基于网络药理学的丹参-川芎药对治疗阿尔茨海默病的作用机制分析
杨梦琳,周小青,伍大华,张运辉,郑彩杏,童天昊
1重庆三峡医药高等专科学校中医学院,重庆 404120;2湖南中医药大学;32011数字中医药协同创新,长沙 410208;4湖南省中医药研究院附属医院,长沙 410006
随着世界人口老龄化增加,阿尔茨海默病(Alzheimer’s disease,AD)的发病率也逐年升高,到2050年估计会增至1.15亿[1],对老年人的健康和生活质量造成重大威胁,给家庭和社会带来巨大压力。由于AD发病隐匿、病程长、临床表现和发病机制复杂,现代西药对其治愈率极低,且易耐药、副作用较多[2,3]。传统中医治疗AD历史悠久,其疗效已获得认可[4]。
清代唐容川《血证论》言“血在上,则浊蔽而不明矣”,王清任《医林改错》云:“凡有瘀血也,令人善忘”。故瘀血是痴呆的重要致病因素,活血化瘀是治疗AD的基本治法之一[5]。Yan等[6]研究中医文献中医药治疗老年痴呆常用药对发现,从活血化瘀立论治疗老年痴呆90首基本方中丹参与川芎配伍频率最高,推测丹参-川芎可能具有较好的治疗AD的作用。本研究应用网络药理学方法,探讨丹参-川芎药对治疗AD的作用机制,以期为阐述活血化瘀法治疗AD的临床治疗提供有价值的信息。
1 材料与方法
1.1 丹参-川芎有效成分库的建立
在TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)和BATMAN-TCM(http://bionet.ncpsb.org/batman-tcm/)中筛选丹参-川芎两味中药的有效成分,根据口服利用度(oral bioavailability,OB)≥30%及类药性(drug-like,DL)≥0.18进行筛选[7]。同时,通过文献检索补充丹参和川芎的其他有效成分。一些有效成分如川芎嗪、阿魏酸虽不满足上述筛选条件,但通过文献检索发现这类有效成分有明确治疗AD的作用,因此这类有效成分也将作为本研究的候选有效成分。例如,川芎嗪能通过作用PI3K/Akt通路,调节Bcl-2、Bax、caspase-3的表达,从而拮抗Aβ25-35诱导的细胞凋亡[8];阿魏酸可通过抗氧化作用降低AD小鼠脑内的氧化应激效应和凋亡相关蛋白的表达,从而发挥对AD的治疗作用[9]。
1.2 有效成分作用靶点库的建立
借助TCMSP数据库、Drug Bank(https://www.drugbank.ca/)数据库和STITCH(http://stitch.embl.de/)数据库查询有效成分的作用靶点。
1.3 AD疾病相关基因检索
在DisGeNET数据库(http://www.disgenet.org/)、TTD数据库(https://bidd.nus.edu.sg/group/cjttd/)和Drugbank数据库中检索AD的靶基因,去除三个数据库重复项。
1.4 丹参-川芎有效成分与AD共同靶点筛选及PPI网络构建
将“1.2”和“1.3”项获得的靶点进行比对,找出共同靶点,将这些共同靶点上传至STRING数据库,构建靶点群蛋白质相互作用(PPI)网络。
1.5 筛选PPI网络的关键靶基因
借助Cytoscape 3.7.1的插件Centiscape 2.2算出PPI网络的点度中心性(degree)、接近中心性(closeness)和中介中心性(betweenness)的中位数, 选择degree、betweenness和closeness均在中位数之上的靶点为“关键靶基因”。
1.6 关键靶点的代谢通路与生物过程分析
丹参-川芎治疗AD靶基因通过Metascape平台进行GO分析和KEGG通路分析。获取丹参-川芎有效成分与AD相关性前20位的生物学过程和前10位的通路。
1.7 体外验证实验
1.7.1 细胞与试剂
PC12细胞(长沙赢润生物技术有限公司,批号2015032007);Aβ25-35(美国Sigma公司,批号053M4804V);Annexin-V/PI凋亡检测试剂盒(KeyGEN BioTRCH,批号20201204);ELISA测定试剂盒(南京建成生物研究所,IL-1β批号Y16036021,TNF-α批号Y17036022,IL-6批号Y14036607);p38MAPK、NF-κBp65引物合成(由上海生工生物工程有限公司提供);qRT-PCR试剂盒(中国北京康为世纪公司,批号50445);总RNA抽提试剂(Trizol)(中国北京康为世纪公司,批号36320)。丹参100g购自湖南中医药大学第一附属医院;川芎100g购自湖南中医药大学第一附属医院,按1∶1称取丹参、川芎,通过水提、蒸发、浓缩成不流动的浸膏,过滤膜灭菌后放至-20 ℃冰箱贮藏。
1.7.2 仪器
Galaxy 170R型二氧化碳培养箱(上海百赛生物技术有限公司);Eppendorf 5804R型低温高速离心机(德国Eppendorf 5810R);Primo Vert型倒置显微镜(德国 Carl Zeiss Jena)等。
1.7.3 细胞培养及分组干预
PC12细胞于37 ℃、95% O2、5% CO2培养箱生长至对数生长期,分为5组。对照组:在不含FBS、PBS的DMEM中孵育24 h;模型组:用Aβ25-35(20 μmol/L)孵育24 h[10];丹参-川芎低剂量组(10 μg/mL)、丹参-川芎中剂量组(20 μg/mL)、丹参-川芎高剂量组(40 μg/mL)孵育24 h。
1.7.4 丹参-川芎对PC12细胞的细胞存活率的影响
每个孔加入1×MTT溶液50 μL,在37 ℃、95% O2、5% CO2培养箱中继续培养4 h;终止培养吸去孔内的培养液,各孔加入DMSO 200 μL,置摇床上低速振荡3 min。酶标仪上测各孔在570 nm吸光度的OD值。

1.7.5 丹参-川芎对PC12细胞炎症反应的影响
采用ELISA法检测各组PC12细胞培养液中IL-1β、IL-6和TNF-α含量,测量步骤严格按照使用说明书进行。
按Annexin V FITC/ PI 试剂盒说明操作,流式细胞仪上检测PC12细胞凋亡率,每组试验重复5次,用凋亡分析软件对数据进行统计。
1.7.7 丹参-川芎对PC12细胞p38MAPK/NF-κB信号通路的影响
荧光定量法检测PC12细胞上清p38MAPK、NF-κB p65mRNA表达,利用Trizol法提取PC细胞总 RNA,反转录合成cDNA,按照试剂盒说明书进行荧光实时定量PCR检测。预变性引物见表 1。
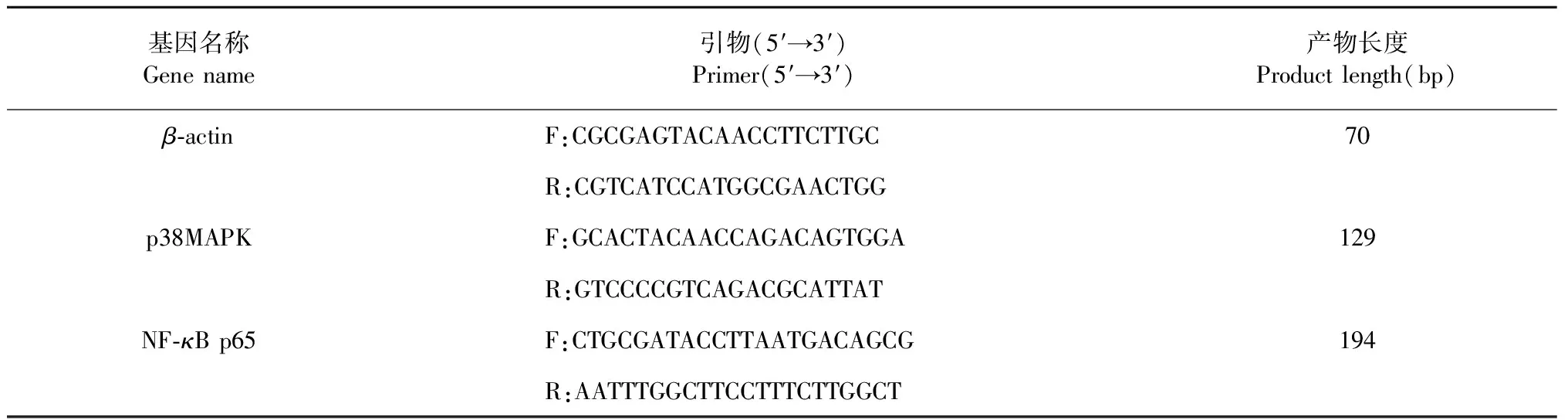
表1 引物序列Table 1 Primer sequence
1.7.8 统计学处理
实验数据结果采用SPSS 24.0软件进行分析,组间比较用单因素方差分析,P<0.05表示差异有统计学差异。
2 结果
2.1 丹参-川芎药对活性成分的收集与筛选
本研究通过TCMSP平台的OB和DL筛选,以及查找相关文献对中药中的特征化合物予以补充,获得丹参-川芎的25个化合物包括丹参15(DS1~15)个,川芎10(CX1~10)个(见表 2)。

表2 丹参-川芎活性成分Table 2 Active ingredients of DS-CX

续表2(Continued Tab.2)
2.2 丹参-川芎药对活性成分-靶点网络
通过Cytoscape 3.7.1获得“活性成分-靶点网络”(见图1)。25个菱形代表丹参-川芎的有效成分,224个三角形代表有效成分靶标,872条边代表了有效成分和靶点两者的互相作用,展现了丹参-川芎多成分、多靶点的特点。
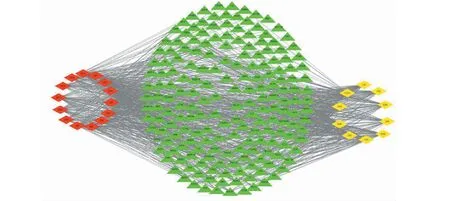
图1 “活性成分-靶点”网络Fig.1 The target network of the active ingredients注:红色菱形:丹参有效成分;黄色菱形:川芎有效成分;绿色三角形:靶点。Note:Red diamond:Active ingredients of DS;Yellow diamond:Active ingredients of CX;Green triangle:Target.
2.3 AD相关靶点
在DisGeNET、TTD和Drugbank数据库查找AD的靶点,共获得2 245个靶点。
第一,教育财政投入理论。马克思主义财政体制思想在很早就表明教育财政投入和教育服务的价值、作用和意义。马克思表示,“随着社会科技进步,知识、教育、计算和阅读等方面的内容,只会在我们的生活中更普遍、更容易、更快速地生产出来……在国民教育普及之后,生活条件较差的人或很少接受教育的人可以成功和容易地接受教育……虽然他们的劳动能力可能不如以前那么好,他们的工资水平还没有达到原来的水平,但他们的劳动能力有了很大的提升,这就是依靠教育做出的贡献……”[2]47。
2.4 PPI网络构建图
在DisGeNET、TTD和Drugbank数据库查找AD的靶点与丹参-川芎作用的靶点有105个交集靶点,这105个靶标可能是丹参-川芎治疗AD的靶基因。通过PPI网络分析寻找关键靶基因(见图2)。
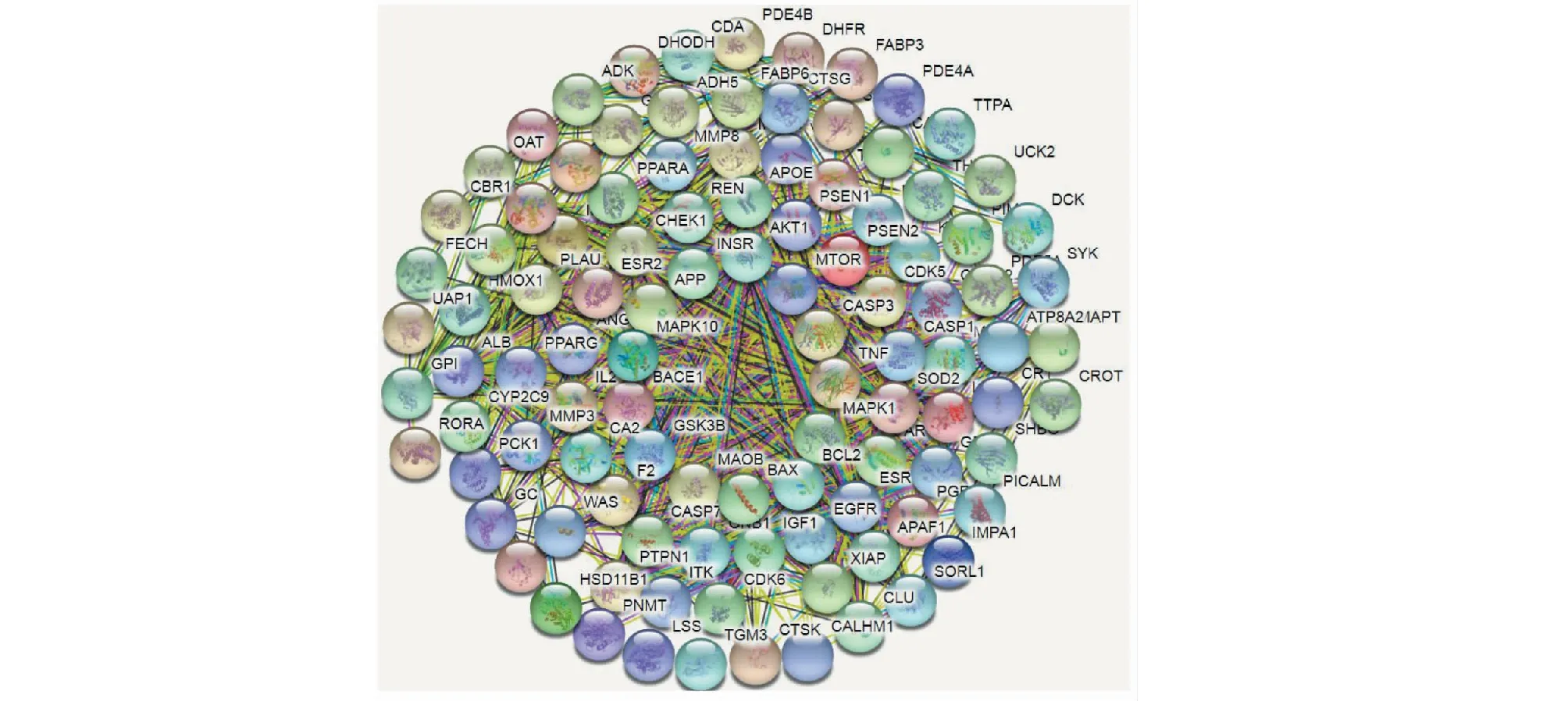
图2 靶基因 PPI网络图Fig.2 PPI network diagram of target gene
2.5 关键靶基因筛选结果
利用Cytoscape 3.7.1的插件Centiscape 2.2算出了网络closeness的中位数为0.53,degree的中位数为15.3,betweenness的中位数为3.48×10-2,closeness、degree和betweenness均在平均值以上的靶点为9个,按次序是MAPK1、MAPK10、APP、AKT1、GSK3β、Caspase-3、MAOB、TNF、MTOR,表示以上9个靶点很可能是丹参-川芎治疗AD的关键靶基因。
2.6 GO功能分析和 KEGG通路分析结果
丹参-川芎治疗AD的105个靶点GO分子功能富集分析结果如图3所示,主要关联炎症反应、凋亡、氧化应激反应、MAPK级联反应等方面。
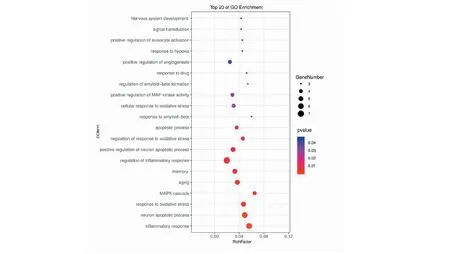
图3 生物过程Fig.3 Biological process
Metascape数据库中的KEGG分析结果如图4所示,从图中可以看出包括MAPK信号通路、NF-κB信号通路、凋亡、TNF信号通路、PI3K-Akt信号通路等,提示丹参-川芎治疗AD的主要作用过程是通过这些信号通路来完成的。
2.7 丹参-川芎对PC12细胞的细胞存活率影响
与对照组对比,模型组PC12细胞的细胞存活率明显降低(P<0.01);与模型组对比,丹参-川芎中、高剂量组的细胞存活率显著升高(P<0.05,P<0.01),提示丹参-川芎能保护PC12细胞(见表3)。
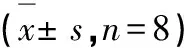
表3 丹参-川芎对PC12细胞存活率的影响Table 3 Effects of DS-CX on the survival rate of PC12 s,n=8)
2.8 丹参-川芎对PC12细胞炎症反应的影响
与对照组对比,模型组PC12细胞IL-1β、IL-6和TNF-ɑ含量均明显增高(P<0.01);与模型组对比,随着丹参-川芎浓度增加,PC12细胞培养液中IL-1β、IL-6和TNF-α含量均明显降低(P<0.05,P<0.01),提示丹参-川芎能抑制PC12细胞的炎症反应(见表4)。
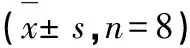
表4 丹参-川芎对PC12细胞炎症反应的影响Table 4 Effect of DS-CX on the inflammation of PC12 s,n=8)
2.9 丹参-川芎对PC12细胞凋亡率的影响
结果见表5,与对照组对比,模型组细胞凋亡率显著升高(P<0.01);与模型组对比,丹参-川芎中、高剂量组的PC12细胞凋亡率显著降低(P<0.05,P<0.01)。
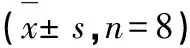
表5 丹参-川芎对PC12细胞凋亡率的影响Table 5 Effect of DS-CX on the apoptosis rate of PC12 s,n=8)
2.10 丹参-川芎对PC12细胞p38MAPK/NF-κB信号通路主要基因表达的影响
与对照组对比,模型组p38MAPK、NF-κB mRNA表达明显升高(P<0.01)。与模型组对比,丹参-川芎各组均能明显降低p38MAPK、NF-κB mRNA的表达水平(P<0.05,P<0.01)(见表6)。提示丹参-川芎可下调p38MAPK/NF-κB信号通路,抑制细胞炎症反应和凋亡,减轻神经元损伤。
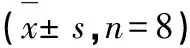
表6 丹参-川芎对PC12细胞p38MAPK/NF-κB的影响Table 6 Effects of DS-CX on p38MAPK/NF-κB in PC12 s,n=8)
3 讨论
AD属中医学之“呆证”、“痴呆”等,老年人五脏功能渐衰,气虚无力推动血行,血液运行不畅,易瘀滞脉络,瘀血阻于脑窍,元神失养,神机失用,终成呆证。如《医学衷中参西录》言:“脑络瘀阻可直接损伤脑髓,使脑窍渐空,灵机记忆渐失,终成呆证。”故瘀血是AD重要致病因素,活血化瘀法是防治AD的重要治法之一。丹参具有活血祛瘀、安神之功效。《滇南本草》曰:“补心定志,安神宁心,治健忘怔忡,惊悸不寐”[11]。川芎具有活血行气,祛风止痛功效。《本草通玄》记载其可“除湿止泻,行气开郁,去瘀生新”。“血大动,则走而不能生;血不动,则止而不能生”,虽川芎辛散,其生血妙在动,不在散。行气开郁,升清阳之气,去头之湿气,善于疏通,可清神生新。二者配伍,可使血行流利,脑络通畅,精得上乘而充髓,血得上行而养脑,以奏活血祛瘀,开窍醒神之效。
本研究通过TCMSP平台的OB和DL筛选,以及查找相关文献对中药中的特征化合物予以补充,获得丹参-川芎的25个化合物,其中丹参的有效成分中丹参酮IIA的活性最高,可以作用32个靶点,而在川芎中活性最高的是川芎嗪,作用靶点达到了27个。研究显示[12,13],丹参酮IIA可抑制小胶质细胞增生,并进一步降低IL-1β、TNF-α炎性细胞因子的表达和抑制Tau蛋白过度磷酸化对抗神经细胞凋亡,从而发挥治疗AD的作用。研究发现[8],川芎嗪可通过作用PI3K/Akt通路,调节Bcl-2、Bax、caspase-3的表达,从而拮抗Aβ25-35诱导的细胞凋亡。
GO富集分析结果表明,“丹参-川芎”药对的作用靶点分布在多种细胞组分中,以胞质为主,通过多种结合方式参与生物进程,包括炎症反应、凋亡过程、氧化应激反应、老化、记忆、MAPK级联反应、神经元凋亡过程的正调控、对炎症反应的调节、积极调节白细胞激活、神经系统发育等等。研究显示[14],脑内炎性反应是AD发病的重要环节。研究证实[15,16],细胞凋亡和氧化应激反应在AD的发生和发展的过程中扮演着极其重要的角色。提示“丹参-川芎”药对可能通过多靶点、多通路发挥治疗AD的作用。为了验证网络药理学的分析结果,本研究选择丹参-川芎对Aβ25-35诱导的PC12细胞的细胞存活率、炎症反应、凋亡率进行了实验验证。结果表明丹参-川芎能显著提高PC12细胞的细胞存活率和抑制PC12细胞的炎症反应及降低PC12细胞的凋亡率,发挥治疗AD的作用。
KEGG富集通路分析表明,居第一位的是MAPK信号通路,居第二位的是NF-κB信号通路。MAPK信号通路在哺乳动物类细胞主要由p38信号通路、ERK信号通路和JNK信号通路组成。研究发现[17],p38在脑组织中表达水平的高低与痴呆的严重程度有极大的关联。研究发现[18],p38MAPK通路可通过促使Bax发生转位及激活Caspase-3活性而参与到神经元细胞凋亡的进程当中。研究表明[19],抑制p38MAPK通路可抑制Aβ1-42诱导的AD模型大鼠脑组织细胞发生凋亡。NF-κB信号通路可参与神经系统中炎症反应、神经元凋亡、多种基因调控的信号转导过程[20]。研究指出[21],p38MAPK与NF-κB关系密切,活化的p38 MAPK能诱使炎症细胞因子的表达从而活化NF-κB,若抑制p38MAPK的表达,也会抑制NF-κB的活化。丹参-川芎可能通过调控p38MAPK/NF-κB信号通路,抑制炎症反应和细胞凋亡,从而延缓AD的发生和发展。
本研究选择丹参-川芎对Aβ25-35诱导PC12细胞的p38MAPK/NF-κB信号通路的调控作用进行网络药理学研究结果的实验验证。实验结果表明丹参-川芎可明显下调p38MAPK/NF-κB信号通路,最终抑制AD的发展。
本研究应用网络药理学研究丹参-川芎对AD的具体作用靶点及分子机制,结果发现丹参-川芎治疗AD是通过多成分、多靶点、多通路协同产生主要的治疗作用,为临床深入研究丹参-川芎治疗AD作用机制提供重要的指导意义。

