无花果叶片多糖抑制胃癌细胞增殖与促进凋亡效应
邓佳丽,李 晓,安玉艳,林泽崑,汪良驹,2*
1南京农业大学园艺学院,南京 210095;2青岛海德坤生物科学研究院,青岛 266200
无花果(FicuscaricaL.)属于桑科榕属,是一种常见的暖温带落叶果树,也是人类驯化栽培最早的果树之一[1]。1990年,南京农业大学与江苏省肿瘤防治研究所合作研究证明,无花果具有明显的抗癌效应[2],全国性的无花果产业开始蓬勃发展起来。现在,无花果除了加工成果酒、果干、果酱等食品外,其医药保健特别是抗癌药用仍然像谜一样吸引人们[3]。只有把这种价值开发利用起来,这种古老的果树才能真正造福于人类。
无花果富含多种医药活性成分,如黄酮[4]、苯甲醛[5]、多糖等[6],其根、茎、叶、果、乳汁均可纳入传统药源。许多研究者致力于从植物中提取天然多糖,认为它们具有提高免疫活性[7]、降血糖[8]、抗肿瘤[9]等医疗功效。在无花果上,也有学者把其抗癌活性归结为多糖组份,在Guo等[10]报道中,无花果果实多糖具有抗氧化活性,且能显著抑制人体肝癌HepG2和胃癌SGC-7901细胞生长。Jiang[11]证实,无花果叶片多糖对人体肺癌细胞A549、宫颈癌细胞Hela、肝癌细胞HepG2均有不同程度的抑制效果。因而,无花果多糖可望用于人体肿瘤防治。但是,无花果品种众多,特性各异,是不是所有品种多糖都具有抑癌活性,需要试验判明。另外,无花果叶片大,数量多,可以制作无花果茶[12]。但是,无花果茶品制作及饮用过程,主要考虑的是口感,很少涉及多糖在人体保健中作用。实际上,经高温热水浸泡的无花果茶汤含有一定量多糖。这是无花果产品开发中有待探讨的问题。前人对无花果多糖的研究多集中于果实,对叶片多糖研究尚少。不同品种间叶片多糖抑癌活性未见报道。为此,本试验首先分离提取纯化三个不同品种不同月份无花果叶多糖,然后,利用MTT法比较了不同来源多糖对人体胃癌SGC-7901细胞增殖的抑制活性,并在此基础上进一步研究无花果叶多糖对癌细胞凋亡效应和机理,以期为无花果品种叶片综合开发利用提供理论依据。
1 材料与方法
1.1 材料
无花果品种由南京农业大学园艺学院汪良驹教授鉴定。2019年7月至11月间,每月于江苏省常州市圣王果蔬有限公司无花果园采摘‘布兰瑞克’和‘玛斯义陶芬’新梢中部成熟叶片,南京市浦口区翔辰家庭农场无花果园采摘‘波姬红’叶片。洗净后,在110 ℃烘箱中杀青10 min,在80 ℃条件下烘干,磨碎成粉,过60目筛,以备多糖提取之用。
1.2 试剂与仪器
1.2.1 试剂
RPMI(Roswell Park Memorial Institute)培养基(Lot No:AF29546226)、1×PBS缓冲液(Lot No:AF29511325)为Hyclone公司产品;胎牛血清FBS(Lot No:2232246)和0.25%胰蛋白酶(Lot No:2120734)来自Gibco公司;细胞培养级别二甲基亚砜DMSO(Lot No:1209M0312)、MTT(Thiazolyl Blue Tetrazolium Bromide)细胞增殖抑制试剂盒(Lot No:20200728)、Annexin V-FITC/PI凋亡检测试剂盒(Lot No:20200825)、细胞周期DNA含量检测试剂盒(Lot No:20200728)、活性氧ROS检测试剂盒(Lot No:20201123)来自北京索莱宝生物科技有限公司;RNA simple Total RNA Kit试剂盒来自天根生化科技有限公司;cDNA反转录试剂盒(Lot No:G492)来自ABM公司。
1.2.2 仪器
CO2培养箱(Thermo Electron Corporation);实时荧光定量PCR仪(Thermo Electron Corporation);倒置显微镜(Leica);流式细胞仪(BD Accuri C6 Ⅱ);多功能酶标仪(BioTek);高速冷冻离心机(安徽中科中佳科学仪器有限公司)。
1.3 方法
1.3.1 多糖制备与精制
取无花果叶干粉1 kg,按1∶15物液比添加去离子水,在80 ℃热水中浸提8 h。真空抽滤收集滤液。经旋转蒸发浓缩后,添加无水乙醇,使乙醇浓度调至75%。4 ℃静置过夜,离心收集沉淀,得到粗多糖。而后,经AB-8大孔树脂和Sevage法脱色除蛋白,3 kD透析袋透析,去除小分子寡糖,保留10个以上单糖组成的多糖,冷冻干燥成固体备用。
1.3.2 细胞培养
人体胃癌SGC-7901细胞由中国药科大学倪孟祥教授提供,培养于含10%FBS的RPMI培养基上,置于37 ℃、5%CO2恒温箱中。
1.3.3 无花果叶多糖对SGC-7901细胞增殖抑制影响
1.3.3.1 多糖品种月份筛选
取对数生长期细胞溶液(浓度为1×105/mL)100 μL加到96孔板中,培养4 h至细胞贴壁,弃上清液。将不同品种不同月份的无花果叶精制多糖(2 mg/mL)溶液添加到细胞培养基,继续培养48 h。弃除培养基后,加入90 μL新鲜培养基和10 μL MTT溶液(5 mg/mL),再培养4 h。弃除孔内溶液后,加入110 μL DMSO,水平晃动10 min,使晶体充分溶解,在酶标仪490 nm处测定吸光度,以(1-OD样品/OD空白)×100%作为癌细胞增殖抑制率。该试验生物学重复3次以上。
1.3.3.2 多糖浓度筛选
将无花果多糖浓度设置为0.5、1、2、4 mg/mL,按照上述方法测定不同浓度多糖对胃癌细胞SGC-7901增殖抑制率。
1.3.4 细胞形态观察
将SGC-7901细胞均匀铺在6孔板中,用不同浓度多糖处理,培养48 h后在倒置光学显微镜(10×物镜)下观察SGC-7901细胞形态变化。
1.3.5 细胞周期分析
收集多糖处理48 h后的培养细胞,用PBS洗涤,经300 g离心5 min,去除上清液,再用PBS将细胞浓度调整为1×105/mL,加入体积分数为70%预冷乙醇500 μL固定,4 ℃过夜。染色前用PBS洗去固定液,250 g离心3 min。在细胞沉淀中加入100 μL RNase A 溶液,充分混匀,37 ℃水浴30 min。再加入400 μL PI染色液混匀,4 ℃避光孵育30 min后使用流式细胞仪在激发波长488 nm红色荧光下检测20 000以上细胞的细胞周期,用Flow Jo分析不同阶段细胞比例[13]。
1.3.6 细胞凋亡检测
收集多糖处理48 h的培养细胞,用预冷的PBS洗涤,300 g离心5 min,弃上清。用1 mL Binding Buffer(1×)悬浮细胞,300 g离心10 min,弃上清。用Binding Buffer重悬细胞,使细胞浓度达到1×106个/mL。吸取100 μL重悬细胞,加入5 μL Annexin V-FITC溶液,混匀后在室内避光处孵育10 min。加入5 μL PI,再孵育5 min。加入PBS至500 μL,轻轻混匀,在流式细胞仪激发光波长488 nm、发射波长515 nm的通道中检测FITC,在发射波长560 nm的通道中检测PI。每次检测10 000个细胞,Flow Jo分析细胞凋亡情况。
1.3.7 细胞活性氧(ROS)含量检测
收集多糖处理48 h后的培养细胞,离心去除培养液,按照1∶1 000比例,用无血清RPMI培养液稀释10 mmol/L的荧光探针DCFH-DA,使荧光探针最终浓度为10 μmol/L。向细胞溶液中加入1 mL稀释后的DCFH-DA溶液,充分混匀,在细胞培养箱中孵育25 min。此期,每隔5 min颠倒混匀,使细胞与探针充分接触。之后,用无血清培养基洗涤,以去除未进入细胞中的探针。最后,将装载好探针的细胞置于流式细胞仪上在激发光波长500 nm,发射波长为525 nm的通道中收集10 000个细胞,Flow Jo分析细胞荧光强度。
1.3.8 细胞凋亡相关基因表达
利用RNA simple Total RNA Kit试剂盒提取SGC-7901细胞RNA,利用微量分光光度计测定RNA浓度,经琼脂糖凝胶电泳检测RNA18S和26S条带完整性。使用cDNA反转录试剂盒将RNA反转为cDNA。以该cDNA为模板,用RT-qPCR法测定p53、Bax、Bcl-2基因以及与细胞周期相关基因表达量,以GAPDH为内参。引物序列如表1。
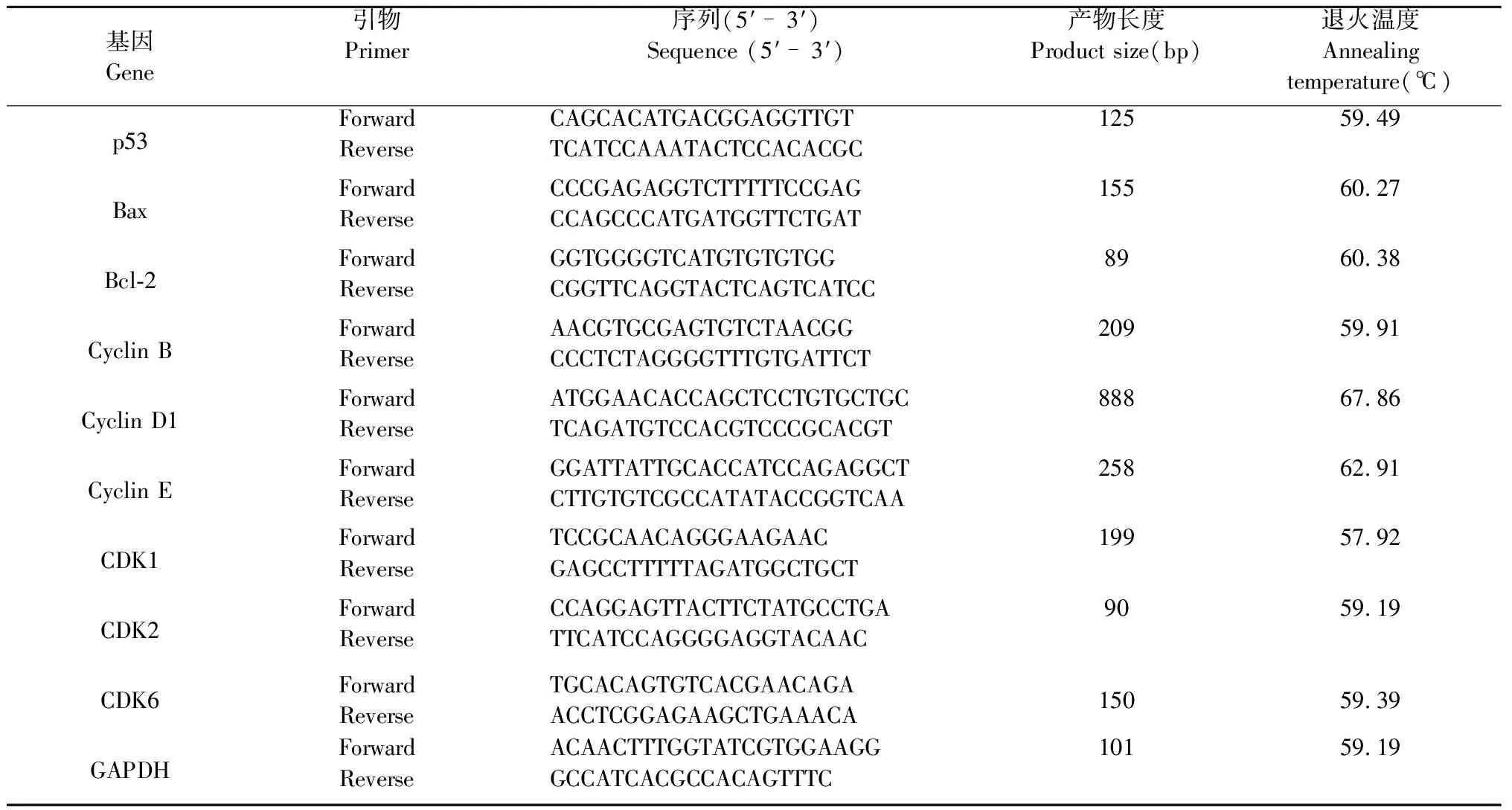
表1 用于 RT-qPCR 分析的引物序列Table 1 Oligonucleotide sequences for primers used in RT-qPCR
1.4 数据处理
所有数据均为3次以上试验重复平均值,并做单因素或双因素方差分析和Duncan氏显著性测验。当P<0.05时,认为差异显著;当P< 0.01时,认为差异极显著。
2 结果与分析
2.1 无花果叶片多糖对人体胃癌SGC-7901细胞增殖的抑制效应
2.1.1 不同品种不同月份多糖对SGC-7901增殖的抑制效应
3个无花果品种7~11月份的叶片多糖在2 mg/mL浓度下处理SGC-7901细胞48 h后,不同处理对细胞生长均表现出一定程度抑制效应(图1)。从双因素方差分析结果看,不同品种多糖对癌细胞增殖抑制有极显著差异(F > F0.01),其中‘布兰瑞克’对癌细胞增殖抑制率最高,总平均值为29.12%,极显著高于后两者(P< 0.01)。‘波姬红’和‘玛斯义陶芬’的平均抑制率分别为21.89%和19.37%,没有显著差异(P> 0.05)。从月份上看,7月和9月对细胞抑制效果最佳,且两者抑制率相似,而8月、10月和11月的抑制率极显著低于7月和9月(P< 0.01)。从具体品种和具体月份上看,布兰瑞克9月多糖的抑制率最高,在2 mg/mL浓度下达到46.67%,极显著高于其他品种或月份(P< 0.01)。其次是7月份‘布兰瑞克’和‘玛斯义陶芬’叶片,其抑癌率分别为32.92%和31.62%。其他月份多糖样品对细胞增殖的抑制率均小于30%,其中,‘玛斯义陶芬’11月份叶片抑制率最低,仅有13.98%。这些结果为不同品种月份无花果叶片采集提供了理论依据。另外,介于‘布兰瑞克’9月份叶片多糖抑癌率最高,可以选作后续试验的试材。
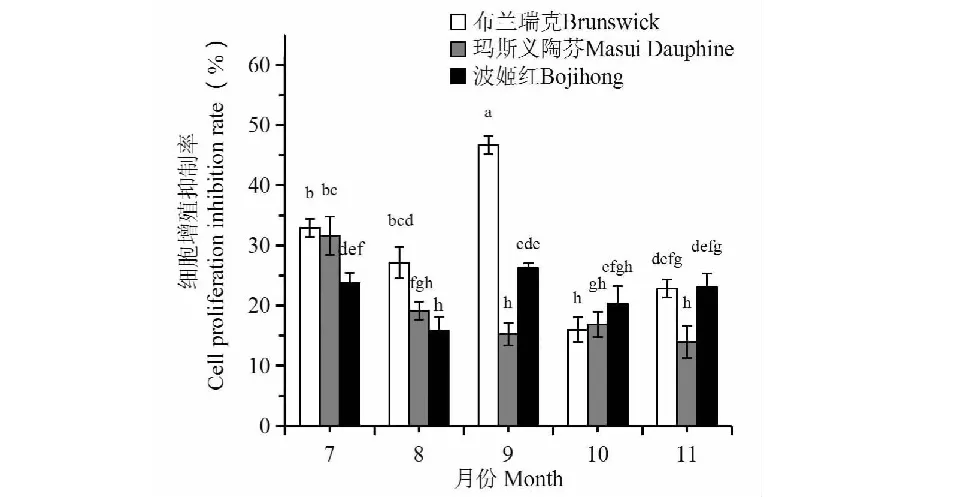
图1 不同品种和不同月份无花果叶片多糖(2 mg/mL) 对SGC-7901细胞增殖的抑制效应Fig.1 Inhibition of leaf polysaccharides in a dosage of 2 mg/mL of three Fig varieties harvested in different months on SGC-7901 cell proliferation注:图中相同字母代表在P = 0.05水平上差异不显著。Note:The same letters in the Figure represent no significant difference at P = 0.05 level.
2.1.2 ‘布兰瑞克’无花果9月份叶片多糖抑制SGC-7901细胞增殖的浓度效应
图2显示,0.5、1、2、4 mg/mL四个浓度‘布兰瑞克’无花果叶片多糖对SGC-7901细胞增殖抑制率呈现出剂量效应。随着多糖浓度增加,细胞增殖抑制率增加,相关系数r= 0.938*,达到P= 0.05显著水平。当多糖浓度达到4 mg/mL时,细胞增殖抑制率为52.92%。
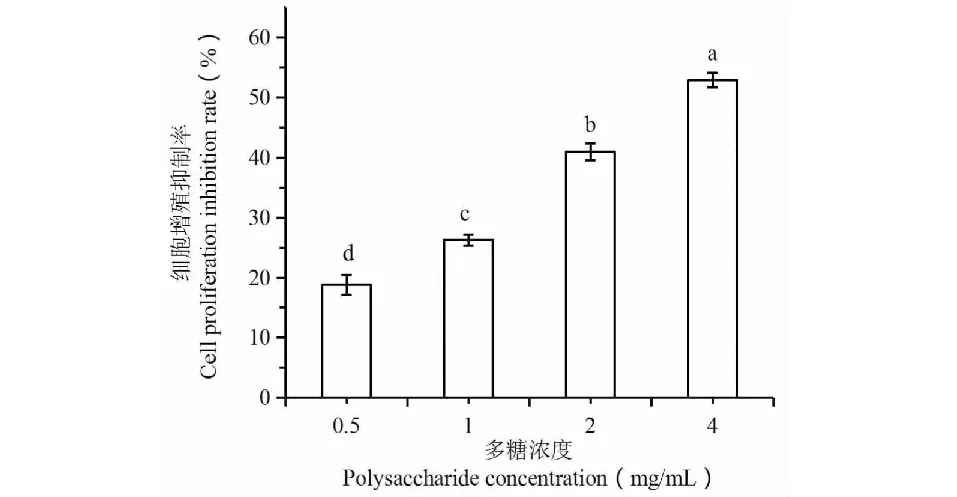
图2 不同浓度无花果多糖对SGC-7901细胞增殖的抑制率Fig.2 Inhibition of Fig polysaccharide in different concentrations on the proliferation of SGC-7901 cell line注:图中不同字母代表在P = 0.05水平上差异显著。Note:The different letters above the bars in the Figure represent significant difference at P = 0.05 level.
2.2 无花果叶片多糖对癌细胞形态的影响
通过倒置显微镜可以观察无花果叶片多糖处理后SGC-7901细胞形态。如图3,经多糖溶液处理48 h后,对照细胞增殖旺盛,细胞密度高,而处理细胞密度随着多糖浓度增加而迅速下降,说明细胞增殖受到显著抑制。其次,经多糖溶液处理的细胞,死亡细胞数量增加,细胞形态从梭形逐渐变圆,细胞粘附性降低,表明无花果多糖导致胃癌SGC-7901细胞死亡。
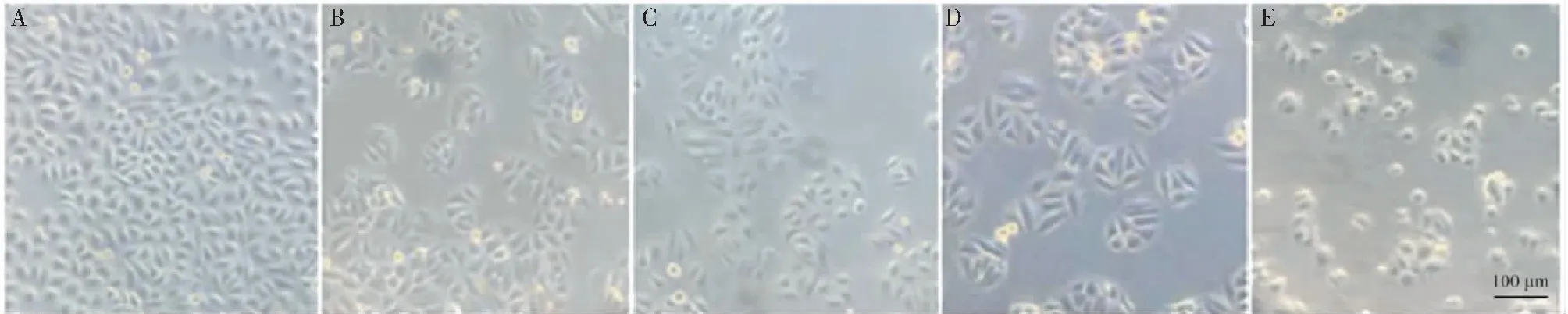
图3 不同浓度无花果多糖处理后SGC-7901细胞形态变化Fig.3 Morphological change of SGC-7901 cells treated by Fig polysaccharide in different concentrations注:A~E分别为0、0.5、1、2和4 mg/mL无花果多糖处理。Note:A-E are 0,0.5,1,2 and 4 mg/mL Fig polysaccharide treatment,respectively.
2.3 无花果叶片多糖阻滞SGC-7901细胞周期效应
癌细胞增殖是通过细胞分裂周期来实现的,细胞周期阻滞意味着细胞增殖受阻。图4为流式细胞仪检测出的SGC-7901细胞周期结果。从中可以看出,随着无花果叶片多糖浓度增加,处于G1期的细胞比例逐渐减少,当多糖浓度达1 mg/L时,差异达到P= 0.05显著水平。相反,处于S期细胞比例随着多糖浓度上升而上升,当浓度为1 mg/L时,差异达到P= 0.05显著水平。如果浓度为2 mg/L时,S期细胞比例比对照高出25.13%,暗示着大量细胞阻滞于S期。与此不同的是,G2期细胞比例在多糖浓度在0~2 mg/L之间,没有显著差异(P> 0.05),只有多糖浓度达4 mg/L时,G2期细胞比例显著高于低浓度多糖处理,暗示着高浓度多糖处理将导致部分细胞周期在G2期受阻。整体上看,无花果叶片多糖处理将SGC-7901细胞周期阻滞在S期,细胞增殖因此受到抑制。
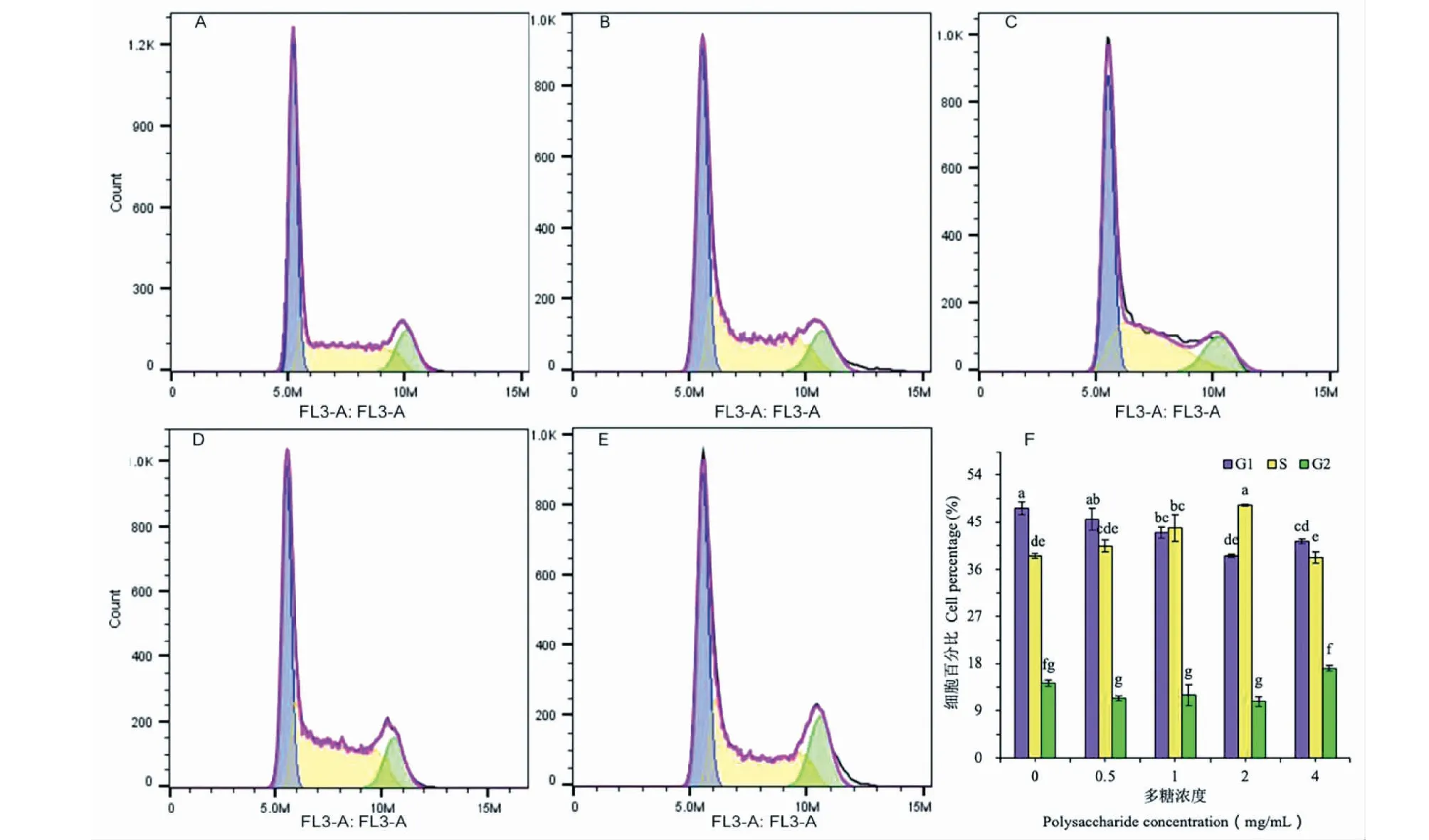
图4 不同浓度无花果多糖对SGC-7901细胞周期的影响Fig.4 Influence of Fig polysaccharide in different concentrations on the cycle of SGC-7901 cells注:A~E分别为0、0.5、1、2和4 mg/mL无花果多糖处理48 h后用流式细胞仪检测出的细胞周期图;F为不同浓度多糖处理后三个细胞周期阶段的细胞所占的百分率,图中相同字母代表在P = 0.05水平上差异不显著。Note:A-E are the cell cycles detected by flow cytometry after Fig polysaccharide treatments in 0,0.5,1,2 and 4 mg/mL,respectively,for 48 h,and F is the cell percentage at different stages of cell cycles.The same letters in the Figure represent no significant difference at P = 0.05 level.
2.4 无花果叶片多糖促进SGC-7901细胞凋亡
为了了解无花果多糖对SGC-7901细胞凋亡的影响,使用Annexin-V/PI试剂通过流式细胞仪对凋亡细胞进行定量分析。结果如图5,其中象限Q1、Q2、Q3、Q4分别代表坏死、凋亡晚期、正常和凋亡早期细胞数量。在不同浓度多糖处理下,凋亡早期细胞百分率与对照相比没有显著差异,但是凋亡晚期细胞百分率随着多糖浓度增加而上升。当多糖浓度为1 mg/mL时,处理比对照高出37.87%(P< 0.01)。当多糖浓度达到4 mg/mL,处理比对照高出150%。另一方面,无花果多糖处理的死亡细胞比例增加,而且这种效应在多糖浓度为0.5 mg/mL就存在(P< 0.05),但是,在1、2、4 mg/mL间没有差异。整体上看,活细胞百分率随着多糖浓度上升而下降。当多糖浓度为1 mg/mL时,处理为对照的91.50%(P< 0.05)。多糖浓度达4 mg/mL时,处理降为对照的74.03%。这些结果表明,无花果多糖显著促进SGC-7901细胞凋亡,降低活细胞比率。
2.5 无花果叶片多糖对SGC-7901细胞活性氧含量的影响
图6结果显示,不同浓度无花果叶片多糖处理促进SGC-7901细胞内ROS含量增加。当多糖浓度为0.5 mg/mL时,处理细胞平均荧光强度比对照高出2.32倍;当多糖浓度为4 mg/mL时,处理比对照高出5.58倍。显然,无花果叶片多糖诱导SGC-7901细胞ROS含量急剧上升是其诱导细胞凋亡的重要原因。
2.6 无花果叶片多糖对SGC-7901细胞凋亡相关基因表达的影响
Bax是一种促细胞凋亡基因。图7A结果显示,无花果叶多糖处理显著促进SGC-7901细胞Bax表达上调。这种效应在多糖浓度为0.5 mg/mL时就显著存在(P< 0.05)。当浓度为2 mg/mL时,处理基因相对表达量比对照高出95%。类似地,p53为人体抑癌基因。该基因表达可以抑制癌细胞生长。图7A显示,除了无花果叶片多糖浓度为0.5 mg/mL时,p53的相对表达显著降低对照外,其他浓度多糖处理的p53相对表达量均显著高于对照(P< 0.05),说明一定浓度无花果多糖处理可以上调p53表达。相反,Bcl-2为抑制细胞凋亡基因。随着无花果多糖浓度上升,SGC-7901细胞内Bcl-2表达量逐渐下降。当多糖浓度为1 mg/mL时,处理效应达到P= 0.05显著水平。当多糖浓度达4 mg/mL时,处理Bcl-2相对表达量只有对照的1/4,说明无花果多糖处理抑制了促癌基因表达。
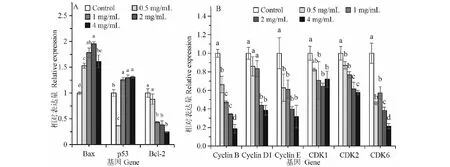
图7 不同浓度无花果多糖处理对SGC-7901细胞基因表达的影响Fig.7 Effect of Fig polysaccharide in different concentrations on the gene expressions of SGC-7901 cells注:A:细胞凋亡相关基因;B:细胞周期相关基因。同一基因相同字母代表在P = 0.05水平上差异不显著。Note:A:Apoptosis-related genes;B:Cell cycle-related genes.The same letters in each gene represent no significant difference at P = 0.05 level.
为阐明无花果多糖抑制SGC-7901细胞增殖效应与细胞周期相关基因表达的关系,本试验检测了细胞周期蛋白(Cyclins)以及细胞周期蛋白依赖激酶(Cyclin-dependent kinase,CDKs)编码基因的相对表达量,结果如图7B。随着无花果叶片多糖浓度上升,两类基因表达量均呈下降趋势。其中,Cyclin B在mRNA水平下表达量受多糖浓度调节的效应最为明显。当多糖浓度为0.5 mg/mL时,处理组表达量降为对照的66.21%;当多糖浓度为4 mg/mL时,只有对照的18.71%。Cyclin D1基因表达对多糖浓度也比较敏感,但是只有多糖浓度达2 mg/mL时,处理效应才达到P= 0.05显著水平。此时,处理的相对表达量只有对照的44.00%。类似地,Cyclin E基因对无花果多糖处理也相当敏感,而且在0.5 mg/mL多糖处理时,相对表达量降至对照的62.81%(P< 0.05)。此后,随着多糖浓度增加,下降幅度更大。当多糖浓度为4 mg/mL时,处理组仅为对照的31.86%,但由于标准误较大,它与0.5 mg/mL处理间没有显著差异。另一方面,无花果叶片多糖抑制SGC-7901细胞周期蛋白依赖激酶基因CDKs表达。从图7B可以看出,无论是CDK1,还是CDK2或者CDK6,经多糖处理后,基因表达量均明显下降。就CDK1而言,0.5 mg/mL多糖处理的抑制效应没有达到P= 0.05显著水平,但当多糖浓度达到1 mg/mL后,处理组基因表达量只有对照的70.86%(P< 0.05)。对CDK2来说,基因表达水平随着多糖浓度上升而下降。0.5 mg/mL多糖处理的效应就达到P= 0.05显著水平。当多糖浓度达到2或4 mg/mL时,基因表达水平约为对照的60%。类似地,基因CDK6表达对无花果叶片多糖处理也非常敏感。当多糖浓度为0.5 mg/mL时,CDK6的相对表达量为对照的46.37%(P<0.05)。当多糖浓度升到4 mg/mL时,相对表达量仅为对照的21.42%。这些结果说明,无花果叶多糖显著降低细胞周期相关基因表达。这对细胞周期、细胞增殖和细胞凋亡来说是至关重要的。
3 讨论
业已证明,无花果多糖具有体外抗氧化活性[10],能够降血糖[8],增强免疫力[7],并具有抗肿瘤[11]等医药功效。Jiang[11]提出,无花果多糖对宫颈癌Hela和肝癌HepG2细胞都有明显抑制活性,但对肺癌A549细胞的抑制活性较弱,说明无花果多糖对不同肿瘤细胞抑制效应不同。Guo等[10]证明,无花果多糖不同组分对人体肝癌HepG2、胃癌SGC-7901、结肠癌SW1116细胞均有明显的抑制作用。其中2 mg/mL多糖组分-3对胃癌7901细胞的抑制率为54.49%。本文结果与此类似。当‘布兰瑞克’品种叶片多糖浓度为2 mg/mL时对SGC-7901细胞增殖抑制率为46.67%(见图1);浓度为4 mg/mL时,抑制率达52.92%(见图2)。再次证明,无花果多糖具有明显的抑癌活性,适当浓度的多糖处理可以显著抑制癌细胞增殖,导致细胞死亡(见图3)。
前人有关无花果多糖及其抑癌活性研究很少涉及品种和采样时间。但是,植物内含物活性会因品种和时间的不同而不同。Zhang等[14]发现,4个品种无花果叶片提取物均有降血糖作用,但不同品种对肝糖原的影响存在差异。本试验也获得类似结果。我们发现,不同无花果品种、不同采集时间的叶片多糖对SGC-7901细胞抑制活性存在明显差异(见图1)。在2 mg/mL试验体系中,‘布兰瑞克’的平均抑制率最高,‘波姬红’次之,‘玛斯义陶芬’最后,说明‘布兰瑞克’品种叶片更适合于多糖开发。另外,该品种9月份叶片多糖抑癌活性最高,7~8月其次,10~11月最次。这些结果为无花果叶片多糖抑癌功效的开发利用以及原料选择提供了一定理论依据。
前人关于无花果多糖抗肿瘤的机理研究侧重于抗氧化活性[10]或者免疫功能提高[7,11]。然而本文观察到,无花果多糖处理将引起SGC-7901细胞内ROS含量上升。这一效应在0.5 mg/mL无花果多糖处理后便显著存在,并且随着多糖浓度上升而上升。当多糖浓度为4 mg/mL时,处理细胞ROS含量比对照高出5.5倍(见图6),说明无花果多糖抑癌活性可能是通过诱导癌细胞ROS上升来促进癌细胞凋亡的。这一观点也符合目前流行的看法。比如,Halliwell[15]提出,过量ROS会导致细胞膜、脂质、DNA的氧化损伤。Brosche等[16]认为,氧化应激与细胞凋亡有着密切相关性。Ding等[17]利用外源H2O2证明,活性氧能诱导细胞凋亡。最近有人证明,黄芪多糖诱导人胃癌MGC-803凋亡过程中能诱导细胞ROS增加[18]。据此看来,本文观察到的无花果多糖诱导ROS上升是其抑癌的重要方面。
本试验首次观察到无花果多糖诱导SGC-7901胃癌细胞凋亡(见图3)。经处理细胞其活细胞数量随着多糖浓度上升而下降,凋亡晚期和死细胞数量显著增加(见图5)。进一步观察表明,无花果叶片多糖抑癌效应可能与其抑制细胞周期有关。从图4可以看出,无花果多糖对SGC-7901细胞周期的抑制效应主要体现在S期。随着多糖浓度上升,停滞在S期的细胞数量显著上升。曾报道,柑桔皮多糖对移植性腹水瘤H22细胞增殖的抑制作用也表现在细胞周期的S期[19],枸杞多糖抑制宫颈癌Hela细胞周期则在S期和G2/M期[20]。以上结果说明,细胞周期受阻,特别是S期DNA合成受阻可能是无花果多糖抑制癌细胞增殖的重要机制。
业已明确,细胞周期蛋白(Cyclins)以及细胞周期蛋白依赖激酶(Cyclin-dependent kinases,CDKs)在细胞周期中起到核心调控作用[21]。不同生物体内存在着几十种Cyclins,能与不同种类CDKs构成Cyclin-CDK复合体,在细胞周期的不同阶段起到激酶作用,诱发蛋白磷酸化,调控细胞周期进程[22]。CDK2/Cyclin E复合体在G1晚期和S期高度表达。如果CDK2表达减弱,则S期启动受阻[23]。Cyclin D1/CDK4/CDK6蛋白复合物处在CDK2/Cyclin E复合物上游,也对G1/S期细胞分裂起调控作用[24]。Zhong等[25]发现,桑黄多糖抑制人体结肠癌HT-29细胞增殖时,大量细胞停滞在S期,同时,CDK2和Cyclin E蛋白表达水平下降。Ma等[13]研究表明,山楂多糖抑制人体结肠癌HCT116细胞增殖时也能诱导CDK1、CDK2、Cyclin A1、Cyclin D1和Cyclin E1基因表达下调。本试验结果与此类似。我们观察到无花果多糖抑制人体胃癌SGC-7901细胞周期停滞于S期,同时细胞周期蛋白基因表达显著下调(见图7B)。经无花果多糖处理的SGC-7901细胞CDK1、CDK2、CDK6、Cyclin B、Cyclin D1和Cyclin E基因表达显著下降(见图7B)。也许,正是细胞周期蛋白编码基因表达受抑,无花果多糖阻滞细胞周期,从而抑制癌细胞增殖。
除了上述Cyclins和CDKs外,无花果叶片多糖处理还影响到抑癌基因p53和Bax以及促癌基因Bcl-2的表达(见图7A)。在这三个基因中,Bax与Bcl-2属于同一基因家族,其中,Bcl-2促进细胞周期,而Bax与Bcl-2形成二聚体,当Bax高表达时,Bax会自身形成同源二聚体促进细胞凋亡[26]。曾报道,白花蛇舌草多糖处理HepG2细胞导致Bcl-2基因表达量下降[27];生姜多糖处理HepG2细胞导致Bax和p53等基因表达上调,同时下调Bcl-2基因表达,诱导细胞凋亡[28]。我们把无花果多糖浓度、SGC-7901细胞增殖抑制率与Bax、Bcl-2以及p53相对表达量做两两相关分析后发现,无花果多糖浓度与增殖抑制率的相关系数r= 0.938*,细胞增殖抑制率与Bcl-2相对表达量的相关系数r= -0.932*,但其它几项指标之间的相关性没有达P= 0.05显著水平。这暗示,虽然无花果多糖能够诱导抑癌基因Bax和p53表达上调,但从浓度效应上看,促癌基因Bcl-2表达下调可能更为重要。
综上所述,本文分析了不同品种不同月份无花果叶多糖对人体胃癌SGC-7901细胞增殖的抑制效应,发现‘布兰瑞克’无花果品种9月份叶片多糖的抑制率最高。随着多糖浓度上升,癌细胞增殖受抑,密度和粘附性下降,细胞形态从梭形变为圆形,活细胞减少,死亡细胞和凋亡晚期细胞比例上升。抑癌机理研究表明,无花果叶多糖将细胞周期阻滞在S期以及少量的G2期,促癌基因Bcl-2以及细胞周期相关基因(Cyclins和CDKs)表达下调,抑癌基因(Bax和p53)表达上调,细胞内活性氧积累增加。这些都是无花果多糖促进癌细胞凋亡的重要原因。这些结果为无花果叶片采集与抗癌药物开发提供了一定理论依据。另外,目前已经开发出的无花果茶[12],主要是以叶片为原料,在热水冲泡过程中应该可以把无花果多糖浸提出来,但是它们是否具有抑癌活性,还有待进一步研究。

