后腹腔镜下肾癌根治术对患者炎性反应指标、肾功能指标、肿瘤标志物的影响△
赵小磊,李松,常俊锴,徐文超
河南大学淮河医院泌尿外科,河南 开封 475000
肾癌是指起源于肾实质泌尿小管上皮系统的一种恶性肿瘤,可对患者的肾功能造成严重损害,随着病情进展还可能向肾外转移,最终危及患者的生命安全。目前肾癌的形成与进展机制尚未完全清晰,研究多认为与遗传、环境、相关慢性病史及不良生活习惯相关。55%左右的肾癌患者早期无典型表现,多于健康体检时发现,有症状者则多见于腰痛、血尿,较少患者因腹部可触及肿块而就诊。目前对于局限性肾癌与局部进展性肾癌多采用手术治疗,以往肾癌根治术于开腹直视下进行,但其手术创口较大,切缘精准度欠佳,在一定程度上限制了其临床应用。近年来,腔镜技术开始广泛应用于临床治疗中,腹腔镜下肾癌根治术极大地减轻了手术创伤,使老年、体弱等患者亦可耐受,手术切缘较精准,临床疗效较理想,且手术安全性较高,术后恢复较快。腹腔镜肾癌根治术主要包括经腹腔与经后腹腔两种入路术式,后腹腔入路手术对腹腔内结构与其他器官影响较小,有利于患者术后肠道功能的恢复,但后腹腔镜在肿瘤直径较大、粘连较广泛的肾癌患者能否达到治疗要求,仍存在一定争议。本研究旨在客观评估后腹腔入路的腹腔镜肾癌根治术的临床疗效及其对患者术后炎性反应的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2018 年1 月至2020 年12 月于河南大学淮河医院就诊的肾癌患者。纳入标准:①经病理组织学检查确诊为肾癌,且临床分期为T期;②对侧肾功能正常;③年龄≥18 岁;④围手术期相关资料完整。排除标准:①合并其他恶性肿瘤;②合并肾脏其他器质性病变;③处于其他手术或创伤后14 天内;④处于心脑血管不良事件急性期、感染性疾病急性期、各种慢性炎性疾病急性发作期;⑤有开腹术或腹腔镜手术禁忌证,包括凝血功能异常、心脏或呼吸功能不全、内疝、腹腔广泛粘连、胸腔内严重感染、广泛性腹膜炎、膈疝、严重全身性感染等;⑥合并免疫功能异常或免疫系统疾病。根据纳入与排除标准,共纳入102 例肾癌患者,依据手术方式分为开腹组和腔镜组,每组51 例,开腹组患者接受传统开腹术治疗,腔镜组患者接受后腹腔镜下肾癌根治术治疗。开腹组中男32 例,女19例;年龄38~76 岁,平均(55.69±8.47)岁;肿瘤直径5.71~10.43 cm,平均(7.61±1.23)cm;患侧位置:左侧27 例,右侧24 例;病灶位置:肾上极25 例,肾下极20 例,肾中部6 例;临床分期:T期26 例,T期15 例,T期10 例。腔镜组患者中男31 例,女20 例;年龄36~78岁,平均(56.12±8.58)岁;肿瘤直径5.32~10.64 cm,平均(7.54±1.21)cm;患侧位置:左侧28例,右侧23 例;病灶位置:肾上极24 例,肾下极19例,肾中部8 例;临床分期:T期24 例,T期16 例,T期11 例。两组患者的性别、年龄、肿瘤直径等临床特征比较,差异均无统计学意义(P
﹥0.05),具有可比性。1.2 治疗方法
1.2.1 开腹组 患者采用传统开腹肾癌根治术治疗,于全身麻醉下进行,取健侧卧位。常规消毒铺巾后,于肋缘下方做一长约18 cm 的手术切口入路,逐层切开皮肤、腹直肌的前后鞘达肾周筋膜,游离肾动静脉等,逐一结扎后,游离肾周脂肪、肾蒂,结扎动脉。于肿瘤病灶边缘0.5~1.0 cm 处完整切除肿瘤,以生理盐水充分冲洗后,确定无活动性出血,缝合切口,留置引流管。
1.2.2 腔镜组 患者采用后腹腔镜下肾癌根治术治疗,于全身麻醉下进行,取健侧卧位。常规消毒铺巾后,于腋后线第十二肋下缘约2 cm 处做切口,于扩张腹膜后间隙入路,置入气囊;于腋中线骼嵴上方穿刺置入直径为10 mm 的Trocar,腋前方肋下缘处穿刺置入直径为12 mm 的Trocar,腋后线的第十二肋下缘处穿刺置入直径5 mm 的Trocar,建立气腹。使用超声刀对腹膜外的脂肪进行清理,充分显露肾周筋膜,定位肾门后,游离肾脏动静脉等,剥离输尿管,以Hem-o-lock 夹双重处理后离断,切除病灶组织置于标本袋中,电凝止血,确认无活动出血后,留置腹膜后引流管,撤出腹腔镜器械,关闭切口与穿刺点,妥善包扎。
1.3 观察指标
①观察两组患者的手术指标,包括手术时间、术中出血量、下床活动时间、肠道功能恢复时间、术后拔管时间、恢复进食时间、住院时间。②分别于术前、术后3 天采集全部患者空腹外周肘静脉血样5 ml,静置后放入离心机,3000 r/min 离心10 min取血清,离心半径12 cm,置于-20 ℃环境储存,检测两组患者炎性反应指标[C 反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、红细胞沉降率(erythrocyte sedimentation rate,ESR)]、肾功能指标[血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)]、肿瘤标志物[癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原50(carbohydrate antigen 50,CA50)]、和血常规指标[血小板(platelet,PLT)、白细胞(white blood cell,WBC)、白蛋白(albumin,ALB)、血红蛋白(hemoglobin,Hb)]。采用酶联免疫吸附法检测CRP、TNF-α、IL-6 水平;采用化学发光免疫法检测CEA水平,放射免疫法检测CA50 水平;使用全自动生化分析仪检测BUN、Cr 水平;采用血沉仪按魏氏法检测ESR;血小板聚集试验检测PLT 水平,使用全自动血球计数仪检测WBC、ALB、Hb水平。③比较两组患者术后并发症的发生情况,包括切口感染、肾血肿、乳糜漏、肠梗阻、腹膜损伤、腰静脉损伤。
1.4 统计学方法

2 结果
2.1 手术指标的比较
腔镜组患者均无中转开腹病例。两组患者的手术时间比较,差异无统计学意义(P
﹥0.05);腔镜组患者术中出血量明显低于开腹组,下床活动时间、肠道功能恢复时间、术后拔管时间、恢复进食时间、住院时间均明显短于开腹组,差异均有统计学意义(P
﹤0.01)。(表1)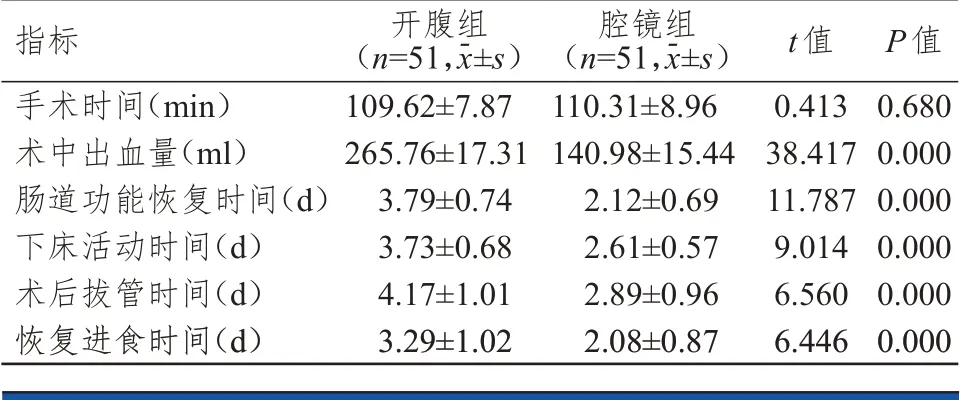
表1 两组患者手术指标的比较
2.2 炎性反应指标的比较
术前,两组患者血清CRP、TNF-α、ESR、IL-6 水平比较,差异均无统计学意义(P
﹥0.05)。术后3天,两组患者血清CRP、TNF-α、ESR、IL-6 水平均高于本组术前,且腔镜组患者上述指标水平均低于开腹组患者,差异均有统计学意义(P
﹤0.05)。(表2)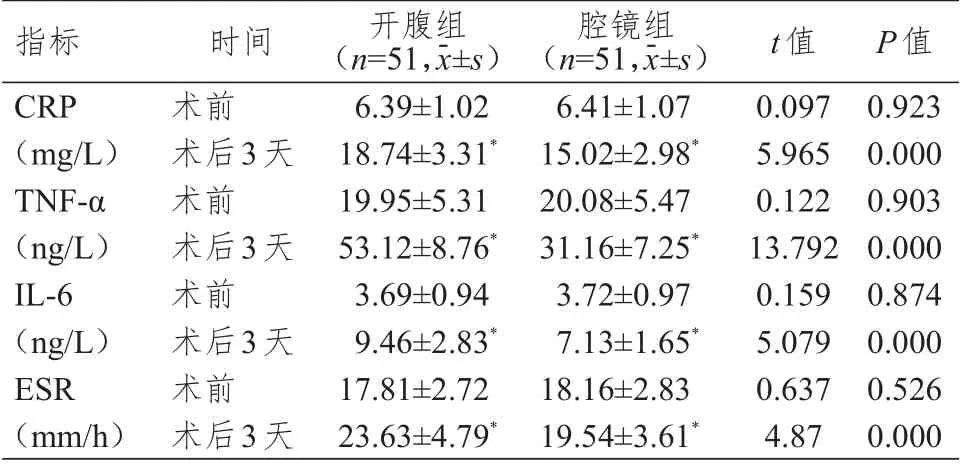
表2 术前、术后3 天两组患者炎性反应指标的比较
2.3 血常规指标水平的比较
术前,两组患者WBC、Hb、PLT、ALB 水平比较,差异均无统计学意义(P
﹥0.05)。术后3 天,两组患者WBC 水平均高于本组术前,Hb、PLT、ALB水平均低于本组术前,且腔镜组患者WBC 水平低于开腹组患者,Hb 水平高于开腹组患者,差异均有统计学意义(P
﹤0.05)。术后3 天,两组PLT、ALB水平比较,差异均无统计学意义(P
﹥0.05)。(表3)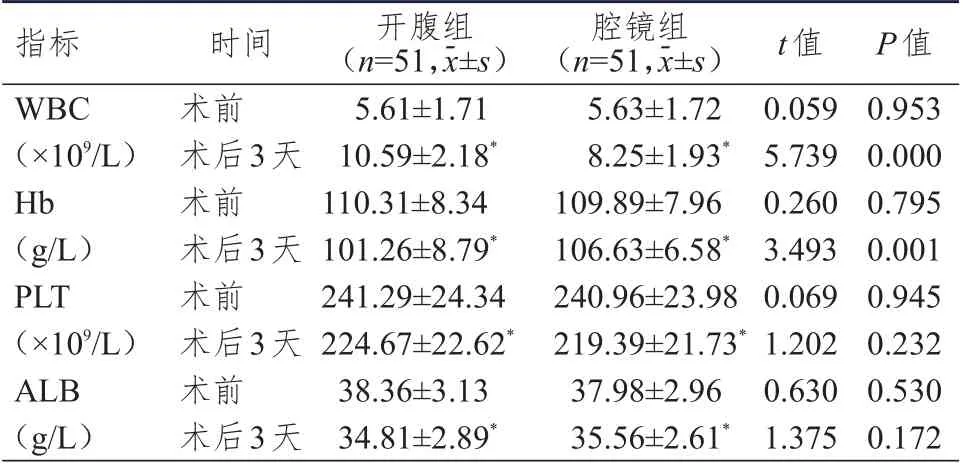
表3 术前、术后3 天两组患者血常规指标水平的比较
2.4 肾功能指标与血清肿瘤标志物水平的比较
术前,两组患者BUN、Cr、CEA、CA50 水平比较,差异均无统计学意义(P
﹥0.05)。术后3 天,两组患者BUN、Cr、CEA、CA50 水平均低于本组术前,且腔镜组患者上述指标水平均低于开腹组患者,差异均有统计学意义(P
﹤0.05)。(表4、表5)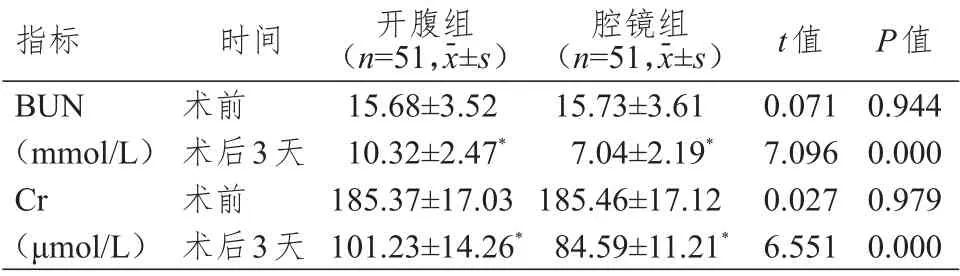
表4 术前、术后3 天两组患者肾功能指标的比较
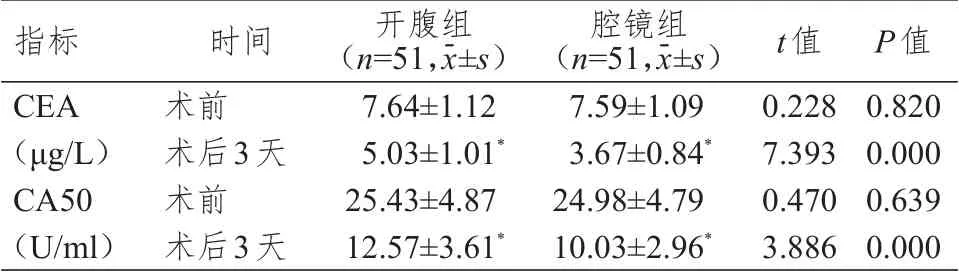
表5 术前、术后3天两组患者血清肿瘤标志物水平的比较
2.5 术后并发症发生情况的比较
腔镜组患者术后并发症总发生率为11.76%(19/51),明显低于开腹组患者的37.25%(6/51),差异有统计学意义(χ
=8.955,P
=0.003)。(表6)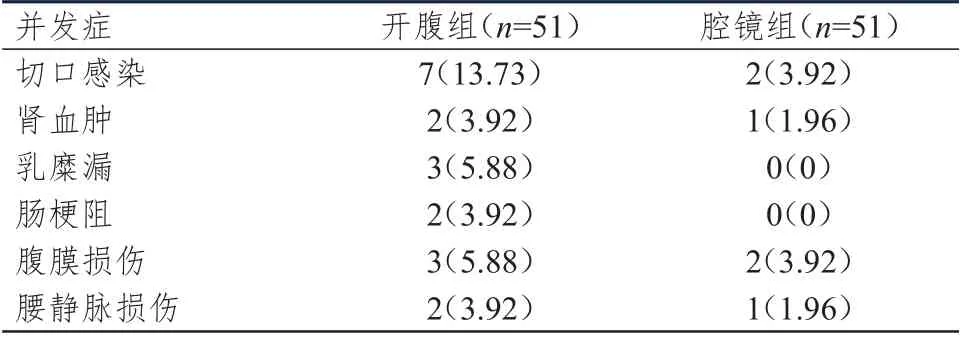
表6 两组患者的术后并发症发生情况[n(%)]
3 讨论
肾脏是人体重要的排泄器官,肾癌发生后可对肾功能造成严重损伤,从而导致机体代谢毒素潴留,可诱发机体活化维生素D、促红细胞生成及分泌肾素等功效异常降低甚至丧失。肾癌对放化疗敏感性低,且免疫治疗的总有效率也仅为15%左右,外科手术为肾癌的治疗重要方式,手术治疗的局限性使肾癌患者术后远处转移率高达33%。传统肾癌根治术于开腹直视下施术,手术创口大,术中出血量多,术后并发症也较多,导致部分患者难以耐受,从而在一定程度上限制了该术式的应用。临床上对于肾癌是否能够通过腹腔镜治疗仍存有一定争议,当肾癌病灶最大直径﹥7 cm,且周围粘连较严重时可导致术中游离周围血管的难度较高,术中大出血风险较高,不适宜采用腹腔镜手术治疗。但随着腹腔镜技术的不断发展,临床已经有肾癌直径超过21 cm 采用腹腔镜手术成功治疗的案例。因此,目前多认为肾癌病灶无癌栓、大血管无侵袭时,无论肿瘤的大小均可通过腹腔镜下肾癌根治术进行治疗。腹腔镜肾癌根治术通常采用经腹腔与经后腹腔两种入路,其中后腹腔镜肾癌根治术,进入肾门更为便捷,肾蒂处理难度较低,尤其适用于肥胖患者,可更好地避免腹部脂肪对手术操作的干扰,病灶定位更为准确。后腹腔镜手术以后腹腔间隙入路,对于腹腔内的脏器损伤较小,因此术后肠道的并发症较轻、肠道功能更易恢复。后腹腔镜下肾癌根治术处理肾动脉、静脉的时间更短,能够缩短手术时间。
本研究纳入的肾癌患者临床分期为T期,腔镜组患者中无中转开腹病例,说明后腹腔镜下施术能够达到传统开腹手术的效果,而且腹腔镜可根据术中情况随时调整放大倍数,从而提高了手术切缘的精准度。本研究结果表明,术后3 天,腔镜组患者血清CEA、CA50 水平均低于开腹组,提示后腹腔镜下肾癌根治术能够有效降低患者血清肿瘤标志物表达水平。腔镜组患者术中出血量明显低于开腹组,下床活动时间、肠道功能恢复时间、术后拔管时间、恢复进食时间、住院时间均明显短于开腹组,提示后腹腔镜手术具有手术创口小、术中出血量低、腹腔暴露微小,对腹腔组织的干扰更小,因此患者术后恢复快。腔镜组患者术后肾功能优于开腹组,且术后并发症发生率明显低于开腹组,也说明后腹腔镜手术安全性更高,可更好的保留患者肾功能。术后3 天,两组患者CRP、TNF-α、ESR、IL-6、WBC 水平均高于本组术前,提示手术切除操作可诱发患者发生不同程度的术后炎性反应,这主要与手术切除的损伤、开腹术术中腹腔暴露等相关;但术后腔镜组患者CRP、TNF-α、ESR、IL-6、WBC 水平均低于开腹组患者,提示后腹腔镜手术因创伤微小、切缘精准对周围组织损伤较小,从而减轻了患者术后炎性反应程度。腔镜组患者术后Hb 高于开腹组,主要是由于患者术中出血量小且术后肾功能恢复更为理想。
综上所述,后腹腔镜下肾癌根治术具有更为理想的临床疗效,能够减轻患者术后炎性反应程度,更好的保留患者肾功能,促进患者术后恢复,且手术安全性更高。

