阿帕替尼联合化疗治疗经一线以上化疗后进展的晚期恶性肿瘤的临床研究△
王娜,谢骥,王涛,周亚丽,周思妤,赵倩格,赵昌波,李婷,张燕平,王婷,宋飞雪#
1兰州大学第二医院肿瘤内科,兰州 730000
2兰州大学第二临床医学院,兰州 730000
恶性肿瘤是中国居民死亡的主要原因之一,其发病率及病死率均逐年增加,随着医疗技术的进步、医保政策的普及和就医率的提高,恶性肿瘤的诊断率不断提高。目前恶性肿瘤的治疗疗效较以前已有很大提高,但大部分恶性肿瘤(如胃癌、肺癌、结直肠癌等)的早期症状不典型,发现时多数已进展至晚期,治疗效果欠佳,复发率和转移率较高,患者生活质量较低。恶性肿瘤的早期治疗以手术为主,部分肿瘤(如头颈部肿瘤、宫颈癌等)的治疗以放疗为主,中晚期肿瘤的治疗方法包括手术、化疗、放疗、靶向治疗、免疫治疗等综合治疗。在真实世界的临床研究中,中晚期肿瘤患者的手术率较低,放疗疗效欠佳,主要以化疗为主,驱动基因阳性的非小细胞肺癌等恶性肿瘤可选择靶向治疗,大部分中晚期肿瘤以化疗为主。虽然近年来程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)/程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也 称PD-L1)抑制剂应用于恶性肿瘤的治疗较以前明显增多,但其费用较高,有效率较低,而且需更精准地筛选获益人群,因此迫切需要寻找多靶点以及对多种肿瘤有效的药物。目前抗血管生成药物贝伐珠单抗、阿帕替尼等均显示了良好的疗效,阿帕替尼为口服靶向药物,其抗肿瘤效果好,在临床中的应用更加广泛,它是全球第一个在晚期胃癌中被证实有效的小分子抗血管生成靶向药物,其可以高度选择性竞争细胞内血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的腺苷三磷酸(adenosine triphosphate,ATP)结合位点,阻断下游信号转导通路,抑制肿瘤新生血管生成。因阿帕替尼口服方便且患者依从性好,美国国立综合癌症网络及中国临床肿瘤学会指南均推荐其作为胃癌的三线治疗药物。在临床应用中发现,很多其他恶性肿瘤患者一线以上使用阿帕替尼联合化疗可取得较二线单纯化疗更好的疗效,同时不良反应可耐受。本研究探讨了阿帕替尼联合化疗治疗经一线以上化疗后进展的恶性肿瘤的疗效及安全性,现报道如下。
1 对象与方法
1.1 研究对象
选择2016 年7 月至2020 年6 月于兰州大学第二医院经一线以上化疗后进展的100 例晚期恶性肿瘤患者。纳入标准:①经病理学检查确诊为晚期恶性肿瘤;②预计生存时间﹥6 个月;③美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分≤2 分,无其他严重基础疾病及并发症;④心、肺、肝、肾、脑功能正常;⑤经一线以上化疗后病情进展;⑥具有至少一个可测量的肿瘤靶病灶;⑦无肿瘤相关的出血史及出血倾向;⑧无未愈合伤口。排除标准:①合并其他恶性肿瘤;②妊娠期或哺乳期女性;③年龄﹤18岁。采用随机数字表法将患者分为研究组(n
=47,采用阿帕替尼联合化疗)和对照组(n
=53,采用单纯化疗)。两组患者的年龄、性别、ECOG 体力状况评分、治疗线数及肿瘤类型比较,差异均无统计学意义(P
﹥0.05)(表1),具有可比性。本研究经医院伦理委员会审批通过,所有患者及家属均对本研究知情同意并签署知情同意书。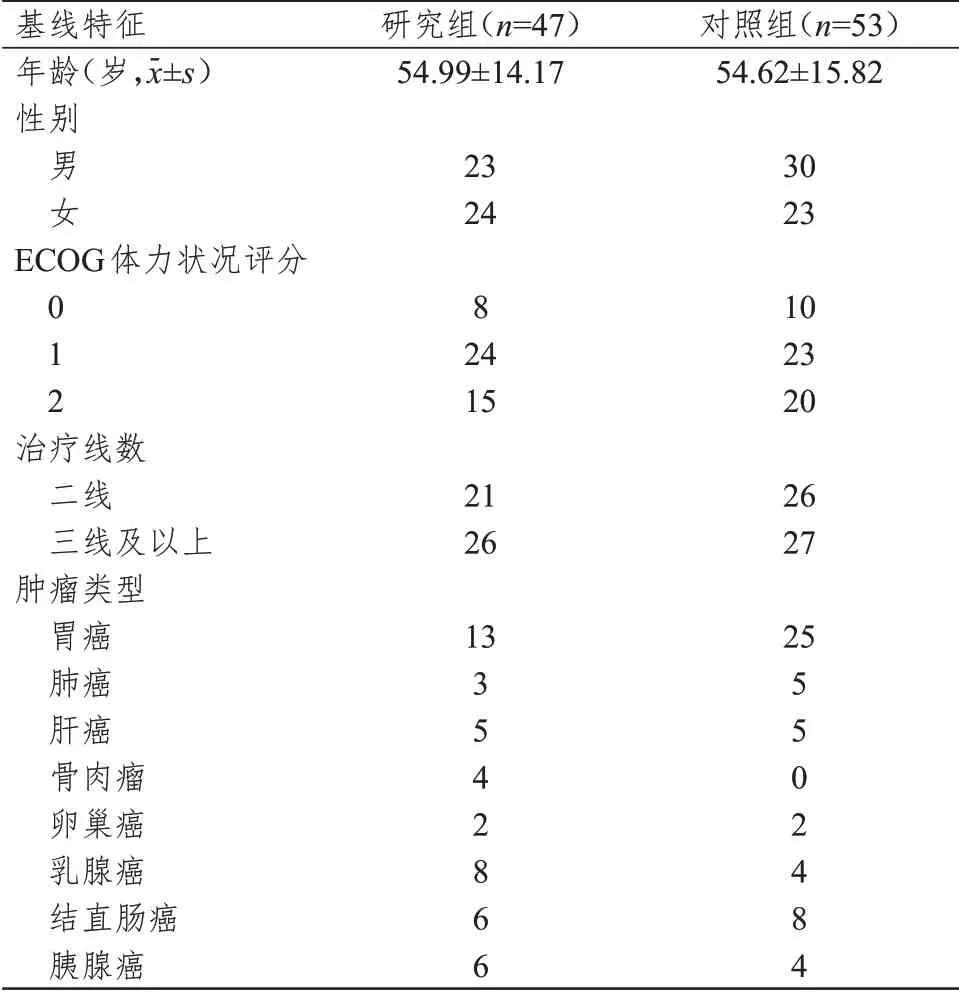
表1 两组患者的基线特征
1.2 治疗方法
研究组患者采用阿帕替尼联合化疗,甲磺酸阿帕替尼:0.50 g,口服,每天一次,若0.50 g 剂量不耐受可调整为0.25 g,口服,每天一次;持续服用至肿瘤进展或出现不可耐受的不良反应,同时联合各类型肿瘤治疗指南推荐的标准方案化疗。对照组患者采用单纯化疗,化疗方案均为指南推荐的标准方案,选择化疗方案时避免半年内使用过的药物。
1.3 疗效评价
采用实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1 版进行疗效评价,分为完全缓解、部分缓解、疾病稳定和疾病进展。客观缓解率(objective response rate,ORR)=(完全缓解+部分缓解)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。
1.4 不良反应评价及处理
采用美国国立癌症研究所常见不良反应事件评价标准(National Cancer Institute common terminology criteria for adverse event,NCI-CTCAE)4.0 版评价患者的不良反应,分为0~4 级。不良反应处理:①对于1~2 级不良反应,如出现口腔炎及手足综合征,采用外用药物治疗;出现骨髓抑制,采用重组人粒细胞集落刺激因子或重组人白细胞介素-11 或重组血小板生成素治疗;出现高血压,采用标准规范的降压药物治疗。②对于3~4 级不良反应,停药观察,不良反应改善至1~2 级时再次用药,出现2次3~4 级不良反时调整阿帕替尼剂量。
1.5 统计学分析

2 结果
2.1 临床疗效的比较
两组患者均可评价临床疗效,研究组患者的阿帕替尼服药时间为1.5~14.0 个月,中位服药时间为7.8 个月,化疗周期数为2~5 个,中位化疗周期数为3 个;对照组患者的化疗周期数为2~5 个,中位化疗周期数为3 个。研究组患者的ORR 为14.9%(7/47),与对照组患者的3.8%(2/53)比较,差异无统计学意义(P
﹥0.05);研究组患者的DCR 为74.5%(35/47),明显高于对照组患者的41.5%(22/53),差异有统计学意义(χ
=11.040,P
=0.001)(表2)。
表2 两组患者的临床疗效[n(%)]
2.2 不良反应发生情况的比较
两组患者乏力/纳差、凝血异常、手足综合征、蛋白尿、白细胞减少的发生率比较,差异均无统计学意义(P
﹥0.05);研究组患者的高血压发生率为17.0%(8/47),明显高于对照组患者的0%(0/53),差异有统计学意义(χ
=7.629,P
=0.006)(表3)。两组患者的不良反应大多为1~2 级,且可耐受。研究组3~4级不良反应仅有高血压(5例),对照组3~4级不良反应包括乏力/纳差(1例)和白细胞减少(2例)。
表3 两组患者的不良反应发生情况[n(%)]
3 讨论
晚期恶性肿瘤的治疗均以综合治疗为主,目前常用的治疗方法主要为化疗、姑息放疗、靶向治疗及PD-1/PD-L1 抑制剂治疗。对于驱动基因阳性的肿瘤(如肺癌、乳腺癌等),可使用针对肿瘤细胞的靶向药物,而对于驱动基因阴性的肿瘤,可以以抗肿瘤血管治疗为主。肿瘤新生血管生成是肿瘤生长和转移的关键,肿瘤细胞的增殖依赖于肿瘤新生血管提供的氧气和营养物质,因此血管内皮生长因子/血管内皮生长因子受体信号通路对肿瘤新生血管生成具有重要的调控作用。甲磺酸阿帕替尼是中国自主研发的新型口服小分子抗血管生成制剂。研究表明,甲磺酸阿帕替尼可高度选择性结合并抑制VEGFR2,阻断血管内皮生长因子与VEGFR2 结合,抑制肿瘤新生血管生成,进而抑制肿瘤生长。2014 年10 月,阿帕替尼被国家食品药品监督管理总局批准用于晚期胃腺癌或胃-食管结合部腺癌患者的三线及以上治疗。虽然目前阿帕替尼尚未批准用于其他肿瘤的二线治疗,但临床试验证实其在肝癌、非小细胞肺癌、乳腺癌等多种恶性肿瘤中具有较好的临床疗效。一项Ⅲ期随机对照临床研究将267 例胃癌患者随机分为阿帕替尼组和安慰剂组,结果发现,阿帕替尼组患者的中位总生存期和中位无进展生存期分别为6.5 个月和2.6 个月,分别高于安慰剂组患者的4.7 个月和1.8 个月,差异均有统计学意义(P
﹤0.05)。另一项临床研究纳入16 例既往应用表皮生长因子受体-酪氨酸激酶抑制剂的非小细胞肺癌患者,给予阿帕替尼(250 mg/d)治疗后,患者的中位无进展生存期为4.6 个月,ORR 为28.6%,DCR 为100%。Hu 等研究纳入38 例转移性非三阴性乳腺癌患者,采用阿帕替尼治疗后,患者的中位无进展生存期和中位总生存期分别为4.0 个月和10.3 个月,DCR 达到66.7%。Li 等研究纳入16 例化疗失败的Ⅳ期肉瘤患者,给予阿帕替尼(500 mg/d)治疗后,患者的中位无进展生存期为8.84 个月,ORR 为20.0%,DCR 为80.0%。以上临床研究结果均显示阿帕替尼治疗恶性肿瘤具有良好的临床疗效。本研究结果显示,研究组患者的DCR 为74.5%,明显高于对照组患者的41.5%,差异有统计学意义(P
﹤0.01)。提示阿帕替尼在恶性肿瘤中具有较好的临床疗效,在临床中具有广泛的应用前景。研究表明,阿帕替尼最常见的不良反应为高血压、蛋白尿、手足综合征,其中3 级高血压和手足综合征均为剂量限制性毒性。本研究中,研究组患者的高血压发生率明显高于对照组(P
﹤0.01)。阿帕替尼导致高血压的机制包括以下几个方面:通过抑制血管内皮生长因子信号通路,使外周血管阻力增加,血管内皮细胞增生、血管狭窄;与肾小球内相应受体结合后,导致肾小球硬化、蛋白尿;与VEGFR2结合,激活c
-Src
基因,使血压升高。研究显示,阿帕替尼治疗后33.3%的恶性肿瘤患者发生骨髓抑制,但大多数为1~2 级;3~4 级中性粒细胞减少的发生率为8.7%,3~4 级血小板减少的发生率为2.2%,3~4 级贫血的发生率为4.3%;其余较少见的不良反应为皮疹、腹泻、肝功能不全、厌食等,多数为1~2 级且可控。本研究中,因阿帕替尼的剂量为0.50 g 或0.25 g,且对乏力明显的患者均采取了睡前服用的方法,两组患者的不良反应大多为1~2 级,且可耐受。本研究中阿帕替尼的主要不良反应与既往临床研究结果相似。综上所述,阿帕替尼联合化疗治疗经一线以上化疗后进展的晚期恶性肿瘤具有较好的临床疗效,且其安全性较好。近几年来,免疫治疗进入临床,免疫治疗联合抗血管生成药物治疗恶性肿瘤取得了较好的疗效,而阿帕替尼是一种多靶点的抗血管生成药物,在多数恶性肿瘤中疗效较好,不良反应可控,目前很多肿瘤治疗指南均推荐PD-1/PD-L1 抑制剂联合抗血管生成治疗,相信在以后的临床工作及实践中阿帕替尼联合免疫治疗将会得到更为广泛的应用,也期待更多的大型多中心临床研究在更多类型的肿瘤中开展,为恶性肿瘤患者提供更多的治疗选择。

