Piwi 蛋白相互作用RNA-823 在胃癌中的表达及临床意义
顾曦,王程#,许锁保,时常乐,刘健红
常州市第三人民医院1普外科,2病理科,江苏 常州 213000
胃癌是世界范围内胃肠道肿瘤病死率较高的疾病之一,病死率居所有肿瘤第3 位。随着肿瘤化疗药的研制和发展,胃癌的治疗效果有了一定的提升,辅助化疗后患者的死亡风险是直接手术患者的0.67 倍,因此探讨胃癌的诊断预测因子和靶向治疗目标对提高胃癌的治疗效果和患者的生存率具有重要意义。近年微小RNA(microRNA,miRNA)可以从基因水平调节肿瘤细胞的生长、分化、凋亡和应激过程,从而起到促进/抑制肿瘤细胞生长的作用,越来越受到众多研究者的关注。Piwi蛋白相互作用RNA(Piwi-interacting RNA,piRNA)是非编码小RNA 中新发现的一类,最初被发现存在于生殖干细胞中,通过DNA 的甲基化沉默反转录转座子维持基因组的完整性,表现出表观遗传控制调节作用。近年来在多种肿瘤如宫颈癌、乳腺癌和结直肠癌细胞中发现piRNA 的异常表达。贾成林等采用基因芯片方法借助于piRNA数据库发现,胃癌可能存在与piRNA-823 相结合的特异靶点。本研究通过检测胃癌组织、癌旁正常组织中piRNA-823 水平,分析其与患者临床特征的关系,旨在了解其应用于胃癌临床诊断与治疗中的可行性,现报道如下。
1 对象与方法
1.1 研究对象
选取2015 年2 月至2018 年1 月于常州市第三人民医院确诊为胃腺癌的76 例胃癌患者为研究对象。纳入标准:①经病理学检查确诊为胃癌;②首次发病;③未行化疗、放疗等。排除标准:①非原发性胃癌;②已发生远处转移。76 例胃癌患者中,男63 例,女13 例;年龄41~80 岁,平均(55.19±6.58)岁,中位年龄65 岁。收集76 例胃癌患者的术后胃癌组织及癌旁正常组织(距肿瘤组织﹥5 cm)标本。本研究经医院医学伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2 主要试剂与仪器
McCoy’s 5A 培养基购自Sigma-Aldrich 公司,胎牛血清购自武汉普诺赛生命科技公司,miScript Plant RT Kit 购自德国Qiagen 公司,RNA fixer、RNA提取试剂盒均购自北京艾德莱生物科技公司,piRNA-823 抑制剂购自上海吉玛公司。BX51 荧光显微镜购自深圳博视达光学仪器有限公司,TGL-16M 高速台式冷冻离心机购自上海卢湘仪离心机仪器公司,实时聚合酶链反应荧光定量仪购自赛默飞世尔科技(中国)有限公司。
1.3 细胞培养
胃癌细胞系放入37 ℃水浴锅,待其完全复苏后进行1000 r/min 离心大约5 min,然后滤去细胞冻存液,再采用McCoy’s 5A 培养基重悬细胞,经接种后再置入5%CO孵箱中37 ℃恒温培养。以1∶4 比例传代,每隔2 天重新更换1 次培养基,最后采集处于对数生长期的细胞进行RNA 提取。移液枪轻轻吹打,使细胞完全脱离后,将其转移至离心管。用1 ml 注射器吸打混匀5~10 次进一步裂解细胞,然后装入含HiPure DNA Mini Column Ⅱ的收集管中,10 000 r/min 离心1 min,吹打后,加入含HiPure RNA Mini Column Ⅰ的混合液。按照试剂盒说明书进行操作,最后将获得的RNA保存于-80 ℃。
1.4 RNA 提取、逆转录聚合酶链反应(reverse transcription- polymerase chain reaction,RTPCR)检测
1.4.1 RNA 提取 参考RNA 提取试剂盒(Trizol 试剂)说明书的操作步骤,采用苯酚-氯仿抽取法提取胃癌及癌旁组织中的总RNA。
1.4.2 RNA 浓度和纯度的测定 应用BioTek Synergy HT 多功能酶标仪对提取出来的RNA 进行严格的光密度(optical density,OD)/OD检测,结果为1.8~2.0,表明RNA 纯度达到实验要求标准。
1.4.3 逆转录过程 本研究中逆转录反应体系为5×miScript Plant RT Buffer 4 μl,10×miScript Plant RT Nucleics 2 μl,RNase-Free Water 9 μl,miScript Plant Reverse Transcriptase 1 μl,Ligation Product 4 μl。其余步骤参照逆转录试剂盒说明书进行逆转录。
1.4.4 RT-PCR 测定 以cDNA 作为对照模板对piRNA-823 水平进行检测。引物离心后置于Applied Biosystem 7500 实时荧光定量PCR 仪中测定piRNA-823 的Ct 值,2值表示目的基因的相对表达量,2值表示实验组的目的基因相对于对照组的变化倍数。
1.5 随访
76 例患者治疗后均由研究者负责进行电话随访,中位随访时间20 个月。至2021 年1 月30 日随访结束,76 例患者中,生存58 例,占76.32%,死亡18 例,占23.68%。
1.6 统计学方法

2 结果
2.1 piRNA-823 表达情况的比较
76 例胃癌患者胃癌组织中piRNA-823 表达水平为(2.34±0.68),低于癌旁正常组织的(3.51±0.71),差异有统计学意义(t
=10.375,P
﹤0.05)。65.79%(50/76)的胃癌患者胃癌组织中piRNA-823表达水平低于癌旁正常组织。2.2 piRNA-823 表达情况与生存情况的关系
以胃癌组织中piRNA-823 检测值﹤癌旁正常组织的患者(50 例)为低表达组,另外26 例为高表达组。piRNA-823 低表达组患者的总生存期为(16.07±1.68)个月,中位生存期为15.00个月(95%CI:12.06~19.32);piRNA-823 高表达组患者的总生存期为(20.07±1.35)个月,中位生存期为22.00 个月(95%CI:17.09~23.84);piRNA-823 低表达组患者的总生存期短于高表达组,差异有统计学意义(χ
=14.307,P
﹤0.05)。2.3 不同临床特征胃癌患者胃癌组织中piRNA-823表达情况的比较
piRNA-823 高表达与低表达胃癌患者浸润深度、淋巴结转移情况、TNM 分期比较,差异均有统计学意义(P
﹤0.05)。(表1)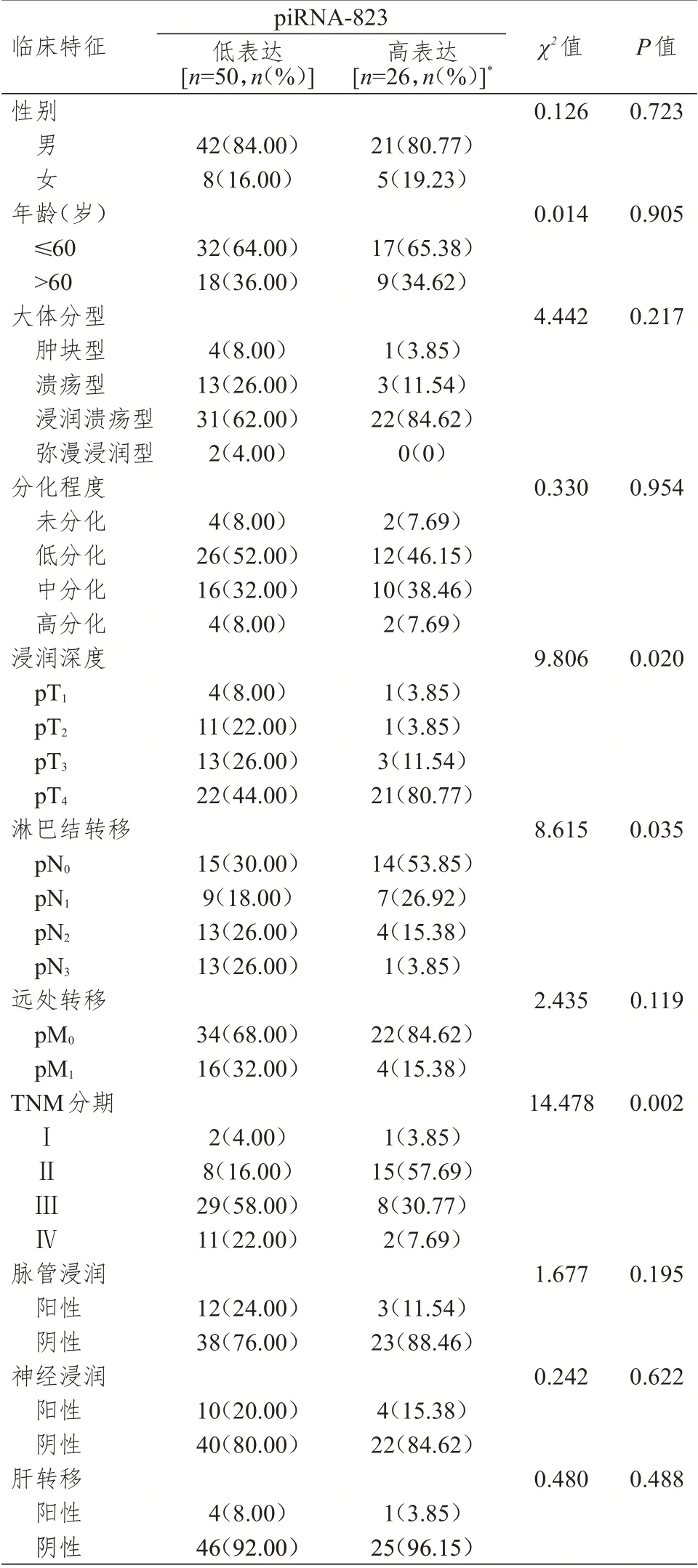
表1 不同临床特征胃癌患者胃癌组织中piRNA-823 表达情况的比较(n=76)
2.4 胃癌侵袭转移影响因素的多因素分析
以是否发生远处转移为评估胃癌侵袭转移的指标,并将远处转移作为因变量。Logistic回归分析单因素分析显示,piRNA-823表达情况、TNM分期、浸润深度均是可能影响胃癌侵袭转移的因素;多因素分析显示,TNM 分期是胃癌侵袭转移的影响因素(P
﹤0.01),而piRNA-823表达情况非胃癌侵袭转移的影响因素(OR=1.01,95%CI:0.89~3.98)。(表2)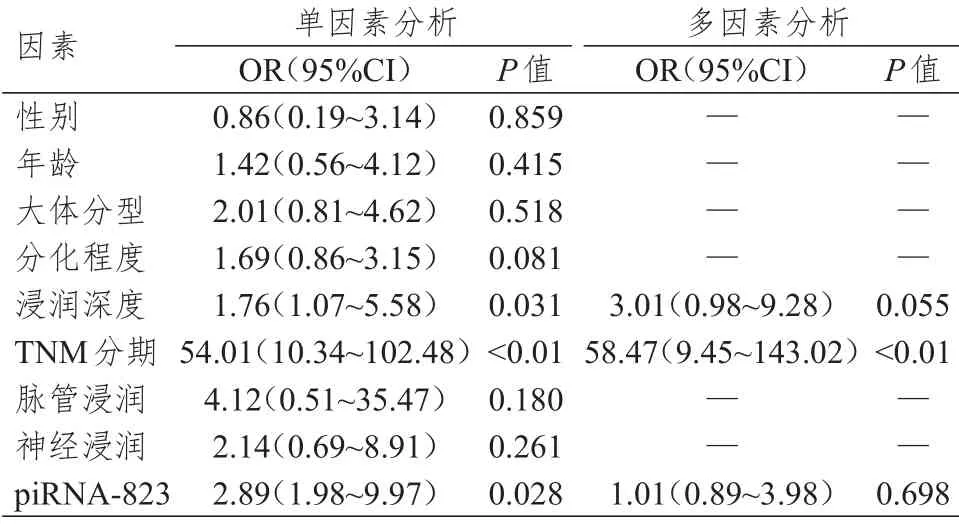
表2 胃癌侵袭转移影响因素的Logistic 回归分析(n=76)
3 讨论
piRNA-823 是内源性的能够发挥生物调控作用的RNA,研究表明其可能参与恶性肿瘤的发生、转移过程,已成为现代肿瘤生物学探讨的热点问题。piRNA-823 表达异常与胃癌发病、转移存在密切关系,推测其可能作为一种致癌基因或抑癌基因,在胃癌的发病、转移过程中扮演重要角色。虽然在过去几十年中很多学者对piRNA 做了大量的研究,如Chen 等研究发现piRNA-651 可以抑制胃癌细胞的分裂,导致胃癌细胞停留在G/M 期,在外周血中piRNA-651 水平低于健康人。有研究指出,检测piRNA-823 水平结果显示,其与结直肠癌的发病存在密切关系,结直肠癌患者普遍存在piRNA-823 水平升高,应用临床干预手段降低piRNA-823 水平后,HCT116 细胞增殖与克隆能力也随之出现明显下降,细胞凋亡的速度显著加快。后续研究同时发现,piRNA-823 能够影响DNA 甲基转移酶(DNA methyltransferase,DNMT)3A 的水平,并对DNMT3B表达进行相应调节,是参与结直肠癌发病的重要因素。但Chen等针对胃癌的研究得出相反结论,胃癌组织中piRNA-823 表达水平显著低于正常组织,这与针对结直肠癌的研究结论明显不一致。另外,关于癌旁组织中piRNA-823 表达水平的变化,以及不同胃癌临床特征与piRNA-823 水平之间的关系尚不明确,关于piRNA-823 在胃癌中的表达及临床意义仍有待深入研究。
为此,本研究检测了76 例胃癌患者胃癌组织中piRNA-823 的表达水平,并与癌旁正常组织比较,结果证实Chen 等研究结论,即胃癌组织中piRNA-823 表达水平显著低于癌旁正常组织,此外,研究结果还显示,piRNA-823 低表达患者的总生存期缩短,表明piRNA-823 低表达与病情恶化和不良预后有关,能够作为预测患者治疗结局的重要因素。回归分析结果显示,piRNA-823 表达对胃癌转移的影响并未显示出统计学意义,这可能与本次研究的样本量相对较少有关,还有待于扩大样本量深入研究,进一步探索piRNA-823 作为恶性肿瘤诊断的参照指标与临床治疗的新靶点的临床价值。
进一步分析,以胃癌组织中piRNA-823 检测值﹤癌旁正常组织的患者(50 例)为低表达组,另外26 例为高表达组,结果显示,与piRNA-823 高表达组比较,低表达组浸润深度更加严重,淋巴结转移更多,TNM 分期更高,提示piRNA-823 水平可能是影响胃癌病情进展与恶化的危险因素。通过Logistic 单因素分析显示,piRNA-823 表达情况、TNM 分期、浸润深度均是可能影响胃癌侵袭转移的因素;但多因素分析中TNM 分期是胃癌侵袭转移的影响因素(P
﹤0.01),而piRNA-823 表达情况非胃癌侵袭转移的影响因素(OR=1.01,95%CI:0.89~3.98)。已有多项研究表明,piRNA 在肝癌、乳腺癌、结直肠癌组织中均表达异常,本研究进一步证实piRNA-823与肿瘤远处转移存在密切关系,与上述多项研究一致。而本研究中piRNA-823 在多因素分析中显示非胃癌侵袭转移的影响因素,分析其原因可能是TNM 分期本身就是以肿瘤细胞浸润、转移等特征作为标准评判肿瘤疾病的严重程度,因此在多因素分析中显示其对胃癌侵袭转移具有较高的预测作用;而piRNA-823 是通过调控肿瘤侵袭转移的生物学行为,所以在多因素分析中对胃癌侵袭转移的作用表现不突出。总之,本研究结果进一步证实,piRNA-823 可能是导致胃癌发病以及病情进展、恶化的一个重要指标,其表达水平能够较好地预测胃癌的预后,在胃癌的临床诊疗实践中可能具有良好的应用前景,但其具体作用机制尚未完全明确,还需以后更多的基础研究进一步深入探讨。

