大鼠癫痫持续状态后海马神经传递环路CB1R表达特征
孟宪栋, 张海锋
大麻素Ⅰ型受体(CB1R)在中枢神经系统广泛分布,主要存在于兴奋性和抑制性突触终末,内源性大麻素(endocannabinoids,EC)在神经元活动加强时,可以在突触后神经元合成、释放,抑制谷氨酸和GABA释放[1],对神经传导进行调控。近年来,CB1R 介导的信号机制被认为在控制癫痫急性发作上发挥重要作用[2,3],因此推测CB1R可能与癫痫发生有关,并且在癫痫发生中对CB1R表达进行了探讨。海马内部存在由內嗅区-齿状回-CA3区-CA1区-下托皮质-內嗅区的单向神经传递环路[4],SE后海马神经传递闭合环路上CB1R表达特征未见报道。因此,我们对大鼠SE后,海马神经传递闭合环路上CB1R进行光密度测定,观察各区域CB1R表达的时空特征,探讨CB1R在癫痫发生中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 3月龄SD大鼠(空军军医大学动物实验中心),清洁级,不限雌雄,实验获空军军医大学动物伦理委员会批准。
1.1.2 主要试剂 CB1R抗体(Abcam),GFAP抗体(Sigma),NeuN抗体(Sigma)。
1.1.3 主要仪器 冰冻切片机(Leica),正置显微镜(Olympus)。
1.2 方法
1.2.1 氯化锂-匹罗卡品建立慢性癫痫模型 SD大鼠随机分成实验组和对照组,建立氯化锂-匹罗卡品癫痫模型。给大鼠腹腔注射氯化锂(127 mg/kg),18~20 h后,甲溴东莨菪碱 (1 mg/kg) 腹腔注射,30 min后,腹腔注射匹罗卡品(30 mg/kg),对发作进行分级[5]:Ⅰ级:肢体和面部自动症;Ⅱ级:点头和咀嚼;Ⅲ级:前肢痉挛;Ⅳ级:伴直立的前肢痉挛;Ⅴ级:摔倒。≥Ⅳ级判定为癫痫持续状态(status epilepticus,SE),发作持续1 h,腹腔注射地西泮(10 mg/kg)终止。依据SE后不同时间点,分为SE1 w、2 w、3 w、4 w,每组4只,各时间点设立对照组,对照大鼠腹腔注射0.9%NaCl溶液,其他操作与实验组相同。
1.2.2 海马组织标本制备 SE后1 w、2 w、3 w、4 w组SD大鼠以及对照组大鼠,进行10%水合氯醛麻醉,灌注固定。生理盐水灌注1 min,然后4%多聚甲醛固定液灌注固定30 min,30%蔗糖溶液后固定,4 ℃过夜。行脑冠状切片,片厚12 μm固定于载玻片。将所有切片行CB1R/NeuN/GFAP免疫组化染色。
1.2.3 海马CB1R、NeuN、GFAP免疫组化检测 血清封闭液封闭切片2 h,加一抗兔抗大鼠CB1R抗体(1∶300),4 ℃过夜。PBS洗片,加生物素化抗兔抗体(1∶300),室温3 h,加链霉素-生物素-过氧化物酶复合物,4 ℃过夜,DAB显色。脱水、封片,Olympus正置显微镜观察、拍照。神经元染色加一抗小鼠抗NeuN单抗(1∶500)孵育,二抗为生物素化羊抗小鼠IgG(1∶300)。星形胶质细胞染色加一抗小鼠抗GFAP单抗(1∶2000),二抗为生物素化羊抗小鼠IgG(1∶300)。
1.2.4 免疫组化定量分析 每只大鼠海马取4张冠状切片行CB1R定量分析。在CA1区放射层、CA3区透明层,以及齿状回分子层,利用Image-Pro Plus软件进行CB1R染色光密度测量,并计算分析区域平均光密度(MIOD)。
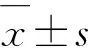
2 结 果
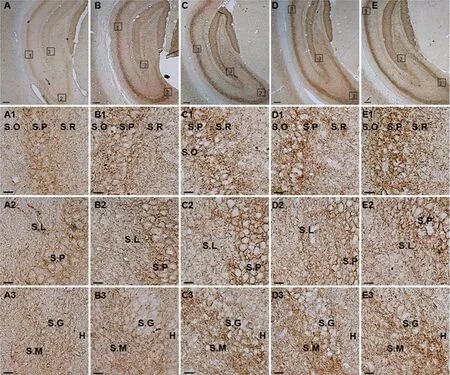
2.1 SE后不同时间点大鼠海马CB1R表达 在对照组和SE后不同时间点,海马CB1R呈点、线状分布,考虑与CB1R在抑制性突触前膜和轴突末端分布有关(见图1)。在CA1区放射层(S. R),测量各时间点MIOD,CB1R表达均高于对照(P<0.05),且CB1R表达在SE后4 w(0.0311±0.00451),高于SE后1 w(0.0205±0.00102)、2 w(0.0229±0.00219)、3 w(0.0209±0.00209)(P<0.05)(见图2A);在CA3区透明层,SE后各时间点CB1R表达均高于对照(P<0.05),CB1R表达在SE后4 w(0.0279±0.00252),高于SE后1 w(0.0194±0.00385)(P<0.05)(见图2B);在海马分子层,SE后各时间点CB1R表达均高于对照(P<0.05),但是CB1R表达在SE后1 w(0.0276±0.00413)、2 w(0.0326±0.00264)、3 w(0.0321±0.00380)、4 w(0.0334±0.00427)之间无统计学差异(P>0.05)(见图2C)。
A:对照大鼠海马,A中1位于CA1区、2位于CA3区、3位于齿状回,A1、A2、A3为图A中1、2、3区域放大;B:SE后1 w大鼠海马,B中1位于CA1区、2位于CA3区、3位于齿状回,B1、B2、B3为图B中1、2、3区域放大;C:SE后2 w大鼠海马,C中1位于CA1区、2位于CA3区、3位于齿状回,C1、C2、C3为图C中1、2、3区域放大;D:SE后3 w大鼠海马,C中1位于CA1区、2位于CA3区、3位于齿状回,C1、C2、C3为图C中1、2、3区域放大;E:SE后4 w大鼠海马,E中1位于CA1区、2位于CA3区、3位于齿状回,E1、E2、E3为图E中1、2、3区域放大。S. O:始层;S. P:锥体细胞层;S. R:放射层;S. L:透明层;S. M:分子层;S. G:颗粒细胞层;H:门区。图标=200 (A、B、C、D、E) μm;图标=20 (A1~A3、B1~B3、C1~C3、D1~D3、E1~E3) μm
A:对照(CON)和SE后1 w、2 w、3 w、4 w,CA1区放射层(S. R)CB1R平均光密度(MIOD)比较;B:对照(CON)和SE后1 w、2 w、3 w、4 w,CA3区透明层(S. L)MIOD比较;C:对照(CON)和SE后1 w、2 w、3 w、4 w,分子层(S. M)MIOD比较;数值以表示。*P<0.05表示和对照组比较具有统计学差异,**P<0.05表示多重组间比较具有统计学差异
2.2 大鼠SE后4W海马神经元和星形胶质细胞变化特征 SE后4 w,海马锥体细胞层神经元排列紊乱,密度明显降低(见图3),星形胶质细胞增生肥大(见图4),因此,本研究建立的癫痫模型,具备海马硬化的两个基本特征,即神经元的大量丢失和星形胶质细胞增生、肥大[6]。
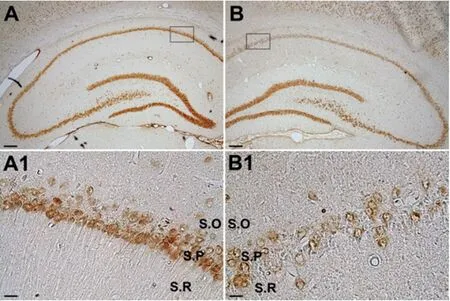
A:对照大鼠海马NeuN表达,A1为图A中矩形框内区域放大。B:SE后4W大鼠海马NeuN表达,B1为图B中矩形框内区域放大。S. O:始层;S. P:锥体细胞层;S. R:放射层。图标=200 (A、B) μm;图标=20 (A1、B1) μm
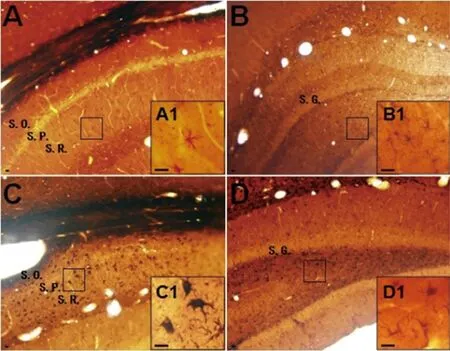
A:对照大鼠CA1区放射层GFAP表达,A1为图A中矩形框内区域放大。B:对照大鼠海马CA4区GFAP表达,B1为图B中矩形框内区域放大。C:SE后4 w大鼠CA1区放射层GFAP表达,C1为图C中矩形框内区域放大。D:SE后4 w大鼠海马CA4区GFAP表达,D1为图D中矩形框内区域放大。S. O:始层;S. P:锥体细胞层;S. R:放射层;S. G:颗粒细胞层。图标=200 (A、B)μm;图标=20 (A1、B1)μm
3 讨 论
CB1R位于神经元轴突和突触终末,内源性大麻素在神经传递增强时合成增加,绑定突触前膜CB1R,抑制神经传导[7]。兴奋性神经递质和抑制性神经递质的平衡决定神经网络的兴奋性,CB1R激活对二者释放皆有抑制作用,因此,CB1R信号通路对神经网络的影响,是由不同细胞上CB1R活化的综合效果决定。此外存在CB1R的非逆行调控,例如星形胶质细胞以及线粒体CB1R信号通路,使内源性大麻素信号传导复杂化[8]。大麻素受体在海马中高度表达,慢性应激会调节海马CB1受体的表达和内源性大麻素水平[9]。大麻二酚等多种CB1R激动剂具有抗痫作用[10],纯化的植物性大麻二酚用于治疗小儿难治性癫痫[11],CB1R阻断剂可以导致癫痫发作[12]。CB1R激活后的信号通路与癫痫急性发作的终止密切相关,癫痫持续状态后CB1R表达发生改变,CB1R的这种抗痫作用是否会发生改变呢?SE后大鼠海马CB1R表达增加[2]。人脑海马对照研究显示,癫痫患者CB1RmRNA下调,硬化海马始层、锥体细胞层、放射层、分子层CB1R表达下降[13]。我们认为,这种下调可能与海马硬化晚期,神经元细胞大量死亡导致突触密度减低有关。
除了SE后CB1R变化之外,EC的变化也对CB1R信号通路产生影响。大鼠SE后海马2-AG、AEA产生增加。然而,癫痫患者脑脊液AEA浓度较对照下降[14]。癫痫发生过程中,EC如何变化?研究结果不甚一致,说明EC在癫痫发生的不同阶段存在波动,提示EC调控具有复杂性。EC降解酶抑制剂及合成酶抑制剂对癫痫发生的作用尚不清楚。CB1R阻断剂利莫那班可以防止大鼠脑外伤后期神经网络兴奋性增高[15]。CB1R阻断剂阻止热性惊厥导致的后期边缘系统兴奋性增强[12]。大麻二酚可有效调节癫痫持续状态(SE)诱发的癫痫[16]。内源性大麻素系统激活不能阻止SE后癫痫发生[17]。这些关于癫痫发生的研究结果本身存在矛盾,并且与CB1R激动剂阻断癫痫急性发作不全一致,提示CB1R调控的复杂性,以及其在控制癫痫急性发作和阻断癫痫发生中,所发挥的作用不同。探讨CB1R在癫痫发生中分布的变化,为其所产生功能改变奠定形态学基础。
在海马内部存在一个由內嗅区-齿状回-CA3区-CA1区-下托皮质-內嗅区的单向神经传递环路。研究显示SE后海马CB1R表达增加,但是尚未见关于海马单向神经传递环路CB1R动态变化的定量分析。海马神经元突触密集,尤其CA1区,多种突触传递最终经CA1区传出海马,其突触的可塑性,因此具有致痫性[18]。放射层内锥体细胞的顶树突有规则的伸展以及与其连接的轴突相互交织,包含来自CA3区的Schaffer侧支。齿状回分子层含有从內嗅区来的海马传入纤维,从邻近神经元发来的轴突,以及颗粒细胞的树突。苔藓纤维是齿状回颗粒细胞轴突,主要在CA3区锥体细胞顶树突起始段之间穿行,与之形成大量的突触,形成了CA3区特有的透明层。因此,我们选取CA1区放射层、CA3区透明层,以及分子层等突触传递密集的区域作为观察对象,定量分析其CB1R的动态变化,探讨SE后海马CB1R改变在癫痫发生中的作用。我们发现本研究中所建立的癫痫模型,SE后4 w,出现明显的海马硬化特征,表现为神经元的大量丢失和星形胶质细胞增生。在海马硬化形成过程中,我们对海马各区进行CB1R表达进行定量分析,发现在CA1区放射层,SE后各时间点CB1R表达均高于对照,CB1R表达在SE后4W明显增高,高于SE后1 w、2 w、3 w,在CA3区透明层,SE后各时间点CB1R表达均高于对照,CB1R表达在SE后4 w,高于SE后1 w,在海马分子层,SE后各时间点CB1R表达均高于对照,但是CB1R表达在SE后1 w、2 w、3 w、4 w之间无统计学差异。这些结果提示,在SE后海马内部单向信息传递环路中,CB1R均出现不同程度增加,但是以齿状回分子层CB1R表达增加最早,且以后数周变化不大,CA3区透明层在SE后,CB1R表达增加,随后增加缓慢,在SE后4 w达到高峰,而CA1区放射层,在SE后CB1R表达增加,此后2~3 w变化不大,在SE后4 w CB1R明显增加。说明从齿状回-CA3区-CA1区的信息传递环路中,在SE后CB1R增加,但是会出现增加延迟,齿状回分子层变化最早,CA1区放射层变化最晚。有学者在颞叶癫痫患者硬化海马中,发现神经元胞体周围出现表达CB1R的GABA能抑制性神经元出芽,认为这种增强的抑制信号可能会增加锥体细胞同步性,有助于癫痫发生和间期放电[19]。在本研究中,我们发现放射层和锥体细胞交界区,CB1R阳性表达明显增强,无论是对照还是SE后各时间点,提示CB1R阳性突触大量位于锥体细胞胞体周围。海马大麻素敏感细胞信号是导致网络振荡可能原因,与癫痫发生密切相关[20]。SE后传导环路CB1R在时间上增加的并不同步,对癫痫的发生有何影响尚不清楚,但是这种非同步性变化,与生理状态下CB1R分布不同,提示其在癫痫形成过程中,海马CB1R对神经传递的调节平衡发生改变,这种变化对于癫痫发生的意义值得进一步探讨。

