血必净对老年吸入性肺炎的临床疗效及安全性观察
武艳旭,李向阳
复旦大学附属华东医院呼吸与危重症医学科,上海200040
吸入性肺炎是由误吸、口咽分泌物移位等引发的急性吸入性肺损伤[1],占社区获得性肺炎的15%~23%[2]。吸入性肺炎的预后主要取决于患者的年龄和基础疾病,除了针对病原体的抗感染治疗外,保持水电解质平衡、营养支持以及雾化、体位引流、胸部物理治疗等辅助治疗也是必要的。不同于非吸入性肺炎,吸入性肺炎不仅涉及病原体的浸润,还包括吸入物引起的肺部及全身炎症改变。加之此类患者的吸入常反复发生,久居医疗保健相关场所又增加了耐药菌感染的风险,部分患者病程后期抗生素疗效欠佳。即使接受了最佳治疗,吸入性肺炎的死亡率仍高达11%~30%[3],因此有必要为吸入性肺炎患者探索新的治疗策略。血必净注射液可以抑制内源性炎症介质的释放,对重症肺炎[4]、脓毒症[5]和病毒性肺炎[6]等多种感染性疾病均有效,在老年人群中表现出了良好的安全性[7]。虽然血必净在老年吸入性肺炎患者中的应用颇具潜力,但目前相关临床研究数据十分有限,本研究旨在探索血必净对老年吸入性肺炎患者的有效性及安全性,为老年吸入性肺炎患者的综合治疗提供更多选择。
1 资料与方法
1.1 临床资料收集2020年1月—2020年12月于复旦大学附属华东医院呼吸与危重症医学科住院治疗的老年吸入性肺炎患者60 例,根据随机区组设计1∶1 比例分配至观察组和对照组。纳入标准:(1)年龄≥60岁;(2)根据《中国成人社区获得性肺炎诊断和治疗指南(2016年版)》[8]以及《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)》[9]确诊为肺炎;(3)有误吸史,吞咽功能障碍,进食或呕吐后呛咳;(4)有反复发热、咳嗽、咳痰等呼吸道症状及肺部炎症阴影(经胸部CT 证实)。排除标准:(1)活动性肺结核;(2)重症肺炎确诊超过48 h;(3)确诊为严重的急性呼吸窘迫综合征者;(4)精神障碍者;(5)合并心、肝、肾等重要脏器功能不全或恶性肿瘤者。入组患者均签署知情同意书,研究经伦理委员会批准(2019K125)。最终纳入老年吸入性肺炎患者53 例,其中观察组28 例、对照组25 例,年龄61~89 岁,平均(79.2±6.8)岁。2 组患者的年龄、性别、基础合并症(糖尿病、高血压和脑梗死)、抗生素和机械辅助通气应用情况差异均无统计学意义(>0.05)。见表1。
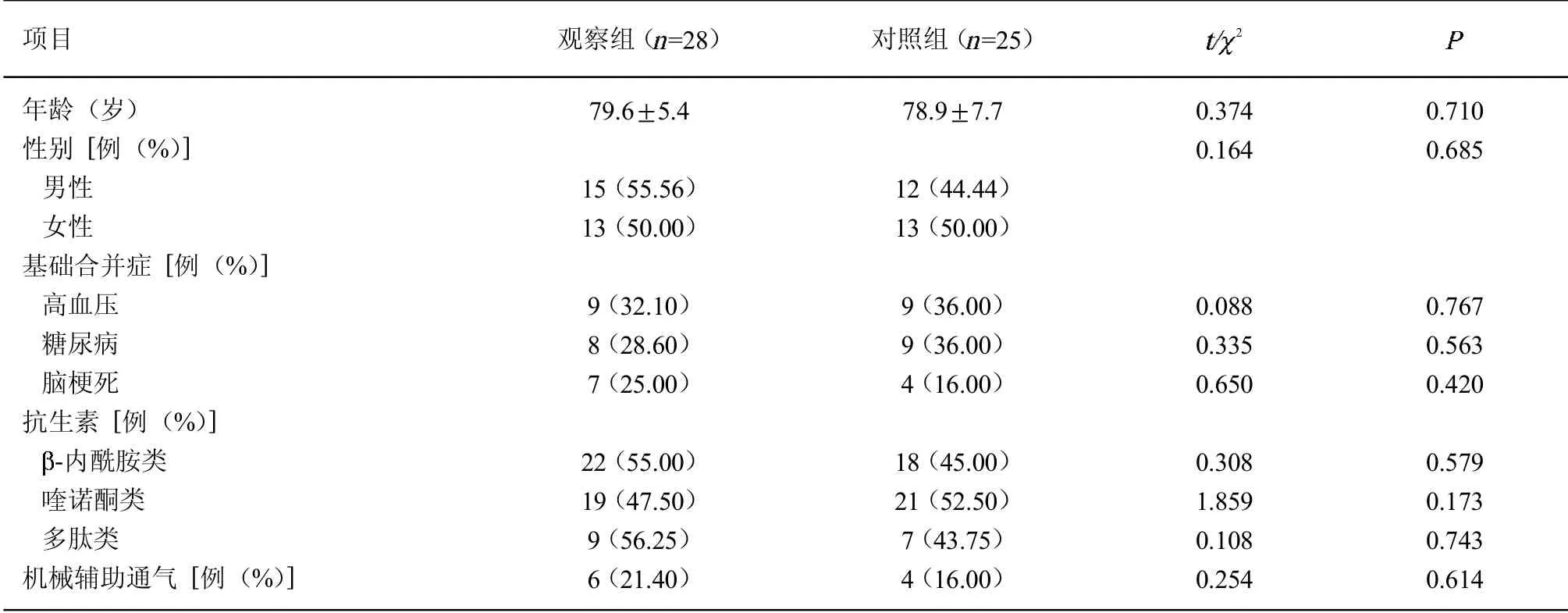
表1 2 组一般资料比较
1.2 治疗方法 所有患者根据个体病情接受包括抗感染、解痉化痰、机械辅助通气、气道护理、营养支持等在内的常规医学治疗14 d。观察组在常规医学治疗的基础上加用血必净注射液(天津红日药业股份有限公司,国药准字Z20040033)100 mL7 d,静脉滴注80 min,2 次/d。
1.3 观察指标
1.3.1 主要疗效指标 观察0、14 d 的肺炎严重指数(Pneumonia Severity Index,PSI)评分及Fine 危险分层改善情况。Fine 危险分层:I 级为年龄<50 岁,无基础疾病且各项生命体征正常的低风险患者。II~V 级通过年龄、性别、伴随疾病、生命体征、实验室影像学指标等肺炎相关危险因素逐项积分。分值≤70 分为II 级;71~90 分为III 级;91~130 分为IV 级;>130 分为V 级[10]。
1.3.2 次要疗效指标 检测患者0、7、14 d 的白细胞(white blood cell,WBC)、C 反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、白介素-6(interleukin-6,IL-6)、D-二聚体(D-dimer,DD)等外周血炎症及凝血指标;治疗2 周后丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、血清肌酐(serum creatinine,SCR)、血尿素氮(blood urea nitrogen,BUN)等肝肾功能指标的变化趋势;氧合指数(oxygenation index,OI)以及肺部炎症(胸部CT/胸片)吸收程度。
肺炎吸收情况评定参照殷人易等[11]编制的肺炎胸片吸收评价量表,通过总得分评价观察2 组间的疗效差异。总得分评价=(治疗后得分-治疗前得分)/治疗前得分×100%。肺炎吸收程度分为4 个等级:(1)总得分评价下降≥95%为完全吸收;(2)70%≤总得分评价下降<95%为大部分吸收;(3)30%≤总得分评价下降<70%为部分吸收;(4)总得分评价下降<30%为无吸收。1.4 统计分析 应用SPSS 20.0 进行数据分析,计量资料用均数±标准差(±s)表示,组间比较行独立样本 检验,组内比较行配对样本 检验;计数资料用例数(%)描述,组间比较行2检验;重复测量数据采用重复测量方差分析<0.05 为差异有统计学意义。
2 结果
2.1 2 组疗效及安全性比较 0 d 时2 组PSI 评分差异无统计学意义,14 d 时各组内及2 组间PSI 评分差异均有统计学意义。治疗后Fine 危险分层改善情况(=0.042)及总得分评价(=0.033)差异有统计学意义。2 组肝肾功能变化差异均无统计学意义。见表2。2.2 2 组不同时间点相关指标比较 2 组WBC、CRP、PCT、IL-6、OI 及D-D 时间效应差异有统计学意义(均<0.001)。0 d 时2 组患者上述指标差异均无统计学意义(>0.05),7、14 d 时2 组患者WBC、CRP、PCT、IL-6 和D-D 较0 d 时下降,OI 升高。WBC、CRP、IL-6 及OI 分组效应差异有统计学意义,所有炎症指标时间与分组交互效应差异有统计学意义(均<0.01)。见表3。

表2 2 组疗效及安全性比较
表3 2 组不同时间点相关指标比较(±s)

表3 2 组不同时间点相关指标比较(±s)
项目0 d7 d14 d images/BZ_28_1850_462_1873_485.png分组×时间images/BZ_28_2087_462_2109_485.png分组×时间WBC(×109 L-1)观察组对照组images/BZ_28_299_704_322_728.png分组images/BZ_28_299_754_322_778.png分组images/BZ_28_299_804_322_828.png时间images/BZ_28_299_854_322_878.png时间CRP(mg/L)观察组对照组images/BZ_28_299_1054_322_1078.png分组images/BZ_28_299_1104_322_1128.png分组images/BZ_28_299_1154_322_1178.png时间images/BZ_28_299_1204_322_1228.png时间PCT(ng/mL)观察组对照组images/BZ_28_299_1404_322_1428.png分组images/BZ_28_299_1454_322_1478.png分组images/BZ_28_299_1504_322_1528.png时间images/BZ_28_299_1554_322_1578.png时间IL-6(pg/mL)观察组对照组images/BZ_28_299_1754_322_1778.png分组images/BZ_28_299_1804_322_1828.png分组images/BZ_28_299_1854_322_1878.png时间images/BZ_28_299_1904_322_1928.png时间OI(mmHg)观察组对照组images/BZ_28_299_2104_322_2128.png分组images/BZ_28_299_2154_322_2178.png分组images/BZ_28_299_2204_322_2228.png时间images/BZ_28_299_2254_322_2278.png时间D-D(mg/L)观察组对照组images/BZ_28_299_2454_322_2478.png分组images/BZ_28_299_2504_322_2528.png分组images/BZ_28_299_2554_322_2578.png时间images/BZ_28_299_2604_322_2628.png时间14.14±3.23 13.76±3.47 82.64±18.49 81.65±25.18 1.58±0.84 1.37±0.96 71.95±25.10 66.35±17.89 331.20±39.85 335.56±38.68 2.95±1.06 2.84±1.21 9.49±1.59 11.69±2.84 4.676 0.035 103.389<0.001 37.28±14.55 63.36±23.57 6.264 0.016 225.727<0.001 0.69±0.39 0.92±0.80 0.044 0.835 54.024<0.001 28.83±12.02 46.81±12.66 4.754 0.034 180.876<0.001 388.46±26.77 368.48±36.84 4.175 0.046 112.624<0.001 1.82±0.91 2.34±1.21 0.769 0.384 191.579<0.001 7.14±0.95 8.72±0.95 13.62±10.42 19.36±15.30 0.27±0.24 0.34±0.33 9.98±3.07 16.29±4.57 422.79±20.14 388.92±35.50 1.29±0.50 1.56±0.92 7.355 39.566 6.256 14.941 8.905 24.476 0.002<0.001 0.004<0.001<0.001<0.001
3 讨论
吸入性肺炎是一种在老年人群中高发的肺部疾病,预期死亡率高于其他类型肺炎[3,12]。诊断应考虑在适当的临床环境中,患者有已知的吸入危险因素和特征性的临床及影像学表现[13]。由于化学性吸入性肺炎早期可无病原菌感染,同时部分患者感染菌耐药等现实问题,抗生素在某些吸入性肺炎患者中的治疗效果十分有限。由吸入触发的机体过度炎症反应引起肺泡上皮细胞损伤凋亡,进而导致气体交换单位减少、肺血管内皮细胞受损以及微循环紊乱是吸入性肺炎重要的病理生理机制。针对机体过度的炎症反应进行调控可能是吸入性肺炎治疗的关键。
血必净注射液主要提取红花、赤芍、丹参、当归和川芎中的有效物质,通过改善机体微循环、调节炎症介质、对抗细菌毒素、清除氧自由基及抗氧化应激机制以发挥抗炎、抗凝、免疫调节、内脏保护等作用[14],但现有药理学研究成果有限。研究显示血必净可通过抑制II 型肺泡上皮细胞凋亡,减轻肺组织的炎症反应和氧化应激,改善氧合[15]。在耐甲氧西林金黄色葡萄球菌感染的小鼠模型中,血必净通过下调促炎性细胞因子如IL-6、肿瘤坏死因子-α、单核细胞趋化蛋白-1等调控机体炎症反应;降低脾脏、肝脏中的细菌负荷;抑制Toll样受体2 激动剂诱导的小鼠巨噬细胞中核因子B、丝裂原活化蛋白激酶和磷脂酰肌醇3-激酶/蛋白激酶通路激活;减轻肺、肝脏和肾脏的组织损伤,从而发挥其保护作用[16]。本次研究显示,使用血必净后吸入性肺炎患者血清炎性指标WBC、CRP、IL-6水平较对照组下降,OI 有所改善,同时安全性良好。这与血必净在重症肺炎[4]和全身炎症反应综合征[17]等既往研究中的结果相似。
但根据本次研究,2 组间PCT 和D-D 水平差异无统计学意义,推测PCT 多与细菌感染性疾病相关,且初期吸入性肺炎炎症部位较为局限或全身炎症水平低。当然,也可能与研究的小样本量有关。此外,根据肺炎胸片吸收评价量表[11]2 组患者治疗前后影像学对比总得分评价差异有统计学意义,可见血必净能够在一定程度上促进肺部炎症吸收,遗憾的是此次研究肺炎吸收程度差异无统计学意义。已知肺炎病程中影像学改变受宿主、病原体、感染部位和气道引流等多重因素影响,部分患者炎症吸收可能滞后于临床症状及血指标的改善。而耐药菌感染、肺炎吸收延迟、样本量小、患者代表性不够、随访时间不足及影像学观察节点的选择也都会影响上述结果。由于目前方法学所限,通过影像学评分量化肺炎的过程本身存在一定的主观因素,最终评分界值的判定在各种类型肺炎中也可能具有差异。延长随访时间、扩大样本量、优化针对吸入性肺炎影像学量化评分方法可能有助于更好地展示血必净对吸入性肺炎影像学吸收的影响。虽然血必净已在多种炎症相关疾病的治疗中显示出肯定的疗效,但目前仍存在一些科学空白。未来需进行更多关于血必净药代动力学、与抗生素的相互作用、真实世界的有效性和安全性、生物活性成分的药理机制和较大规模的临床试验研究[18]。
本研究通过随机、对照、小样本临床试验评价血必净对老年吸入性肺炎的治疗效果及安全性,旨在为吸入性肺炎患者探索新的治疗方案。然而,鉴于纳入试验数据的高偏倚风险和低质量,目前尚不能对血必净在吸入性肺炎中的常规使用得出任何结论。未来可通过设计更严谨的多中心、大规模临床试验进一步验证。

