LncRNA-MEG3在心肌纤维化过程中的表达变化研究
蒋书美,施 鹏,王立超,王 璨,徐盛松,石开虎
心肌纤维化是心血管疾病中心脏重塑的主要病理特征,包括心房颤动(atrial fibrillation,AF)、心肌梗死(myocardial infarction,MI)和心脏衰竭等,其特征是心肌成纤维细胞(cardiac fibroblasts,CFs)增加、心肌间质胶原合成增加、降解减少、排列紊乱,主要机制为CFs的激活进而转化为肌成纤维细胞导致I型胶原(Collagen type I,Collagen I)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等蛋白的合成增加,最后细胞外基质(extracellular matrix,ECM)过度沉积发生心肌纤维化。研究表明,表观遗传修饰参与调控CFs细胞的活化增殖,如非编码RNA修饰等,但调节心肌纤维化的具体发生机制仍有待于研究阐明。
长链非编码RNA(long non-coding RNA,LncRNA)是一类长度超过200个核苷酸的RNA分子,在多种层面上参与相关目的基因表达的调控。有文献报道,LncRNA在心血管疾病发生中起着重要的调节作用。人母系表达基因3(maternally expressed gene3,MEG3)位于人类染色体14 q 32.3区的DLK1-MEG3位点,其编码产物是一条长约1.6 kb的LncRNA,功能上MEG3具有抑制肿瘤细胞的增殖和转移作用,但其对心肌纤维化调控的研究目前知之甚少。该研究以异丙肾上腺素(isoproterenol,ISO)构建的大鼠心肌纤维化模型及TGF-β1刺激诱导CFs模型为研究对象,分别检测MEG3的表达变化情况,以此来探究MEG3对大鼠心肌纤维化及CFs活化增殖的可能作用,为心肌纤维化的机制研究和预防提供潜在的靶点。
1 材料与方法
1.1 主要材料
1.1.1
实验动物 雄性SD大鼠20只,7~8周龄,体质量(200±10)g,乳鼠40只,出生1~3 d,体质量(10±2)g,均购于安徽医科大学实验动物中心,动物许可证号:SYXK(皖)2017-001。1.1.2
主要试剂 DMEM培养基(美国HyClone公司);胰蛋白酶(加拿大WISENT公司);蛋白酶抑制剂PMSF、细胞组织裂解液RIPA(上海Beyotime公司);α-SMA、Collagen I一抗(武汉博士德生物公司)及相关二抗(北京中杉金桥);TRIzol试剂(美国Life Technology公司);MEG3及相关胶原分子的引物(上海生工生物工程有限公司);TBGreen试剂(日本TaKaRa公司);CCK-8试剂(Biosharp公司)。1.1.3
主要仪器 EPS电泳仪(上海天能科技有限公司)、显影机等相关Western blot设备(上海Tanon公司);生物安全柜、细胞培养箱(美国Thermo Fisher Scientific公司);预冷离心机(德国Eppendorf公司);倒置相差显微镜(日本Olympus公司);逆转录仪、PCR扩增仪(美国Bio-Rad公司);酶标仪(美国Thermo Fisher Scientific公司)。1.2 方法
1.2.1
心肌纤维化动物模型的建立及病理学检测 取SD大鼠20只,随机分为ISO组和对照组。ISO组大鼠腹部皮下注射ISO 5 mg/kg,2周,对照组腹部皮下注射等量生理盐水,2周,取心脏组织标本。一部分用甲醛液固定后石蜡切片,行HE、Masson染色,观察胶原表达变化;另一部分用于提取组织蛋白和RNA,行Western blot、qRT-PCR实验。1.2.2
提取乳鼠原代心肌成纤维细胞 取出生1~3 d的乳鼠,将其处死消毒后取出心脏并用PBS清洗两遍。然后取心脏组织,将其剪碎放置50 ml离心管中并加入胰蛋白酶和Ⅱ型胶原酶(2 ∶1)消化10 min后取上清液至10 ml离心管中,立即加入培养基中和消化酶,接着离心机中离心10 min(转速3 500 r/min、重复3次),离心后弃上清液加入培养基吹匀接种至培养瓶中并将其转至培养箱中培养1.5 h,弃去培养瓶中的培养基,贴壁的即是CFs,显微镜下观察CFs为大的梭型有触角的细胞。待细胞长至80%左右时予以传代处理,传至1~2代后行相关实验。1.2.3
CFs分组与培养 用胰酶将培养瓶中的细胞消化下来后进行细胞计数,吹匀后等量种到6孔板中。TGF-β1组予以10 ng/ml TGF-β1刺激作用CFs,对照组为未予以TGF-β1刺激,放入细胞培养箱相同条件下培养48 h。1.2.4
Western blot法检测相关蛋白的表达 用配制好的混合裂解液(PMSF ∶RIPA=1 ∶100充分混匀)在冰浴中裂解提取各组的组织和细胞蛋白。按配方配制电泳缓冲液,转膜液,TBST。电泳:按分组加入相应组织及细胞蛋白样品;接电源、80 V、30 min后改 120 V、1 h左右。转膜:设定恒流200 mA进行转膜100 min左右。封闭:将膜放入TBST配制的5%脱脂牛奶,摇床慢摇封闭1.5 h左右。孵育抗体:将膜放入配制好的一抗,4 ℃冰箱过夜;第2天用TBST液快摇床洗膜3次、每次10 min;然后孵二抗,摇床慢摇孵育1 h,再用TBST液洗3次后显影。1.2.5
qRT-PCR法检测相关mRNA与MEG3的表达 用预冷的TRIzol提取组织和细胞的总RNA,然后加入DEPC水吹匀测浓度和纯度,确保260 nm/280 nm OD值在1.8~2.0之间。将总RNA逆转录成cDNA,然后行目标cDNA 的扩增(qRT-PCR):用无酶水配制目标基因的引物,取cDNA样本1.6 μl、被扩增基因的引物3.2 μl加入到相应的八联管中,然后在避光的环境下每孔加入5.2 μl的TBGreen至总反应体系总量为10 μl。按如下步骤进行目标基因扩增:预变性阶段50 ℃ 2 min,95 ℃ 10 min;扩增阶段95 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s,共进行40个循环;溶解曲线阶段 95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。以β-actin为内参,用2法计算各组目标基因的表达量。引物序列见表1。
表1 目的基因引物序列
1.2.6
CCK-8法检测CFs的OD值 用胰酶将培养瓶中的细胞消化下来进行细胞计数,以3 000个细胞/孔均匀的接种到96孔板中,每孔加培养基至100 μl。将CFs分为A、B、C三组,其中A组为未加TGF-β1刺激,B、C两组分别予以10 ng/ml TGF-β1刺激作用24、48 h,在相同条件下培养48 h后,每孔加入4 ℃保存的CCK-8试剂10 μl,再放入细胞培养箱中继续培养3 h,最后测每孔在波长450 nm处的OD值。
2 结果
2.1 大鼠心肌组织病理学改变
心肌组织切片HE染色中细胞核被染成蓝色,细胞质及细胞外基质被染成红色,与对照组比较,ISO组的心肌细胞体积明显增大、大小不一且排列紊乱,组织病理改变更为明显,见图1。Masson染色中细胞核被染成黑色,细胞外胶原纤维被染成蓝紫色,与对照组比较,ISO组的大鼠心肌细胞肥大紊乱,心肌胶原纤维化面积明显增多,见图2。
图1 大鼠心肌组织的HE染色图 ×400A:对照组;B:ISO组
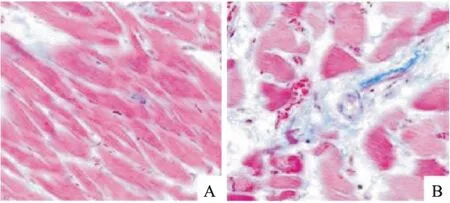
图2 大鼠心肌组织的Masson染色图 ×400A:对照组;B:ISO组
2.2 大鼠心肌组织中Collagen I、α-SMA分子蛋白和mRNA的表达变化
Western blot检测大鼠心肌组织蛋白结果提示:与对照组比较,ISO组的心肌组织中Collagen I、α-SMA分子蛋白表达明显增加,差异有统计学意义(P
<0.05),见图3。 qRT-PCR法检测结果提示:与对照组比较,ISO组的心肌组织中Collagen I、α-SMA的mRNA表达明显增加,差异有统计学意义(P
<0.05),见图4。
图3 大鼠心肌组织中Collagen I、α-SMA分子的蛋白表达变化A:对照组;B:ISO组;与对照组比较:*P<0.05

图4 大鼠心肌组织中Collagen I、α-SMA的mRNA表达变化A:对照组;B:ISO组;与对照组比较:*P<0.05
2.3 TGF-β1 刺激诱导CFs中Collagen I、α-SMA分子蛋白及mRNA的表达变化
用TGF-β1刺激CFs 48 h后,Western blot检测结果提示:与对照组比较,TGF-β1组中Collagen I、α-SMA分子蛋白表达明显增加,差异有统计学意义(P
<0.05),见图5。qRT-PCR检测结果提示:与对照组比较,TGF-β1组中Collagen I、α-SMA的mRNA表达明显增加,差异有统计学意义(P
<0.05),见图6。
图5 TGF-β1刺激CFs 48 h后Collagen I、α-SMA的蛋白表达变化A:对照组;B:TGF-β1组;与对照组比较:*P<0.05
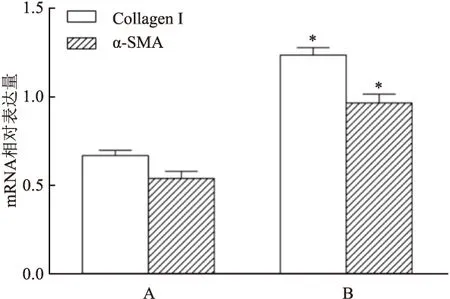
图6 TGF-β1刺激CFs 48 h后Collagen I、α-SMA的mRNA表达变化A:对照组;B:TGF-β1组;与对照组比较:*P<0.05
2.4 CCK-8检测TGF-β1刺激CFs后的OD值变化
CCK-8检测结果提示:与对照组比较,TGF-β1刺激CFs 24 h和48 h后CFs的OD值均明显增加,差异有统计学意义(P
<0.
05),见图7。说明TGF-β1刺激CFs后的细胞增殖活性有所增加。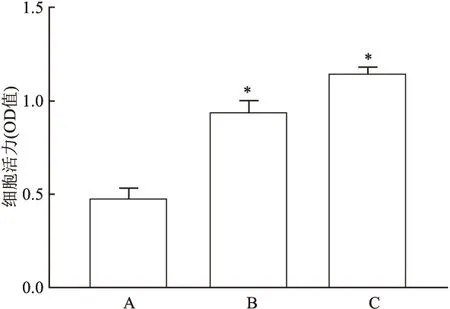
图7 TGF-β1刺激CFs 24、48 h后CFs的OD值变化A:对照组;B:TGF-β1刺激CFs 24 h后;C:TGF-β1刺激CFs 48 h后;与对照组比较:*P<0.05
2.5 大鼠心肌组织和CFs中LncRNA-MEG3的表达变化
qRT-PCR检测结果提示:与对照组比较,在动物实验组(ISO组)的心肌组织中和细胞实验组(TGF-β1组)的CFs中LncRNA-MEG3的表达都明显减少,差异有统计学意义(P
<0.
05),见图8。
图8 大鼠心肌组织和CFs中MEG3的表达变化A:动物实验;B:细胞实验;与对照组比较:*P<0.05
3 讨论
心肌纤维化被认为是众多心脏疾病的终末病理表现,CFs的活化增殖导致α-SMA、Collagen I等胶原分子合成的增加是心肌纤维化的主要发生机制,但具体发生机制尚未完全研究清楚。研究表明LncRNAs在细胞增殖、分化和变性中发挥重要作用,包括对心肌纤维化中CFs的活化增殖过程也具有重要的调控作用,例如本课题组前期验证过LncRNA-Gas5可通过调控CFs的凋亡来影响心肌纤维化的发生,起到抑制心肌纤维化的作用。
LncRNA-MEG3是非编码RNA中的一种,其在肿瘤增殖中研究较多,且已被证明具有抑制肿瘤细胞增殖生长的作用,如在肺癌、胃癌等肿瘤中LncRNA-MEG3表达降低。同时也有报道LncRNA-MEG3在糖尿病肾病肾脏纤维化和肺纤维化发生过程中起调控作用,但其在心肌纤维化发生过程中的机制研究较少。本研究在大鼠ISO模型的心肌组织中和TGF-β1刺激 CFs中检测到α-SMA、Collagen I在蛋白和基因水平都较对照组表达显著增加;同时TGF-β1刺激CFs后较对照组增殖活性明显增加,说明心肌纤维化动物和细胞模型建立成功。我们发现在心肌纤维化动物和细胞模型组中LncRNA-MEG3的表达较对照组都是明显降低的。Piccoli et al研究在心脏疾病晚期重塑过程中,CFs中的LncRNA-MEG3表达也是下调的,其结果与本研究是一致的。间接说明LncRNA-MEG3可能在心肌纤维化及CFs活化增殖形成过程中发挥了负调控作用。
综上所述,本研究发现了LncRNA-MEG3在心肌纤维化动物和细胞模型组中表达明显降低,其在心肌纤维化过程中可能起到抑制作用,但本研究只是在组织和细胞水平的初步验证,LncRNA-MEG3在心肌纤维化发生中的具体调控通路还有待于继续深入研究。

