线粒体分裂、线粒体自噬在烟草提取物诱导的支气管上皮细胞损伤模型中的作用
王素文,宋小敏,李忱菲,魏良煜,张 海,李 锋,王 炯
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是气道和肺实质的慢性炎症性疾病,据统计,全球有3.84亿患者,具有高发病率和高死亡率的特点。多种因素可以导致COPD的发生发展,其中香烟烟雾是最常见的致病因素。研究表明,香烟烟雾可导致气道上皮细胞线粒体结构与功能的紊乱,与COPD的发生发展紧密相关。
线粒体质量控制系统主要由线粒体分裂和线粒体自噬组成,是维持线粒体正常网络结构的必备条件,也是维护线粒体功能正常的保障,该系统的紊乱会严重影响细胞功能,甚至导致细胞死亡。线粒体分裂过程主要由动力相关蛋白 1(dynamin related protein 1,DRP1)和线粒体分裂因子(mitochondrial fission factor,MFF)调控。而线粒体自噬过程受多种分子调控,损伤的线粒体最终由sequestosome 1(SQSTM1/p62)和微管相关蛋白1轻链3B,(microtubule-associated protein 1 light chain 3 beta,LC3B)形成自噬小体,由自噬小体呈送至溶酶体,进而通过自噬-溶酶体降解途径完成线粒体的降解和再利用。线粒体自噬与细胞程序性坏死密切相关,后者是细胞程序性死亡的新形式,在受体相互作用蛋白激酶3(receptor-interacting protein kinase 3,RIPK3)、RIPK1和混合谱系激酶结构域样蛋白(mixed-lineage kinase domain-like protein,MLKL)共同作用下发挥作用。程序性坏死的主要特征包括ATP水平下降,细胞内氧化物(reactive oxygen species,ROS)积累,钙超载和线粒体通透性转换孔的开放。该研究通过建立烟草提取物(cigarette smoke extract,CSE)诱导的支气管上皮细胞损伤模型并加以干预,探讨线粒体分裂和线粒体自噬及其下游的细胞程序性坏死在该模型中的变化与作用。
1 材料与方法
1.1 实验材料
Beas 2b细胞株购自中国科学院上海生命科学研究所;DMEM高糖培养基、FBS购自美国GIBCO公司;BCA蛋白浓度测定试剂盒、青链霉素混合液、0.25%胰酶消化液、SDS-PAGE蛋白上样缓冲液(5X)购自上海碧云天生物科技有限公司;万宝路香烟购自龙岩烟草工业有限公司;细胞增殖/毒性检测试剂盒CCK8购自日本东仁公司;DCFH-DA购自美国Sigma-Aldrich公司;MitoTrackerGreen FM、MitoSOXRed Mitochondrial Superoxide Indicator购自美国Invitrogen公司;TRIzol试剂、Prime ScriptTM RT Master Mix Kit、Power Green qPCR mix购自大连TaKaRa公司;DRP1、MFF、β-actin抗体、HRP标记的山羊抗兔IgG二抗、HRP标记山羊抗小鼠IgG购自美国Cell signaling Technology公司;SQSTM1/p62、LC3B购自美国Abcam公司;Urolithin A、Mdivi-1购自美国SELLECK公司。1.2 实验分组
体外培养支气管上皮细胞系Beas 2b细胞,分为对照组、5%CSE暴露组、5%CSE暴露+10 μmol/L线粒体分裂抑制剂Mdivi-1(Md)预处理组和5%CSE暴露+10 μmol/L线粒体自噬促进剂Urolithin A(UA)预处理组。预处理组药物于5%CSE暴露前2 h加入与细胞共孵育。1.3 实验方法
1.3.1
细胞培养 Beas 2b细胞接种于含10% FBS的DMEM高糖培养基的无菌培养皿中,置于37 ℃、5% CO培养箱中孵育。细胞长至铺满皿底时用0.25%胰酶消化,传代或铺板。1.3.2
CSE的制备 万宝路香烟去除过滤嘴,用50 ml注射器以50 ml/min速度抽吸香烟烟雾,1支香烟完全燃烧产生的烟雾通过含5 ml无血清DMEM培养基的气体采集管,该溶液用0.22 μm滤膜过滤除菌,最后所得溶液定义为100% CSE,在使用时稀释成不同浓度,现制现用,15 min内用于实验。1.3.3
细胞增殖实验 使用CCK8试剂测定细胞活力。Beas 2b细胞消化传代,细胞计数调整浓度,接种于96孔板,每孔8 000个细胞,96孔板四周孔用PBS填充。铺板过夜待细胞贴壁,给予CSE和药物再培养24 h,弃培养基,用PBS清洗,根据CCK8操作说明,将检测液与培养基1 ∶9配置成工作液,每孔加100 μl工作液,继续孵育2 h后,用酶标仪测定每孔450 nm处吸光度(optical delnsity,OD),计算出每组细胞相对增殖活性。1.3.4
氧化应激检测 使用DCFH-DA测定细胞内ROS。细胞接种于6孔板中,每孔加1 ml新配的DCFH-DA工作液,在37 ℃温箱中避光孵育10 min,分别使用流式细胞仪和荧光显微镜检测。使用MitoSOX Red测定线粒体ROS,细胞接种于96孔黑色板中,每孔8 000个细胞,每组6个复孔,96孔板四周孔用PBS填充。根据MitoSOX Red操作说明制成5 mmol/L的工作液,每孔加100 μl工作液,避光孵育15 min,用预温的PBS清洗两次,激发光510 nm和发射光580 nm处用荧光酶标仪检测。1.3.5
线粒体形态检测 使用MitoTrackerGreen FM染液检测活细胞线粒体形态改变,细胞接种于共聚焦培养皿中,每孔5 000个细胞,按操作说明将储存液配成100 nmol/L的工作液,每孔加500 μl,避光在37 ℃温箱中孵育20 min,用无血清培养基清洗后,即刻用共聚焦显微镜拍摄,观察线粒体形态变化。1.3.6
qRT-
PCR 实验 检测炎症因子白细胞介素 (interleukin,IL)-1β、IL-6、IL-18、趋化因子配体(chemokine ligands1,CXCL)1、CXCL8、程序性坏死因子(RIPK1、RIPK3、 MLKL)的mRNA水平。细胞培养在6孔板中,每孔加1 ml TRIzol提取总RNA,用逆转录试剂盒合成cDNA随后进行qRT-PCR,反应条件:95 ℃、30 s;95 ℃、5 s;60 ℃、34 s,40个循环,实验结果用2方法计算。引物序列见表1。
表1 炎症因子和程序性坏死分子的引物序列
1.3.7
Western blot实验 细胞培养在6孔板中,每孔加100 μl的RIPA裂解缓冲液冰上裂解15 min,所提取的蛋白用BCA试剂盒定量。40 μg总蛋白在10.0%或12.5%的SDS-PAGE电泳,300 mA、60 min将蛋白转移至PVDF膜,5%脱脂牛奶室温封闭2 h,然后分别放入一抗稀释液(一抗配比 1 ∶1 000)中,4 ℃摇床孵育过夜。二抗稀释液(二抗配比 1 ∶1 500)孵育2 h后显影。结果用Image J软件进行灰度分析统计。1.4 统计学处理
采用SPSS 20.0软件进行单因素方差分析,制图使用GraphPad Prism 6.0软件。所有数值采用mean±SD表示,假设检验水准按α=0.05判定,P
<0.05为差异有统计学意义。2 结果
2.1 Md、UA抑制CSE暴露细胞的氧化应激水平
在细胞培养基中加入不同浓度CSE与细胞共培养24 h。5% CSE与细胞共培养时细胞活力出现下降,10% CSE时细胞活力明显下降。随着CSE浓度的增高,细胞内线粒体ROS逐渐增高,在5% CSE浓度时到达最高值(142.3±16.2)%,差异有统计学意义(P
<0.001)。于是选择5% CSE进行后续试验。见图1。在5% CSE暴露的细胞中,分别加入10 μmol/L的Md和10 μmol/L的UA,对细胞增殖活力无明显影响(P
>0.05)。5% CSE暴露导致细胞内ROS显著升高[(132.4±6.4)%,P
<0.001]、线粒体ROS显著升高[(167.5±11.0)%,P
<0.001]。Md、UA均可降低CSE暴露细胞内ROS、线粒体ROS水平,差异有统计学意义(均P
<0.01,均P
<0.001),即Md/UA虽然不能提高细胞增殖活力,但可以降低CSE诱导的细胞氧化应激水平。见图1。
图1 Md、UA对CSE暴露细胞的氧化应激水平的影响A:不同浓度CSE对细胞增殖的影响;B:不同浓度CSE对细胞线粒体ROS的影响;与对照组比较:**P<0.01,***P<0.001;C:Md、UA对CSE暴露细胞增殖的影响;D:Md、UA对CSE暴露细胞线粒体ROS的影响;E:Md、UA对CSE暴露细胞总ROS的影响;与CSE组比较:**P<0.01,***P<0.001
2.2 Md、UA恢复CSE暴露细胞的线粒体形态
正常的细胞内线粒体为网络状结构,在应激状态下(如烟草暴露),线粒体的网络结构发生改变,可表现为线粒体聚集。对照组细胞线粒体形态正常,呈网络状结构; 5% CSE暴露组细胞的线粒体网络状结构破坏、线粒体聚集成团[(18.4±6.2)%,P
<0.05]。Md、UA预处理部分恢复CSE暴露的细胞线粒体网络结构[(110.5±56.6)%、(91.5±15.9)%,P
<0.01、P
<0.05]。见图2。
图2 Md、UA对CSE暴露细胞线粒体形态的影响 ×630A:Md、UA对CSE暴露细胞线粒体形态变化代表图;B:线粒体面积统计分析图;与CSE组比较:*P<0.05,**P<0.01
2.3 Md、UA抑制CSE暴露细胞的炎症因子水平
5% CSE刺激细胞炎症因子(IL-1β、IL-6、IL-18、CXCL1、CXCL8)的mRNA表达增加(P
<0.001、P
<0.01、P
<0.01、P
<0.05、P
<0.05)。Md预处理抑制炎症因子(IL-1β、IL-6、IL-18、CXCL1、CXCL8)mRNA表达(P
<0.01、P
<0.05、P
<0.05、P
<0.05、P
<0.01),UA预处理抑制炎症因子(IL-1β、IL-6、IL-18、CXCL8)mRNA表达(P
<0.01、P
<0.01、P
<0.05、P
<0.01)。见图3。
图3 Md、UA对CSE暴露细胞炎症因子mRNA水平的影响 1:对照组;2:CSE;3:CSE+Md;4:CSE+UA;与CSE组比较:*P<0.05,**P<0.01,***P<0.001
2.4 Md、UA抑制CSE暴露细胞的线粒体分裂蛋白表达
5% CSE组的线粒体分裂蛋白(DRP1、MFF)表达增高[(1.459±0.281)、(2.023±0.416)],且差异有统计学意义(P
<0.05、P
<0.01)。Md、UA预处理均可抑制线粒体分裂蛋白(DRP1、MFF)表达水平,且差异有统计学意义(P
<0.01、P
<0.05、P
<0.05、P
<0.05)。见图4。
图4 Md、UA对 CSE暴露细胞的线粒体分裂蛋白表达的影响 A:Md、UA对CSE暴露细胞线粒体分裂蛋白DRP1变化代表图;B:Md、UA对CSE暴露细胞线粒体分裂MFF蛋白变化代表图;C:DRP1蛋白统计分析图;D:MFF蛋白统计分析图;1:对照组;2:CSE;3:CSE+Md;4:CSE+UA;与CSE组比较:*P<0.05,**P<0.01
2.5 Md、UA影响CSE暴露细胞的线粒体自噬蛋白的蛋白表达水平
5% CSE刺激细胞中线粒体自噬蛋白p62/SQSTM1蛋白表达增高[(3.593±0.097),P
<0.001],LC3BⅡ/Ⅰ蛋白表达下降[(0.528±0.032),P
<0.001]; Md预处理增加线粒体自噬蛋白p62/SQSTM1蛋白表达水平[(4.327±0.534),P
<0.05],不影响线粒体自噬蛋白LC3BⅡ/Ⅰ表达。UA预处理抑制线粒体自噬蛋白p62/SQSTM1蛋白表达[(2.901±0.300),P
<0.05],增加线粒体自噬蛋白LC3BⅡ/Ⅰ蛋白表达[(0.805±0.202),P
<0.05)]。见图5。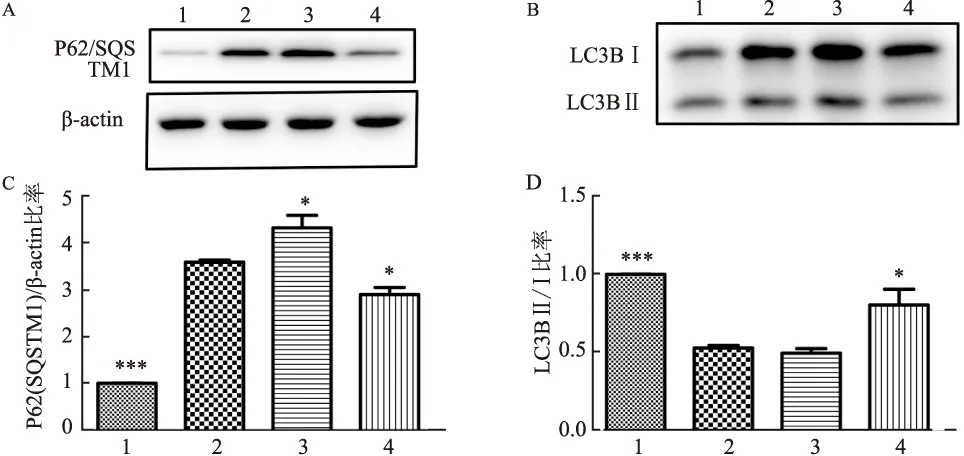
图5 Md、UA对 CSE暴露细胞的线粒体自噬蛋白表达的影响 A:Md、UA对CSE暴露细胞线粒体自噬蛋白p62/SQSTM1变化代表图;B:Md、UA对CSE暴露细胞线粒体自噬蛋白LC3BⅡ/Ⅰ变化代表图;C:p62/SQSTM1蛋白统计分析图;D:LC3BⅡ/Ⅰ蛋白统计分析图;1:对照组;2:CSE;3:CSE+Md;4:CSE+UA;与CSE组比较:*P<0.05,***P<0.001
2.6 Md、UA抑制CSE暴露细胞的程序性坏死组分mRNA水平
5% CSE刺激细胞中程序性坏死组分(RIPK1、RIPK3、MLKL)mRNA表达增高(均P
<0.001)。Md预处理抑制细胞程序性坏死组分(RIPK1、RIPK3、MLKL)mRNA表达水平(P
<0.001、P
<0.01、P
<0.01)。UA处理抑制细胞程序性坏死组分(RIPK1、MLKL)mRNA表达水平(P
<0.01、P
<0.001)。见图6。
图6 Md、UA对CSE暴露细胞的细胞程序性坏死组分mRNA水平的影响1:对照组;2:CSE;3:CSE+Md;4:CSE+UA;与CSE组比较:**P<0.01,***P<0.001
3 讨论
外部刺激物如香烟烟雾和环境毒素,或细胞内刺激物如ROS,均会导致线粒体受损,线粒体功能障碍。受损伤线粒体积累会导致ROS增多、ATP水平下降、线粒体DNA损伤和错误折叠的蛋白增多,这会导致细胞损伤进一步加重。缺乏功能性线粒体的人肺泡上皮细胞中促炎细胞因子产生增加和细胞修复受损,可见线粒体的功能正常对于细胞抵抗外界刺激具有非常重要的作用。本研究证实,CSE可引起气道上皮细胞损伤和线粒体损伤,具体表现为细胞内ROS、线粒体ROS增加,炎症因子表达增加,以及线粒体网络状结构皱缩、线粒体分裂蛋白表达增加、细胞程序性坏死组分mRNA表达增加。
在应激状态下,线粒体分裂增多,线粒体一分为二,可重新利用的线粒体通过线粒体融合快速供能,而线粒体分裂产生的碎片通过线粒体自噬将受损的线粒体通过形成自噬小体重新分解再利用,从而减少损伤线粒体的积累,维持细胞稳态。线粒体动态调节是个复杂且相互影响的过程,不同的调控过程对细胞的结局会有不同的影响。当过表达DRP1会导致线粒体碎裂,线粒体膜电位下降;当敲除DRP1的受体分子FIS1或MFF,会抑制线粒体分裂,线粒体自噬水平下降,恢复线粒体膜电位。线粒体解偶联剂会导致线粒体功能障碍,通过上调DRP1表达水平,增加线粒体自噬水平。有研究显示在COPD患者肺组织中线粒体自噬不充分导致线粒体碎片增加,同时,线粒体自噬水平下降伴随p62/SQSTM1蛋白的积累。在哺乳动物中,LC3BⅠ到LC3BⅡ(自噬体膜相关的磷脂酰乙醇胺结合形式)的转化是自噬体形成的标志,常用LC3BⅡ/Ⅰ增高提示自噬水平增高。本研究中5% CSE刺激气道上皮细胞,线粒体分裂蛋白(DRP1、MFF)蛋白表达增加,而线粒体自噬蛋白p62/SQSTM1水平增高,同时LC3BⅡ/Ⅰ水平下降,即线粒体自噬水平下降。本研究证实香烟烟雾提取物诱导气道上皮损伤模型中线粒体质量控制系统失衡,即线粒体分裂增加而线粒体自噬下降。
凋亡和程序性坏死都是程序性细胞死亡方式,且凋亡和程序性坏死在COPD中均发挥重要的作用。体外研究显示,CSE作用于Beas 2b细胞导致程序性坏死,细胞膜完整性破坏,损伤相关的分子模式(damage associated molecularpattern,DAMP) 增加。在小鼠模型中,烟草暴露会增加小鼠支气管肺泡灌洗液中DAMP的水平和中性粒细胞的数量。本研究证实CSE刺激Beas 2b细胞的程序性坏死组分mRNA水平增加,即增加程序性坏死水平。
Md是一种喹唑啉酮,是DRP1的选择性抑制剂,可抑制线粒体分裂。有研究显示,Md通过减少线粒体分裂而抑制线粒体自噬水平从而发挥保护作用。本研究中加入10 μmol/L Md预处理,检测到细胞内、线粒体ROS水平下降,炎症因子mRNA水平下降,线粒体网络状结构部分恢复,线粒体分裂蛋白水平下降,p62/SQSTM1蛋白水平增加,LC3BⅡ/Ⅰ蛋白水平无明显改变,细胞程序性坏死组分mRNA水平下降。即本研究证实,在CSE诱导的肺上皮细胞损伤模型中,Md抑制线粒体分裂、抑制线粒体自噬,恢复线粒体结构和功能,从而减少细胞程序性死亡,抑制细胞炎症反应。
UA是鞣花单宁的代谢物之一,在秀丽隐杆线虫和人类神经元细胞中可促进线粒体自噬,是一种新型的线粒体自噬促进剂。本研究发现,10 μmol/L UA抑制细胞内、线粒体内ROS水平、炎症因子mRNA水平,部分恢复线粒体网络结构,抑制线粒体分裂蛋白水平和线粒体自噬蛋白p62/SQSTM1蛋白水平,增加LC3BⅡ/Ⅰ蛋白水平,抑制细胞程序性坏死组分mRNA水平。即本研究证实,在CSE诱导的肺上皮细胞损伤模型中,UA抑制线粒体分裂水平、增加线粒体自噬水平,恢复线粒体结构和功能,从而减少细胞程序性死亡,抑制细胞炎症反应。
综上所述,本研究证实,CSE诱导支气管上皮细胞损伤模型中存在线粒体质量控制系统失衡,即线粒体分裂增多以及线粒体自噬不足。通过抑制线粒体分裂和适度促进线粒体自噬,进而抑制细胞程序性坏死组分mRNA水平,对细胞发挥保护性作用,表现为抑制氧化应激和炎症反应,部分恢复线粒体结构。本实验仍有不足之处,关于线粒体质量控制在CSE诱导支气管上皮细胞损伤模型中的分子作用机制在后续实验会进一步探索。

