子宫内膜异位症患者体内氧化应激状态及其与IVF-ET的相关性研究
高子轩,罗小婉,栾 峰,孙广范,刘佳杰,尚 雪
(中山市博爱医院 1.妇科,2.生殖中心,广东 中山 528400)
子宫内膜异位症是临床常见的妇科疾病,是由于各种原因引起的内膜细胞种植在子宫内膜外,患者临床表现包括痛经、性交痛、不孕症等,部分女性甚至要借助辅助生殖技术(assisted reproductive technology,ART)完成生育问题[1]。然而,此类患者接受ART时易发生卵巢低反应、胚胎低植入率及低妊娠率等。氧化应激(oxidative stress,OS)与衰老、慢性炎症有关。活性氧(reactive oxygen species,ROS)在机体内蓄积后会加剧氧化应激反应,而氧化应激在子宫内膜异位症的发病机制和病情进展中起重要作用。ROS可促进腹腔内子宫内膜细胞的黏附和生长,进而导致子宫内膜异位症的发生和发展[2]。但是目前国内外关于氧化应激标记物在子宫内膜异位症患者中的表达及其与妊娠结局的关系报道较少。因此,本文探讨了ROS及其相关的氧化产物丙二醛(malondialdehyde,MDA)、总抗氧化能力(total antioxidant capacity,TAC)在子宫内膜异位症患者中的表达及其与体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)的相关性,报道如下。
1资料与方法
1.1研究对象
选择2018年7月至2020年6月就诊于中山市博爱医院妇科的子宫内膜异位症术后不孕症患者50例设为观察组,患者经开腹或腹腔镜术后病理诊断确诊为内异症。患者年龄22~34岁,平均(30.69±4.34)岁,不孕年限1~6年,平均(3.23±0.51)年,身体质量指数(body mass index,BMI)18.5~23.9 kg/m2,平均(21.32±2.95)kg/m2,平均血清抗苗勒氏管激素(anti-Mullerian hormone,AMH)水平(2.29±0.68)ng/mL。选择同期治疗的输卵管不孕症20例为对照组,年龄21~33岁,平均(31.11±4.37)岁;不孕年限1~7年,平均(3.29±0.57)年;BMI(18.9~23.6)kg/m2,平均(22.07±2.98)kg/m2;平均血清AMH水平(2.53±0.61)ng/mL。所有入选对象排除甲状腺疾病异常、肾上腺疾病、免疫系统疾病、卵巢储备功能降低、男方精液异常、术前6个月使用激素类药物或抗氧化药物等,两组患者基本临床资料比较差异无统计学意义(P>0.05)。
1.2方法
两组患者均接受IVF-ET,具体方法如下:取卵操作完毕后于卵泡液中确定卵-冠-丘复合物,并将其转入培养皿中进行培养,经卵母细胞成熟分型、处理精液并完成共同培养,16~18h受精后完成效果评估。受精24h评估受精卵卵裂情况,在取卵后3~5d进行胚胎评级评估,并将1~2枚胚胎移植入宫腔内,两组患者均给予黄体支持治疗。于移植术后第12~14d查血人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)以确定是否妊娠,妊娠者继续黄体支持治疗直至移植后7~8周停药。移植后4周时采用阴道B超检查以确定患者是否宫内妊娠,移植后12周B超检查胎儿发育状况。
1.3观察指标
①氧化应激标记物测定,两组患者均于取卵日空腹抽血并留取卵泡液,采用酶联免疫吸附试验法测定ROS、MDA及TAC浓度;②分析子宫内膜异位症患者IVF-ET结局(包括获卵数、成熟卵率、受精率、优质胚胎率、种植率、临床妊娠率)与ROS、MDA、TAC的相关性。
1.4统计学分析
本研究获得的数据采用SPSS 18.0统计软件处理。计量资料采用独立样本t检验进行统计分析,计数资料采用卡方检验进行统计分析,子宫内膜异位症患者IVF-ET结局与氧化应激标记物的相关性采用Pearson相关性分析,以P<0.05视为差异有统计学意义。
2结果
2.1两组患者氧化应激标志物浓度比较
观察组血清和卵泡液中ROS、MDA浓度均显著高于对照组(P<0.05),而TAC浓度均显著低于对照组(P<0.05),见表1。
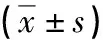
表1 两组患者氧化应激标志物比较
2.2两组患者IVF-ET结局比较
观察组成熟卵率、受精率均显著低于对照组(P<0.05),而两组平均获卵数、优质胚胎率、种植率、临床妊娠率比较差异均无统计意义(P>0.05),见表2。

表2 两组患者IVF-ET结局比较
2.3子宫内膜异位症患者IVF-ET结局与血清氧化应激标记物的相关性分析
Pearson相关性分析结果表明子宫内膜异位症患者血清ROS、MDA均与成熟卵率、受精率呈显著负相关(P<0.05),而血清TAC均与成熟卵率、受精率呈显著正相关(P<0.05),血清氧化应激标记物与其他IVF-ET指标均无显著相关性(P>0.05),见表3。
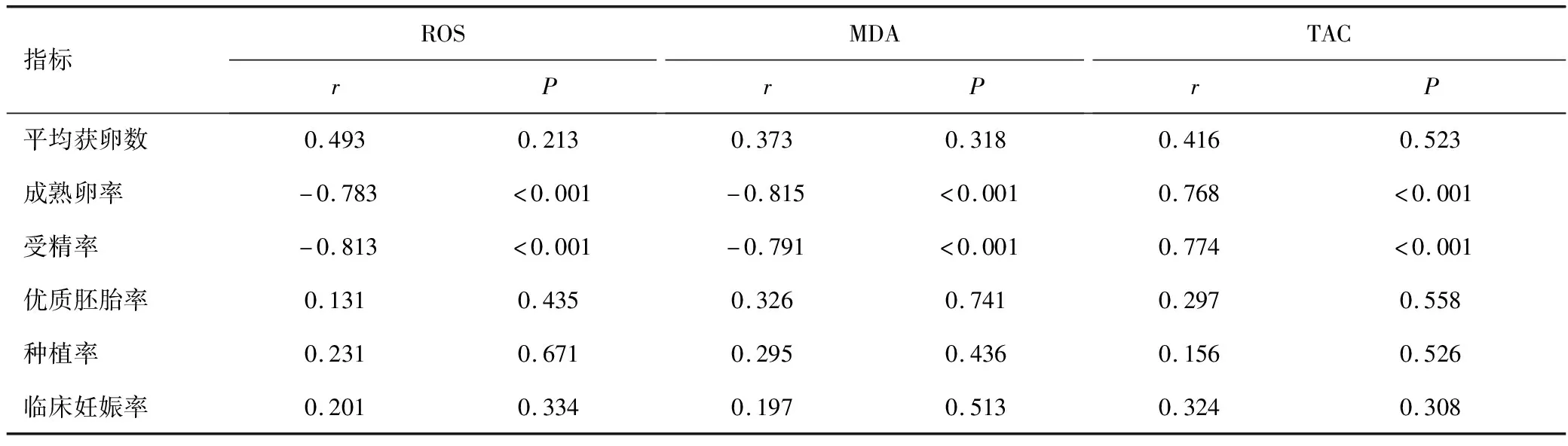
表3 子宫内膜异位症患者IVF-ET结局与氧化应激标记物的相关性分析
3讨论
3.1子宫内膜异位症对女性生育的影响
子宫内膜异位症虽为良性病变,但具有侵袭、转移和复发等恶性生物学行为,其是一种雌激素依赖的盆腔炎疾病,特征是子宫内膜组织(腺体和间质)在子宫腔外着床和生长[3]。目前国内外学者认为该病的病因和发病机制主要基于三种理论:月经逆行、体腔化生和诱导理论[4]。研究报道机体的免疫系统紊乱以及炎性介质的增多可能参与了内异症的发病,而卵巢微环境和卵泡液中适宜的ROS 浓度对于卵泡发育起重要作用[5-6]。随着子宫内膜异位症病情的进展,盆腔可出现异位结节,临床表现为慢性盆腔痛和性交痛[7]。此外,内异症还可引起盆腔粘连,甚至波及输卵管而导致不孕症。部分女性子宫内膜异位于卵巢形成囊肿,或因卵巢子宫内膜异位囊肿手术而影响卵巢功能,导致卵巢储备功能下降和IVF-ET中卵巢低反应。子宫内膜异位症患者的盆腔微环境发生改变,卵母细胞的发育和成熟障碍,引起受精率下降。因此,子宫内膜异位症对女性生育有很大影响。
3.2氧化应激与子宫内膜异位症生育关系
虽然细胞已发展出广泛的抗氧化系统,如超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶等,以限制活性氧的产生,进而修复细胞损伤。然而,当ROS的产生和抗氧化防御之间的平衡被破坏时,氧化应激可能发生。巨噬细胞、红细胞和凋亡的子宫内膜组织通过逆行月经移植到腹膜腔是众所周知的氧化应激诱导物,故腹膜ROS的产生可能与内异症有关。ROS可以激活巨噬细胞,促进异位内膜细胞侵袭和生长,引起炎症反应。氧化应激时巨噬细胞还可以产生过量的脂质过氧化物,加重氧化应激过程产生更多的ROS,同时促使炎性因子水平升高,进而导致内异症患者的疼痛及不孕症状。此外,研究发现氧化应激与多种妇科疾病发生和发展有关,包括盆腔炎性疾病、多囊卵巢综合征、卵巢早衰、子宫内膜异位症和妇科肿瘤等[8-10]。ROS属于氧代谢产物之一,其表达水平升高将会加剧细胞损伤。TAC则能削弱生物酶活性,降低脂质含量,避免细胞受到毒害。当人体内ROS含量过高或TAC明显下降时,则会加剧氧化应激反应,造成糖化氧化、DNA损伤,严重者将会引起蛋白质过氧化反应,造成细胞凋亡。而MDA是膜脂过氧化较为重要的产物,其表达水平能加剧膜的损伤。本研究结果发现观察组血清和卵泡液中氧化应激标记物ROS、MDA浓度均显著高于对照组,而TAC浓度均显著低于对照组,提示子宫内膜异位症患者体内氧化应激显著高于对照组,而抗氧化应激能力显著低于对照组。此外,本研究还比较了两组患者IVF-ET相关指标,结果显示观察组成熟卵率、受精率均显著低于对照组,且Pearson相关性分析结果表明子宫内膜异位症患者血清ROS、MDA均与成熟卵率、受精率呈显著负相关,而血清TAC均与成熟卵率、受精率呈显著正相关,以上研究结果提示氧化应激标记物在子宫内膜异位症患者血清和卵泡液中浓度异常,且与IVF-ET中成熟卵率、受精率具有显著相关性,最终影响内异症患者的生育,且主要影响该类患者成熟卵率和受精率。Goud等于2014年研究报道氧化应激可诱发卵巢损伤,内异症患者的颗粒细胞比对照组表现出更多的DNA氧化损伤迹象,该病妇女的颗粒细胞凋亡小体和酪氨酸的发生率高于对照组,且此类患者的卵巢皮质也会受到氧化应激的损伤。和儒林等[11]研究报道子宫内膜异位症患者常伴有氧化应激反应升高,导致卵巢微环境发生改变,进而影响卵子的质量、胚胎的发育。韩彦洁等[12]研究报道内异症患者易发生氧化应激,且合并不孕者ROS异常引起的氧化应激紊乱可能与其IVF-ET妊娠结局不良有关,以上文献报道与本研究结果相似。
综上所述,氧化应激标记物在子宫内膜异位症患者血清和卵泡液中浓度异常,且与IVF-ET中成熟卵率、受精率具有显著相关性,值得临床关注。

