急性脑梗死患者血清GLP-1 ICAM-1水平与神经损伤程度的相关性分析
张 翔, 陈薪旭, 李夏婷, 辛 宇, 范天伦
(海南医学院第一附属医院神经内科一病区, 海南 海口 570102)
脑梗死又称缺血性卒中,是因脑部血流供应障碍、缺血缺氧导致的局限性脑组织坏死,一般发生在一个月以内的脑梗死都可称为急性脑梗死(acute cerebral infarction,ACI)。近年来,随着人口老龄化现象加重,ACI发病率明显上升,并具有较高的致残率和病死率,严重威胁患者身心健康。研究发现,血管内皮细胞受损可能与ACI发生机制有关[1]。血清胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)具有心脏和神经保护作用,可减少炎症和细胞凋亡[2,3]。既往研究发现[4],GLP-1预处理可降低链脲佐菌素诱导的脑缺血再灌注损伤的糖尿病大鼠血糖水平,改善神经评分,减小梗死体积,表明GLP-1对伴脑缺血/再灌注损伤的糖尿病大鼠具有神经保护作用。细胞间黏附因子-1(intercellular adhesion molecule-1,ICAM-1)作为一种炎性介质,参与血管内皮细胞的黏附功能,其在脑梗死中的作用近年来国内外已有报道[5],但GLP-1、ICAM-1同时在ACI患者血清中的表达关系以及与ACI患者神经损伤的关系研究尚未见报道。因此,现将研究结果报道如下。
1 资料与方法
1.1一般资料:选取2018年10月至2019年12月本院收治的ACI患者67例为研究对象,其中男38例,女29例,年龄52~64岁,平均(57.42±4.36)岁。纳入标准:①均符合中华医学会神经病学分会最新发布的《中国急性缺血性脑卒中诊治指南2018》[6]中相关诊断标准;②均为急性起病;③多为局灶神经功能缺损,如一侧面部或肢体无力、麻木,语言障碍等;④均经脑颅CT/MRI确诊。排除标准:①非血管性病因引起的ACI;②急性脑出血、脑微血管出血等;③近3个月有手术治疗史、抗凝药物服用史;④合并严重心肝肾功能障碍患者;⑤合并恶性肿瘤、血液系统疾病患者;⑥存在严重的意识障碍患者,或美国国立卫生研究院卒中量表(national institutes of health stroke scale,NIHSS)评分>25分。同期随机选取50名于本院体检的健康志愿者为对照组,均排除血管性、感染性、自身免疫疾病,其中男26例,女24例,年龄49~61岁,平均(56.27±5.13)岁。所有患者及家属均知情并自愿签署知情同意书,本研究获得本院伦理委员会批准同意。
1.2方 法
1.2.1一般资料:收集所有入组对象一般情况信息,包括年龄、性别、体质指数(BMI)、既往史如高血压史、糖尿病史、高血脂症史、冠心病史、吸烟史、饮酒史等,见表1。所有患者在入院后均接受改善脑循环、降压降脂降糖、纠正水电解质紊乱等常规治疗;根据患者具体情况给予溶栓、抗血小板凝集治疗等。
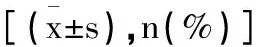
表1 研究组和对照组一般资料比较

组别例数高血脂症史冠心病史吸烟史饮酒史研究组6719(28.36)24(35.82)25(37.31)22(32.84)对照组50--14(28.00)12(24.00)t/χ2--1.1181.084P--0.290.298
1.2.2血样采集及检测:所有ACI患者在入院时及治疗后次日清晨抽取肘静脉外周血5mL,对照组志愿者于体检当天清晨抽取空腹肘静脉外周血5mL,3000r/min离心10min后,将上清液转移至干净EP管,-20℃保存待测。利用酶联免疫吸附法检测血清GLP-1、ICAM-1水平以及S100钙结合蛋白B(S100B)、神经元特异性烯醇化酶(NSE)。人GLP-1试剂盒(ARB11481)购自北京百奥莱博科技有限公司,人ICAM-1试剂盒(GD-S0034-B)、人NSE试剂盒(GD-S0162-B)均购自上海古朵生物科技有限公司,人S100B试剂盒(CK-E11686)购自武汉益普生物科技有限公司,检测方法均按照试剂盒说明书步骤进行。
1.2.3神经损伤程度评价:采用NIHSS评分量表对ACI患者入院治疗前及治疗后神经功能损伤情况进行评分,分别从意识水平、凝视、视野、面瘫、上肢运动、下肢运动、肢体共济失调、感觉、语言、构音障碍、忽视等11个方面进行评分,以患者真实表现打分,分值越高提示神经功能损害越严重。其中NIHSS评分<5分为轻度组(23例),5≤NIHSS评分<20分为中度(28例),NIHSS评分≥20分为重度(16例)。
1.3观察指标:比较研究组和对照组一般资料信息,分析ACI患者入院治疗前与治疗后血清指标水平及NIHSS水平差异,分析血清GLP-1、ICAM-1水平与S100B、NSE水平及NIHSS水平的相关性。

2 结 果
2.1研究组和对照组血清GLP-1、ICAM-1、S100B、NSE水平比较:研究组血清GLP-1水平明显低于对照组(P<0.05),ICAM-1、S100B、NSE水平明显高于对照组(P<0.05),见表2。

表2 研究组和对照组血清GLP-1 ICAM-1 S100B NSE水平比较
2.2不同神经损伤严重程度ACI患者血清GLP-1、ICAM-1、S100B、NSE水平比较:与轻度组相比,中度组、重度组ACI患者血清GLP-1水平明显降低(P<0.05),ICAM-1、S100B、NSE水平明显升高(P<0.05);与中度组相比,重度组ACI患者血清GLP-1水平明显降低(P<0.05),ICAM-1、S100B、NSE水平明显升高(P<0.05),见表3。

表3 不同神经损伤严重程度ACI患者血清GLP-1 ICAM-1 S100B NSE水平比较
2.3研究组患者治疗前后血清指标水平和NIHSS评分变化:与治疗前相比,治疗后ACI患者血清GLP-1水平明显升高(P<0.05),ICAM-1、S100B、NSE水平、NIHSS评分明显下降(P<0.05),见表4。

表4 研究组患者治疗前后血清指标水平和NIHSS水平变化
2.4ACI患者血清GLP-1、ICAM-1水平与S100B、NSE水平及NIHSS评分的相关性:Pearson结果显示,ACI患者血清GLP-1水平与ICAM-1、S100B、NSE水平、NIHSS评分均呈负相关(均P<0.05),ICAM-1水平与S100B、NSE水平、NIHSS评分均呈正相关(均P<0.05),见表5。

表5 ACI患者血清GLP-1 ICAM-1水平与S100B NSE及NIHSS的相关性
3 讨 论
本研究结果显示,ACI患者血清GLP-1水平较对照组明显降低,且与ACI患者神经损伤程度有关。GLP-1是一种肽激素,由胰高血糖素原基因的前激素转化酶(PC1/3)翻译后经组织特异性加工而来。大脑内的GLP-1主要由独束核中的神经元细胞分泌,由脑内的二肽基肽酶Ⅳ(DPP Ⅳ)降解。研究发现[7],GLP-1可靶向大脑中的胰岛素信号,通过提高胰岛素敏感性来降低淀粉样蛋白β(Aβ)水平,使大脑免受氧化损伤作用;并可通过血脑屏障,影响各种细胞通路,如神经炎症、线粒体功能和中枢神经系统中的细胞增殖等[8]。Cai等[9]揭示了补充GLP-1受体激动剂lixisenatide可减少12月龄APP/PS1/tau雌性小鼠海马内淀粉样斑块、神经纤维缠结和神经炎症,通过激活PKA-CREB信号通路和抑制p38-MAPK通路发挥神经保护功能。表明GLP-1可能作为治疗神经损伤的潜在靶点。本研究发现,ACI患者血清GLP-1水平在治疗后明显升高,与Shan等[10]研究结果一致,推测GLP-1水平升高可能通过改善血脑屏障破裂,降低星形胶质细胞来源的细胞因子水平等发挥保护神经功能,降低神经损伤程度。
ICAM-1是表达于细胞表面的免疫球蛋白,可作为一种血管内皮损伤标志物,当脑内血管损伤时,ICAM-1通过调节白细胞与血管内皮细胞的相互作用来促进白细胞向脑损伤区浸润,加重炎症反应[11,12]。本研究结果显示,ACI患者血清ICAM-1水平明显升高,且随患者神经损害加重而上升,表明血清ICAM-1可反映ACI患者神经损害严重程度,降低其水平可能为治疗ACI提供潜在辅助价值。陈龙剑等[13]研究证实,脑梗死伴随脑微出血患者血清ICAM-1水平明显升高,其通过介导外周血炎性细胞与血管壁接触并在血管内皮细胞上黏附、稳定,从而激活局部炎症反应,致使血脑屏障受损崩解,揭示了ICAM-1可能的潜在作用机制。本研究还发现,S100B、NSE水平与ACI患者神经损伤严重程度有关,且血清GLP-1、ICAM-1与S100B、NSE水平之间均有关,提示血清GLP-1、ICAM-1可能是反映ACI患者神经损伤严重程度的潜在生物指标。分析其原因,S100B作为一种重要的细胞溶质钙结合蛋白,既往研究证实S100B在脑卒中发病后水平快速升高,且与患者梗死体积、病情严重程度及预后有关,可能是进展性脑缺血的标志物[14]。另有研究认为[15]NSE水平与急性脑卒中患者梗死体积有关,但不影响神经功能缺损程度及患者预后,与本研究结果有异,推测可能与种族、病例差异有关。
综上所述,ACI患者血清GLP-1水平降低,ICAM-1水平升高,且与患者神经损伤程度有关,二者之间及与S100B、NSE之间密切相关,可能作为指示ACI患者神经损伤严重程度的潜在生物指标,为临床治疗ACI、减轻患者神经缺损提供潜在方向。

