内因子抗体和(或)抗胃壁细胞抗体阳性的脊髓亚急性联合变性13例临床分析
张成杰,陈彬,韩燕飞,孙金梅
脊髓亚急性联合变性(subacutecombined degeneration of spinal cord,SCD)是由于维生素B12(Vitamin B12,VitB12)缺乏导致的神经系统变性疾病。VitB12的摄入、吸收、结合、转运或代谢中的任何一个环节出现异常均可导致VitB12的缺乏,从而可引起SCD。SCD病变可累及脊髓后索、侧索、周围神经,少数患者可累及视神经或脑白质[1]。引起VitB12缺乏常见的原因包括因长期素食导致的摄入不足;由胃切除、回肠切除、酗酒伴萎缩性胃炎、慢性胃炎病史等引起的吸收障碍;此外,内因子抗体和抗胃壁细胞抗体影响VitB12与内因子的结合及其在回肠的吸收,也是一个重要原因[2]。内因子抗体和抗胃壁细胞抗体与自身免疫性胃炎相关[3],对于抗体阳性的SCD患者进行胃镜检查有助于评估胃部病变情况。目前对SCD的病因报道中[2],内因子抗体和(或)抗胃壁细胞抗体阳性的SCD患者的临床特征及胃部病变情况报道较少[4,5]。因此,本研究通过分析该类患者的临床资料,以期提高临床医生对该病的认识。
1 资料与方法
1.1 一般资料
选取2013年1月至2021年2月在我科住院治疗的SCD且合并内因子抗体和(或)抗胃壁细胞抗体阳性的患者13例。SCD的临床诊断标准为:隐匿起病,出现脊髓后索、侧索、周围神经受损的症状和体征,血清VitB12缺乏或应用VitB12后受损的临床症状与体征改善[6]。排除标准:非恶性贫血型联合系统变性、多发性硬化、脊髓压迫症、周围神经病等。
1.2 方法
收集13例患者的临床资料,进行回顾性分析,同时结合文献进行总结。
1.3 统计学处理
采用SPSS 19.0软件,对数据进行描述性统计。
2 结果
2.1 基线资料
13例患者中,男11例,女2例;平均年龄59.7岁。仅完成内因子抗体检测6例,结果均为阳性;同时检测内因子抗体和抗胃壁细胞抗体7例,其中仅抗胃壁细胞抗体阳性4例,均为阳性3例。5例同时合并导致VitB12缺乏的其他原因:胃大部切除和长期酗酒1例,长期酗酒3例,胃大部切除1例。
2.2 临床表现
病程10余天~5年,其中亚急性病程为7例,慢性病程为6例。首发症状:以肢体麻木无力起病5例,以肢体麻木起病4例,以肢体无力起病2例,以肢体麻木及走路不稳起病1例,以走路不稳起病1例。主要症状和体征:同时累及脊髓后索、侧索和周围神经10例,累及后索和周围神经2例,累及侧索和周围神经1例;均无认知功能减退及视力下降等表现。
2.3 实验室检查
入院后所有患者均行血常规检查,其中存在巨幼细胞性贫血5例,正细胞贫血1例,其余未见异常。所有患者均行VitB12水平的检测,下降6例。完成叶酸水平检测12例,升高3例。完成血同型半胱氨酸(homocysteine,Hcy)水平检测10例,升高3例。另有1例患者入院时查VitB12、叶酸、血Hcy正常,但在入院前10个月外院查VitB12水平下降,叶酸升高,血Hcy升高,并给予补充甲钴胺治疗。另1例患者在入院前已给予营养神经治疗,具体不详,入院后查VitB12及叶酸水平正常。
2.4 神经电生理检查
12例患者行神经传导速度检查,提示周围神经损伤9例,同时检测到感觉及运动神经受损3例,仅检测到感觉神经传导受损2例,仅检测到运动神经传导受损4例。8例患者行体感诱发电位检查,均存在异常。
2.5 影像学检查
12例患者行颈椎核磁检查,11例患者行胸椎核磁检查。颈髓及胸髓均存在异常信号3例,仅颈髓存在异常信号1例,均表现为T2WI高信号,见图1。12例患者行头颅核磁检查,其中提示脑白质脱髓鞘8例。
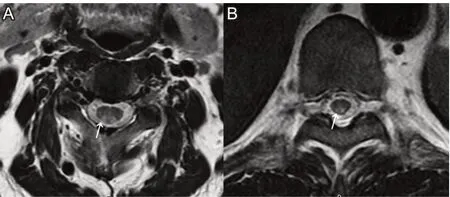
图1 本组1例男性SCD患者影像学资料
2.6 胃镜检查
5例患者行胃镜检查,其中3例患者行活检。未活检的2例患者,胃镜下可见胃底、胃体黏膜光滑,1例胃窦部见散在点状红斑,诊断慢性浅表性胃炎;另1例胃窦部见散在点片状糜烂,诊断慢性浅表性胃炎伴糜烂。3例行活检的患者中,第1例胃镜下可见胃底体黏膜光滑,胃角窦黏膜可见少许颗粒不平,灰白色,可透见黏膜下血管,诊断萎缩性胃炎。胃角活检提示中-重度慢性萎缩性炎,伴肠上皮化生。第2例胃镜下见胃底可见约0.4 cm的扁平息肉;胃体黏膜光滑,胃窦、胃体部见散在点状红斑;诊断慢性浅表性胃炎,胃底息肉(山田I型)。胃底活检提示胃黏膜组织呈慢性炎,固有层及黏膜肌层见巢状排列之细胞,待除外神经内分泌肿瘤。第3例胃镜下见胃底、胃体黏膜光滑,于胃角窦黏膜可见少许颗粒不平,诊断慢性萎缩性胃炎(C-2)。胃窦活检提示胃幽门腺黏膜组织呈中度慢性萎缩性炎,伴中度肠上皮化生。胃底及胃体活检提示胃黏膜组织呈中度慢性萎缩性炎。进一步完善幽门螺杆菌抗体检测为阴性。胃蛋白酶原I 11.4 ng/mL,胃蛋白酶原II 10.7 ng/mL,胃蛋白酶原I/II 1.1。
2.7 治疗和预后
所有患者均给予腺苷钴胺0.5~1.5 mg/d或甲钴胺500μg肌肉注射,3次/周;根据叶酸及Hcy水平,给予补充叶酸、VitB6等。住院治疗2~3周后,12例患者症状有改善,1例患者无明显变化。出院后继续肌注治疗。病程较长的患者会遗留不同程度的后遗症。
3 讨论
VitB12是核蛋白合成和髓鞘合成所必须的辅酶,其缺乏可导致血液系统病变和神经系统病变。摄入的VitB12需与胃底和胃体部壁细胞分泌的内因子结合才能与回肠上的特异性受体结合而吸收入血,并经运钴胺蛋白结合转运至细胞内,发挥生物学效应[7]。内因子抗体是针对内因子表面与VitB12结合位点和回肠内因子受体结合位点的自身抗体[8]。而抗胃壁细胞抗体是针对胃壁细胞表面的H+/K+-ATP酶的自身抗体,可导致胃壁细胞受损,使内因子分泌减少[9]。因此,内因子抗体和(或)抗胃壁细胞抗体的存在是导致VitB12缺乏的一个重要原因。
SCD多见于中老年患者,以累及脊髓后索、侧索、周围神经受累的症状和体征为主,表现为肢体感觉异常、痉挛性运动障碍、步态不稳等,少数患者可出现大小便障碍、认知功能减退和精神异常等[1,10]。本研究13例患者中,男性患者11例。既往报道中SCD也多以男性发病为主[2,11],也有报道中无统计学差异[1]。5例患者同时合并导致VitB12缺乏的其他原因,包括胃大部切除或酗酒。因此,SCD的患者无论是否已存在其他原因,都应完善内因子抗体和抗胃壁细胞抗体检测。11例患者同时累及脊髓后索、侧索及周围神经。张瑞云等[4]报道的8例内因子抗体和(或)抗胃壁细胞抗体阳性的SCD的患者中仅3例出现了典型的脊髓后索、侧索和周围神经均受累的体征。本研究与之存在差异,可能原因为病例数量较少。
VitB12水平的降低,为SCD的诊断提供重要依据,但其水平正常也无法排除该诊断。本研究中仅7例患者在既往或入院时存在VitB12水平降低,原因可能是既往存在补充或者基因多态性[12]。此外,VitB12也参与Hcy的代谢,其缺乏时可出现血Hcy的升高,同时,叶酸缺乏也可导致血Hcy的升高[13]。叶酸正常,但血Hcy升高也反映体内VitB12的缺乏。10例检测了血Hcy水平的患者中,1例VitB12及叶酸水平正常,但存在血Hcy水平升高,由此可推测真正发挥作用的是VitB12水平缺乏。VitB12缺乏影响红细胞DNA的合成,引起巨幼细胞性贫血。本研究中5例患者存在巨幼细胞性贫血,且该5例患者VitB12的水平均降低。
电生理检查异常为SCD的诊断提供依据,但缺乏特异性[14]。本研究中12例患者行神经传导检查,其中9例存在周围神经损伤,而8例诱发电位检查均提示异常。核磁检查可显示病灶情况,但阳性率较低,研究报道阳性率大约14.8%~56.1%[11,15],且病程≤6个月者更易发现病灶。本研究中,12例患者行核磁检查,仅有4例患者在脊髓上发现病变,阳性率为33.3%,表现为在T2WI为高信号,其中2例患者病程≤6个月。
对于抗体阳性的SCD患者应警惕是否存在自身免疫性胃炎。目前对于自身免疫性胃炎的诊断主要依据黏膜受累部位,即胃底、胃体受累而胃窦未受累,以及检测抗胃壁细胞抗体和内因子抗体来判断,其他还包括胃蛋白酶原Ⅰ分泌下降,胃蛋白酶原Ⅱ分泌正常,胃蛋白酶原Ⅰ/Ⅱ比值下降等[3]。自身免疫性胃炎持续进展可并发胃神经内分泌肿瘤,同时可合并其他自身免疫性疾病[3]。本研究中5例完善了胃镜检查,其中3例行活检,胃角活检提示萎缩性胃炎1例,胃底活检提示存在慢性炎症1例,但无胃窦活检及其他实验室检查。1例胃底、胃体及胃窦活检均可见萎缩性炎症,胃蛋白酶原I/II比值下降,而自身免疫性胃炎萎缩仅局限在胃体部,但对于合并其他自身免疫性疾病者可出现全胃萎缩[16],该患者仍考虑存在自身免疫性胃炎。对于考虑存在自身免疫性胃炎的患者,需要消化科随诊警惕肿瘤的发生。
治疗方面,合并内因子抗体和(或)抗胃壁细胞抗体阳性的SCD患者,因自身抗体影响VitB12在胃的结合及在回肠的吸收,经口给予VitB12补充无效。尽早且长期肌肉注射VitB12有助于患者预后。
综上所述,内因子抗体和(或)抗胃壁细胞抗体阳性的SCD患者可同时伴有引起VitB12缺乏的其他原因。考虑SCD的患者,要寻找导致VitB12缺乏的原因。患者的临床症状和体征以脊髓后索、侧索和周围神经同时受累为主。脊髓核磁检查可显示病灶情况,但阳性率不高;需行胃镜检查评估胃部病变情况,必要时完善活检及其他实验室检查。尽早肌肉注射补充VitB12有助于改善预后。
