模拟子宫微环境诱导大鼠胎盘间充质干细胞向子宫内膜上皮细胞方向分化的实验研究*
李爱丽,赵飞,张彤艳,马志玲,肖雅琳
(邯郸市中心医院1.东区妇四科,2.西区普外二科 河北 邯郸056001)
子宫内膜不仅具有高度的增殖活性,还具有周期性更新的特性,并受卵巢激素变化的调节[1]。子宫内膜的来源与循环的骨髓干细胞有关,也可能与内膜中残留的胚胎干细胞有关[2]。胎盘间充质干细胞(placental mesenchymal stem cells,PMSCs)属于一类多能干细胞,是从胎盘组织中分离培养出来的。PMSCs 具有易贴壁生长的特性,其生物学特性与骨髓间充质干细胞相似,具备高自我更新和多向分化的能力[3-4]。对哺乳类动物和人类来说子宫内膜是维持正常生殖能力的必要条件[5]。有研究表明[6],子宫内膜损伤可导致不孕,损伤的子宫内膜会出现大量的瘢痕化,导致子宫供血不足,影响胚胎着床。由于机体子宫功能和内环境的有序性和复杂性,因此目前无良好的治疗方法,随着干细胞技术的发展,临床开始使用干细胞诱导分化修复子宫内膜[7-8]。本研究模拟子宫微环境诱导大鼠PMSCs 向子宫内膜上皮细胞方向分化,以期为临床运用干细胞分化修复子宫内膜提供依据。
1 材料与方法
1.1 材料
实验动物:选择2月龄的SD 大鼠,体重150~180 g,由南京君科生物工程有限公司提供。实验试剂:DMEM 培养基(美国HyClone 公司),兔抗大鼠波形蛋白抗体、小鼠抗大鼠角蛋白抗体(美国Gibco 公司),兔抗大鼠细胞角蛋白7(CK-7)、细胞角蛋白18(CK-18)、细胞角蛋白19(CK-19)、上皮膜抗原(EMA)抗体(上海钰博生物科技有限公司),DMEM/F12 培养液(杭州吉诺生物医药技术有限公司)。
1.2 方法
1.2.1 大鼠PMSCs 原代培养及传代将雌、雄大鼠按1∶3 合笼,于第2 天上午8:00 查看是否有阴栓形成,如有则确定为受孕,记为ES。进入无菌室,将孕13.5 d 的SD 大鼠处死,75%酒精消毒20 min 后,放入超净工作台内,打开腹腔及子宫,可见有成串胎鼠,剪开羊膜后从脐带胎盘端离断,收集所有胎盘,用无菌盐水冲洗,小心去除残余脐带和羊膜组织,将剩余的胎盘组织用无菌组织剪剪成1 mm×1 mm×1 mm 的小块。将组织放入50 ml 的离心管中,加入混合酶(胰蛋白酶∶I 型胶原酶=1∶1),放入37℃水浴箱内消化50 min,消化过程中每隔20 min 摇动1 次,最终用含10%胎牛血清的DMEM 终止消化,随即用200 μm的不锈钢筛滤掉未消化的组织,过滤后的细胞液以1 000 r/min 离心10 min,收集细胞沉淀。在一次性的15 ml 离心管内加入5 ml 由1.131 g/ml 的percoll 液和PBS 混合制成1.073 g/ml 的细胞分离液,用培养基将细胞沉淀混匀后缓慢加入细胞分离液中,然后900 r/min 离心25 min,离心后用移液管小心地吸取白膜层,PBS 洗涤收集的细胞,离心后去除PBS,最终用含10% FBS 的DMEM 培养液吹洗管内细胞制成悬液,将细胞以1×l06/ml 接种至标记好的25 cm×25 cm 培养瓶中,置于培养箱内,其温度设置为37℃,CO2浓度为5%。3 d后首次换液,倒置相差显微镜下观察细胞形态和细胞增殖状况。根据细胞生长情况每2~3 天换液1 次,待细胞铺满瓶底约80%以上时,消化细胞,以l∶2 比例进行传代。
1.2.2 绘制细胞生长曲线取生长良好的第3 代PMSCs 制备单细胞悬液,调整细胞浓度为2×104个/ml 接种到24 孔板,每孔接种0.5 ml,放入37℃、5% CO2培养箱内培养,每天随机选取3 个培养孔,胰酶消化后计算每孔细胞数,取3 孔内细胞数均值,待细胞长满时停止计数。以时间为横坐标,细胞数为纵坐标,绘制细胞生长曲线,连续观察14 d,未计数细胞每3 天换液1 次。
1.2.3 子宫内膜诱导培养液的制备将1%戊巴比妥钠40 mg/kg 麻醉后的雌性SD 大鼠,置于超净工作台上消毒,准备各种器械、试剂、耗材,打开腹腔取出双侧子宫,用PBS 冲洗3 次以去掉组织表面血污,放入加有双抗、PBS 的60 mm 培养皿中清洗,小心去除最外层的浆膜层,纵行剖开后再横向剪成0.3~0.5 cm 的小段,称取湿重,按100 g/L 加入DMEM 培养基,4℃摇床震荡2 h,4℃冰箱过夜,4℃、3 000 r/min离心30 min,离心后吸取上清液,用一次性无菌过滤器过滤至新的离心管内,密封,置入-20℃冰箱冷冻保存。
1.2.4 大鼠PMSCs 体外诱导分化子宫内膜细胞取出装有大鼠第3 代PMSCs 的培养瓶,去除原有培养基,向瓶内加入少许消化酶,以能覆满瓶底为限,室温下消化1~2 min 后轻轻摇晃,当显微镜下发现细胞回缩、间隙增大、细胞变类圆形时,立即终止消化,吸除培养瓶内的混合液。加入培养基,用移液管轻轻吹打瓶壁细胞制成细胞悬液,以1×106个/ml 接种于60 mm 培养皿,待细胞达80%以上融合时,吸除原有培养基,加入无菌子宫内膜诱导培养液,放入培养箱内继续培养,每3 天换1 次液,连续14 d,对照组DMEM 培养基培养。每天倒置显微镜下观察细胞生长情况,当细胞基本长满培养皿底时,吸除旧的培养液,加入消化酶少许,以能覆满瓶底为限,倒置显微镜下观察扁平梭形细胞脱落情况。当观察到大多数扁平梭形的细胞变圆并开始脱落时,立即加入2 ml 含10%胎牛血清的培养基终止消化。用移液管缓慢轻轻地吹打细胞后弃去培养皿内液体;再用少许培养基冲洗2 次,加入培养基后继续培养3 d,再次观察细胞情况。若镜下仍见扁平梭形细胞,可再重复1 次上述胰酶消化法,将扁平梭形细胞去除。
1.2.5 免疫荧光化学法检测细胞中波形蛋白和角蛋白的表达将第3 代PMSCs 以5×104个/ml 接种于24 孔培养板中,培养液为含5%FBS 的DMEM/F12,分为实验组和对照组,实验组使用含有20%的子宫内膜诱导培养液,对照组使用含有5%的FBS 的培养基进行培养。倒置显微镜下观察细胞的形态和增殖情况,培养5 d 后,弃去培养基,使用PBS清洗3 次,5 min/次,弃去PBS,将盖玻片取出,摆放于铺有蜡膜的150 mm×150 mm 的培养皿中,细胞面朝上并做标记。用4%的多聚甲醛固定15 min,再用PBS 清洗2 次,3 min/次,加入5%的BSA 在室温下封闭处理30 min。将兔抗大鼠波形蛋白抗体、小鼠抗大鼠角蛋白抗体按1∶50 在封闭液中稀释,40 μl/盖玻片,在室温下孵育1 h。将一抗吸除,使用PBS 清洗3 次,5 min/次,加入5%的BSA 在室温下封闭处理30 min,吸除封闭液,用PBS 清洗3 次,5 min/次。分别加入1∶500 稀释的FITC 标记的抗兔IgG、抗小鼠IgG,40 μl/盖玻片,在室温下孵育1 h。吸除二抗,用PBS 清洗3 次,每次10 min。滴加0.5 μg/ml 的DAPI 进行染核处理,40 μl/盖玻片,在室温下孵育2 min,用PBS 清洗3 次,5 min/次。用蒸馏水漂洗1 次,将盖玻片夹起,吸水纸吸干,将细胞面朝下,封边处理,做标记。在荧光显微镜下阅片,拍照。
1.2.6 实时荧光定量PCR(qRT-PCR)检查CK7、CK18、CK19、EMA mRNA 相对表达量将第3代PMSCs 以5×104个/ml 接种于6 孔培养板中,培养液为含5% FBS 的DMEM/F12,分为实验组和对照组,实验组使用含有20%的子宫内膜诱导培养液,1×10-7β-雌二醇,对照组使用含有5%的FBS 的培养基。培养5 d 后,用PBS 清洗PMSCs6 孔培养板,加入Trizol 0.6 ml/孔,轻轻吹打,收集细胞,置于1.5 ml的离心管中,室温下静置5 min,再加入120 μl 的氯仿(约为RNAiso 的1/5 体积量),剧烈震荡30 s,室温下静置5 min,4℃下12 000 r/min,离心15 min,取其上清液,移入400 μl 的异丙醇,震荡处理,摇匀,室温下静置5 min,4℃下12 000 r/min,离心10 min,弃除上清液,将75% 1 ml 的乙醇加入至离心管中清洗沉淀,4℃下12 000 r/min,离心5 min,弃除上清液,留取RNA 沉淀,重复上述步骤,彻底清洗RNA 沉淀,在室温环境下进行干燥沉淀处理,加入20 μl DEPC 水溶解RNA 沉淀,轻轻吹打,取20 μl 的RNA,加入198 μl 样品稀释液,测定OD值、浓度,进行逆转录反应,依次加入反应物2.5 μl稀释10 倍的PCR 缓冲液,1.5 μl MgCl2溶液,0.5 μl正向引物和反向引物,最后加水配成总体积为25 μl的反应体系。CK-7 正向引物:5'-GTTCCATTTGCA AAGGCTGT-3';反向引物:5'-CAGGTGGTTATCCC GAAAGA-3'。CK-18 正向引物:5'-GCTCTGCCAGG CGCCCAGCTACGG-3';反向引物:5'-CAGGCGGTC GTTCAGGCTTTGCATG-3'。CK-19 正向引物:5'-TCGCCAAGATCCTGAGTGA-3'; 反向引物:5'-TCCGTTTCTGCCAGTGTGT-3'。EMA 正向引物:5'-GTACCTCCTCTCACCTCCTCCAA-3';反向引物:5'-CGTCGTGGACATTGATGGTACC-3'。GAPDH 正向引物:5'-AGCGGGAAATCGTGCGTG-3';反向引物:5'-CAGGGTACAGGTGGTGCC-3'。PCR 反应条件为:94℃预变性1 min;55℃变性1 min;72℃退火1 min,进行35 个循环,72℃延伸5 min,重复最少3 次,GAPDH 作为内参照,采用2-△△Ct法计算CK-7、CK-18、CK-19、EMA mRNA 相对表达量。
1.2.7 Western blotting 检测波形蛋白和角蛋白相对表达量将第3 代PMSCs 以5×104个/ml 接种于24 孔培养板中,培养液为含5%FBS 的DMEM/F12,分为实验组和对照组,实验组使用含有20%的子宫内膜诱导培养液,1×10-7β-雌二醇,对照组使用含有5%的FBS 的培养基。培养5 d 后,每1×106个细胞加入500 μl 的细胞裂解液,细胞裂解后提取总蛋白,BAC 法检测蛋白浓度,取等量的蛋白样本25 μg,进行5% 的SDS-PAGE,将蛋白转移至PVDF 膜,10%的脱脂奶粉封闭2 h,分别加入兔抗大鼠波形蛋白抗体、小鼠抗大鼠角蛋白抗体和β-actin 抗体,在4℃环境下孵育过夜,TBST 清洗3 次,加入ECL 荧光底物显色,在暗室使用高敏感的X 射线胶片进行曝光显影。检测波形蛋白、角蛋白条带和β-actin 蛋白条带的灰度值,目的蛋白相对表达量=目的蛋白条带灰度值/内参条带灰度值。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料采用均数±标准差(±s)表示,比较用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠PMSCs 的形态特点
原代细胞刚接种至培养瓶时可见大量悬浮圆形细胞(见图1A),接种7 d 后倒置显微镜下看到细胞贴着培养瓶的壁生长,圆形细胞开始延伸,变成梭形或不规则形,轮廓清晰,仍有部分细胞呈圆形(见图1B),培养14 d 后细胞几乎铺满瓶,细胞的形态为漩涡状排列的均一长梭形细胞,可传代(见图1C);一般传代后细胞7~8 d 即可扩增至再次传代。
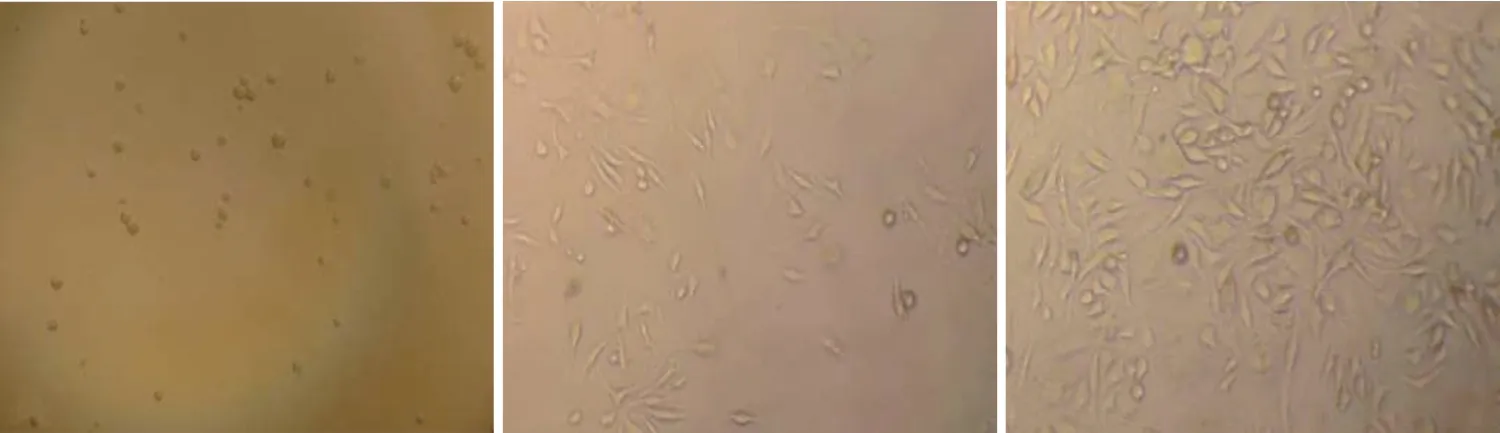
图1 大鼠PMSCs的形态特点
2.2 细胞生长曲线
细胞随着培养时间的延长,数量逐渐增加。见图2。
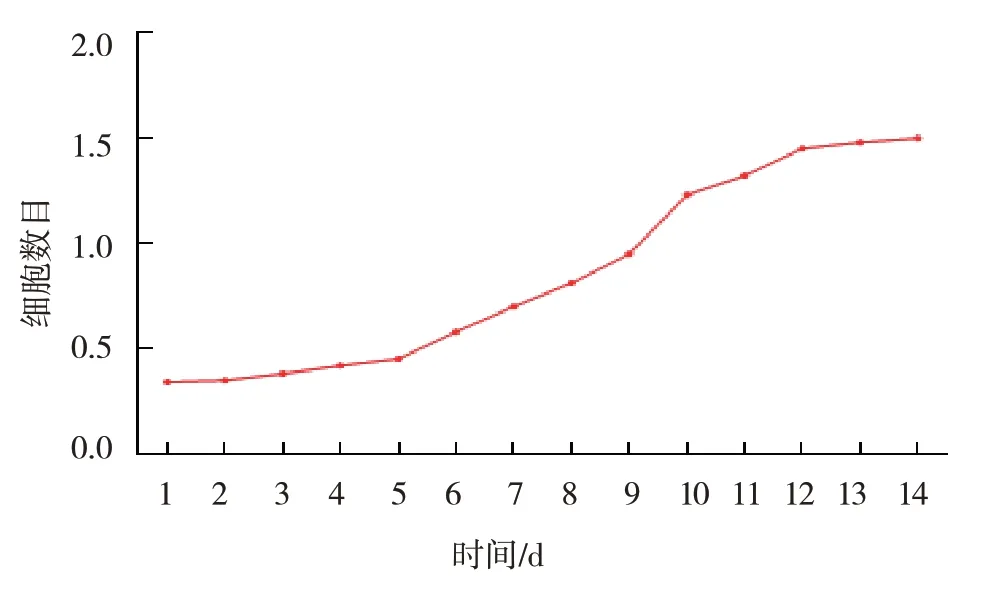
图2 细胞生长曲线图
2.3 大鼠PMSCs 向子宫内膜细胞诱导分化特征及角蛋白、波形蛋白表达情况
诱导14 d 后,显维镜下观察部分细胞呈基质细胞改变,较扁平,呈梭形,核不明显,排列无规律;部分其他细胞多角形,排列成团,核比较圆而大,呈现出上皮样细胞的改变。用胰酶消化法获得较高纯度的上皮样细胞。HE 染色可见上皮样细胞均呈多角形,胞浆呈淡红色,胞核呈淡蓝色(见图3)。细胞免疫荧光检测角蛋白结果显示,实验组大部分细胞出现绿色荧光,即为角蛋白表达呈阳性,对照组只有胞核为蓝色荧光。说明PMSCs 不表达角蛋白,诱导后的角蛋白为阳性,即呈现上皮样细胞改变(见图4A、4B)。细胞免疫荧光检测波形蛋白结果显示,实验组细胞出现大量绿色荧光,对照组只有胞核为蓝色荧光。说明PMSCs 不表达波形蛋白,诱导后的波形蛋白为阳性,即呈现上皮样细胞改变(见图4C、4D)。
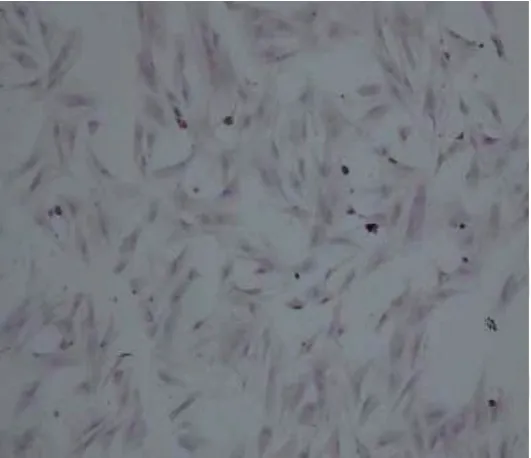
图3 上皮样细胞改变(HE染色×50)
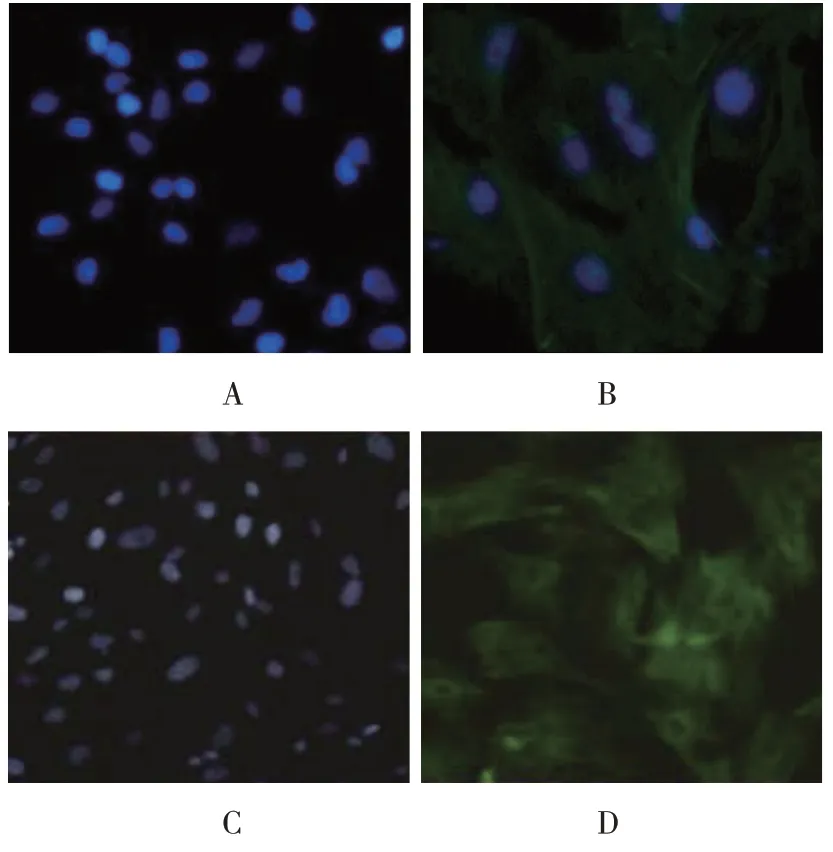
图4 角蛋白、波形蛋白表达情况(免疫荧光法×100)
2.4 两组CK-7、CK-18、CK-19、EMA mRNA 相对表达量比较
两组CK-7、CK-18、CK-19、EMA mRNA 相对表达量比较,差异有统计学意义(P<0.05)。实验组高于对照组。见表1。
表1 两组CK-7、CK-18、CK-19、EMA mRNA相对表达量比较(±s)
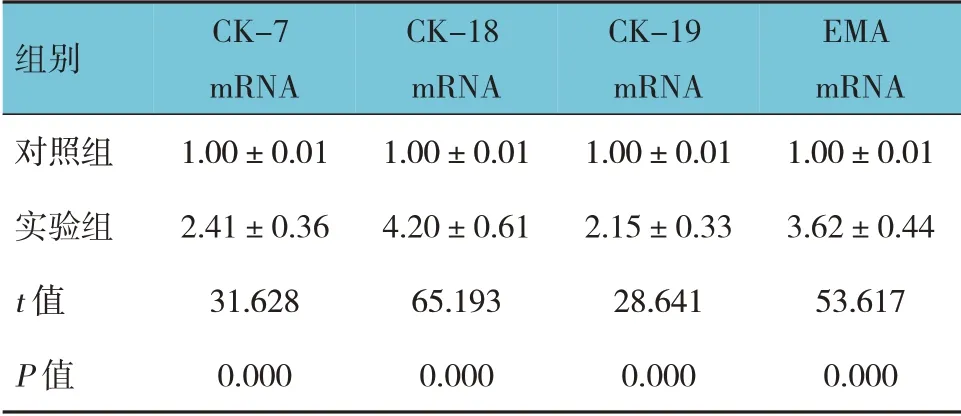
表1 两组CK-7、CK-18、CK-19、EMA mRNA相对表达量比较(±s)
组别对照组实验组t 值P 值CK-7 mRNA 1.00±0.01 2.41±0.36 31.628 0.000 CK-18 mRNA 1.00±0.01 4.20±0.61 65.193 0.000 CK-19 mRNA 1.00±0.01 2.15±0.33 28.641 0.000 EMA mRNA 1.00±0.01 3.62±0.44 53.617 0.000
2.5 两组波形蛋白和角蛋白的相对表达量比较
两组波形蛋白和角蛋白相对表达量比较,差异有统计学意义(P<0.05),实验组高于对照组。见图5和表2。

图5 波形蛋白和角蛋白的相对表达量比较
表2 两组波形蛋白和角蛋白相对表达量比较(±s)
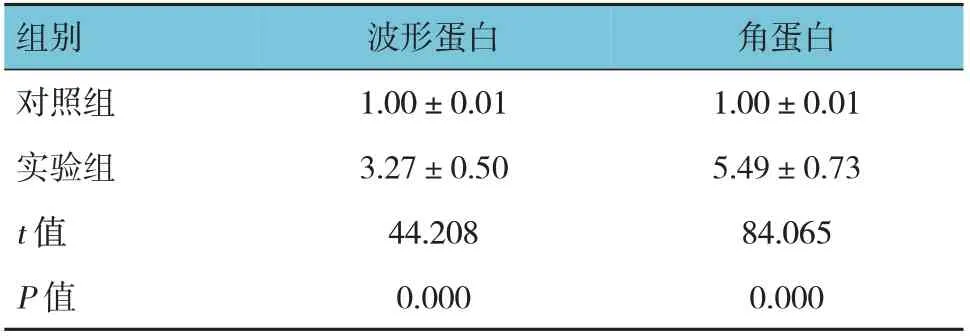
表2 两组波形蛋白和角蛋白相对表达量比较(±s)
组别对照组实验组t 值P 值波形蛋白1.00±0.01 3.27±0.50 44.208 0.000角蛋白1.00±0.01 5.49±0.73 84.065 0.000
3 讨论
间充质干细胞属于一类多能干细胞,能够在多类组织中提取,例数胎盘、骨髓及脂肪组织中,在一定条件下间充质干细胞会被诱导分化为子宫内膜上皮细胞[9]。间充质干细胞具有较高的免疫调节能力和较低的免疫原性,因此使用干细胞对不孕患者进行治疗得到了广泛的关注[10]。PMSCs 是从胎盘中提取出来的,其具备多向分化的潜能和自我更新增殖的能力,能够通过诱导分化为不同种类的细胞,如成骨细胞、子宫内膜上皮细胞等[11-13]。子宫维持着女性的生殖能力,其中子宫内膜分为基底层和功能层,基底层是由疏松结缔组织组成,而功能层更新、脱落和再生与月经周期有关[14]。子宫内膜受到损伤会导致闭经、不孕等疾病的发生,对女性的健康和生殖能力产生较大的影响[15]。PMSCs 和骨髓间充质干细胞相似,培养条件相同,且胎盘来源广泛,取材方便,因此本文模拟子宫微环境诱导大鼠PMSCs 向子宫内膜上皮细胞样方向进行分化。
本研究提取大鼠PMSCs,并制备子宫内膜诱导培养液,进行大鼠PMSCs 体外诱导分化子宫内膜细胞实验。有研究实验发现人和大鼠的子宫内膜的微环境中,PMSCs 可有效分化为子宫内膜上皮细胞[16]。另有研究表明[17],通过移植PMSCs 和雌激素对宫腔粘连患者的治疗效果显著,且治愈性较高,并在后续的治疗和体外受精胚胎移入中成功受孕。PMSCs 在子宫微环境中通过诱导可能会向子宫内膜上皮细胞分化,通过对PMSCs 的移植能够治疗子宫内膜干细胞缺失类疾病,能够作为子宫外干细胞的来源,将子宫内膜组织进行重建,起到治疗的作用[18-20]。本实验中,通过制备子宫内膜条件培养液,诱导PMSCs 向子宫内膜上皮细胞进行分化,结果显示实验组PMSCs 向子宫内膜上皮细胞分化成功。亦有实验[21]通过不同的培养方式诱导PMSCs 向子宫内膜上皮细胞分化,结果显示在含有20%的子宫内膜诱导培养液,1×10-7β-雌二醇培养液中的PMSCs 向子宫内膜上皮细胞分化成功,与本文结果一致。
细胞角蛋白是一种主要在上皮细胞的骨架上表达的蛋白,能够有效维持上皮细胞的形态完整性[22]。波形蛋白主要在非表皮细胞和间叶细胞中存在,也在骨骼肌和心肌Z 盘中的Ⅲ型中间纤丝内存在,作为一种纤丝蛋白,能够维持细胞器和细胞核之间的特定空间。波形蛋白和角蛋白常被应用于间充质干细胞和上皮细胞的表达[23-24]。本实验通过细胞免疫荧光法检测细胞中波形蛋白和角蛋白的表达,结果显示,实验组大部分细胞出现绿色荧光,即为角蛋白表达呈阳性,对照组只有胞核为蓝色荧光。说明PMSCs 不表达角蛋白,诱导后的细胞角蛋白阳性,即呈现上皮细胞改变。实验组细胞出现大量绿色荧光,对照组只有胞核为蓝色荧光。说明PMSCs 不表达波形蛋白,诱导后的细胞波形蛋白阳性,即呈现上皮细胞改变。此结果说明在诱导后PMSCs 成功向子宫内膜上皮细胞分化。有研究[25]提取PMSCs 并制备子宫内膜条件培养液,诱导PMSCs 向子宫内膜上皮细胞进行分化,使用免疫荧光法对波形蛋白和角蛋白进行检测,结果显示,诱导后波形蛋白和角蛋白均表达,说明其模拟子宫微环境将PMSCs 诱导至子宫内膜上皮细胞分化成功,与本文研究结果一致。另外本文还对两组CK-7、CK-18、CK-19、EMA mRNA 相对表达量进行检测,结果显示实验组CK-7、CK-18、CK-19、EMA mRNA 的相对表达量均高于对照组,说明实验组模拟子宫微环境诱导PMSCs 向子宫内膜上皮细胞分化成功。有研究[26-27]使用RT-PCR 对模拟子宫微环境诱导PMSCs 向子宫内膜上皮细胞分化和单纯PMSCs 向子宫内膜上皮细胞分化的CK-7、CK-18、CK-19、EMA 表达情况进行检测,结果显示,模拟微环境下的PMSCs 向子宫内膜上皮细胞分化成功,与本文研究结果一致。
综上所述,PMSCs 在一定的诱导条件下能够向子宫内膜上皮细胞方向分化,且在内源性间充质干细胞和外源性因素的作用下,诱导PMSCs 向子宫内膜上皮细胞方向分化作用更显著,为临床不孕患者使用PMSCs 治疗提供依据。

