脾多肽对非小细胞肺癌患者化疗后骨髓造血功能的影响*
陈露,段方方,王留晏,周寒丽,张玉洁,赵晓丽,孔天东
[河南大学肿瘤医院(郑州市第三人民医院)肿瘤内科,河南 郑州450000]
肺癌是我国乃至世界的高发肿瘤,在我国其发病率和病死率占第一位[1-2]。近年来,随着医学的快速发展,靶向药物和免疫治疗药物在肺癌的治疗中占据越来越重要的地位[3]。但是,化疗仍为肺癌的主要治疗手段之一,不可或缺。研究[4-5]表明,肺癌患者联合或先后应用化疗、靶向药物,才能有最佳的治疗效果和最长的生存时间。而中性粒细胞下降、血小板下降等不良反应是影响化疗方案按时正常进行的主要影响因素[6]。传统的处理手段是当粒细胞、血小板下降时再使用升血药物,往往导致化疗时间延误,影响化疗效果。脾多肽注射液具有双重抗肿瘤作用,既能提高机体免疫监视功能、促进T 细胞增殖分化、调节T 淋巴细胞比例、增强巨噬细胞及NK 细胞活性,还能提高对放化疗的耐受性、刺激骨髓造血、提升白细胞及血小板,从而有利于机体清除肿瘤[7]。脾多肽可能有提升白细胞的作用,但对血小板的影响及其最佳治疗剂量尚不清楚。本研究在肺癌化疗期间联合应用脾多肽,进一步观察其对患者白细胞、血小板等骨髓造血功能是否有保护作用,并探讨其最佳剂量。
1 资料与方法
1.1 一般资料
选取2017年6月—2019年3月在郑州市第三人民医院住院非小细胞肺癌患者,回顾性分析其病历资料。纳入标准:①经组织学或细胞学确诊;②年龄18~75 岁;③既往未接受过放化疗者;④化疗方案为铂二联方案:顺铂联合紫杉醇、多西他赛或吉西他滨,且≥2 个周期;⑤无广泛骨转移;⑥使用或者不使用脾多肽注射液,其中使用者,至少从化疗第1 天开始连用7 d 以上。排除标准:①合并心肺等重要脏器功能不全;②治疗期间合并感染;③病史资料不全;④生化、心电图、心脏彩超等病历资料缺失,化疗前或化疗后血常规结果缺失;⑤合并使用其他免疫扶正药物,例如小牛脾提取物注射液、参芪扶正注射液、参麦等。按照纳入和排除标准,共筛选出152 例患者。化疗期间未使用脾多肽注射液者为对照组,64 例;使用脾多肽注射液者为治疗组,88 例。两组患者年龄、性别、临床分期、ECOG 评分比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者临床资料情况
1.2 治疗方案
对照组给予常规化疗,具体方案为铂二联方案:紫杉醇(或多西他赛或吉西他滨)+顺铂(或卡铂),每3 周为1 个周期。药物具体用法用量:紫杉醇175 mg/m2,第1 天;多西他赛75 mg/m2,第1天;吉西他滨1 000 mg/m2,第1、8 天;顺铂70 mg/m2总量平均分为2~3 d;卡铂AUC4,第2 天。整个化疗期间不给与脾多肽、小牛脾、胸腺肽等免疫制剂。
治疗组在以上常规化疗方案基础上,于化疗周期第1 天开始同步给予0.9%氯化钠注射液+脾多肽注射液(吉林丰生制药,国药准字:H22026499)2~10 ml 静脉滴注,1 次/d,连用7~14 d。治疗组以脾多肽注射液的不同剂量分为2 ml 组(17 例)、4 ml 组(15 例)、6 ml 组(32 例)和10 ml 组(24 例)。
1.3 观察指标
①两组患者化疗后白细胞计数、中性粒细胞计数、血小板计数的最低值。②从化疗后白细胞<3.0×109/L 后开始使用重组人粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)(厦门特宝生物工程股份有限公司,100 μg/支)算起,到第1 次检验到白细胞>4×109/L 所使用的时间;若白细胞为Ⅱ、Ⅲ度下降,则G-CSF 初始用量为200 μg/d,若白细胞为Ⅳ度下降,则G-CSF初始用量为300 μg/d,当回升至Ⅲ度以上,则改为200 μg/d[8]。③两组患者用药期间的不良反应发生情况。
1.4 统计学方法
数据分析采用DPS 15.10 统计软件。计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用Tukey 检验;计数资料以例表示,比较采用χ2检验或Fisher 确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者化疗后血细胞计数最低值比较
两组化疗后中性粒细胞计数最低值比较,差异有统计学意义(P<0.05);两组化疗后白细胞计数、血小板计数最低值比较,差异无统计学意义(P>0.05)。见表2。
表2 两组患者化疗后血细胞计数最低值比较(×109/L,±s)
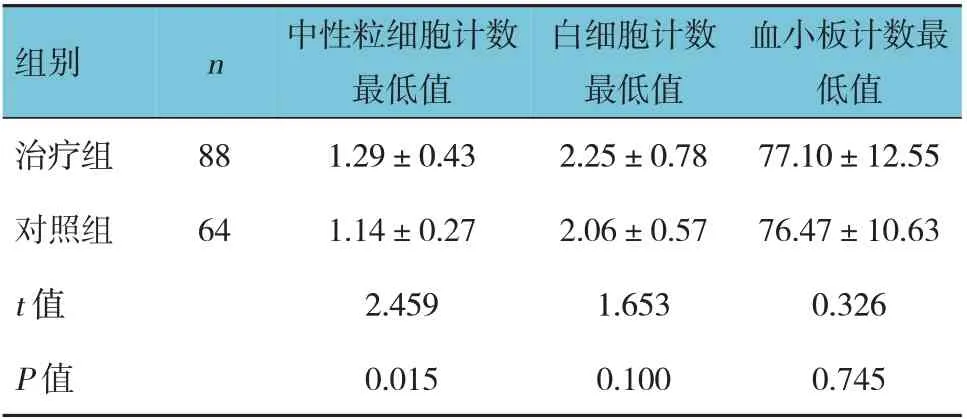
表2 两组患者化疗后血细胞计数最低值比较(×109/L,±s)
组别n治疗组对照组t 值P 值88 64中性粒细胞计数最低值1.29±0.43 1.14±0.27 2.459 0.015白细胞计数最低值2.25±0.78 2.06±0.57 1.653 0.100血小板计数最低值77.10±12.55 76.47±10.63 0.326 0.745
2.2 各组血细胞计数最低值的比较
脾多肽注射液2 ml 组、4 ml 组、6 ml 组、10 ml组和对照组中性粒细胞计数最低值、白细胞计数最低值比较,差异有统计学意义(P<0.05);进一步两两比较,10 ml 组高于其他剂量组及对照组。脾多肽注射液2 ml 组、4 ml 组、6 ml 组、10 ml 组和对照组血小板计数最低值比较,差异无统计学意义(P>0.05)。见表3。
表3 各组血细胞最低值比较(×109/L,±s)
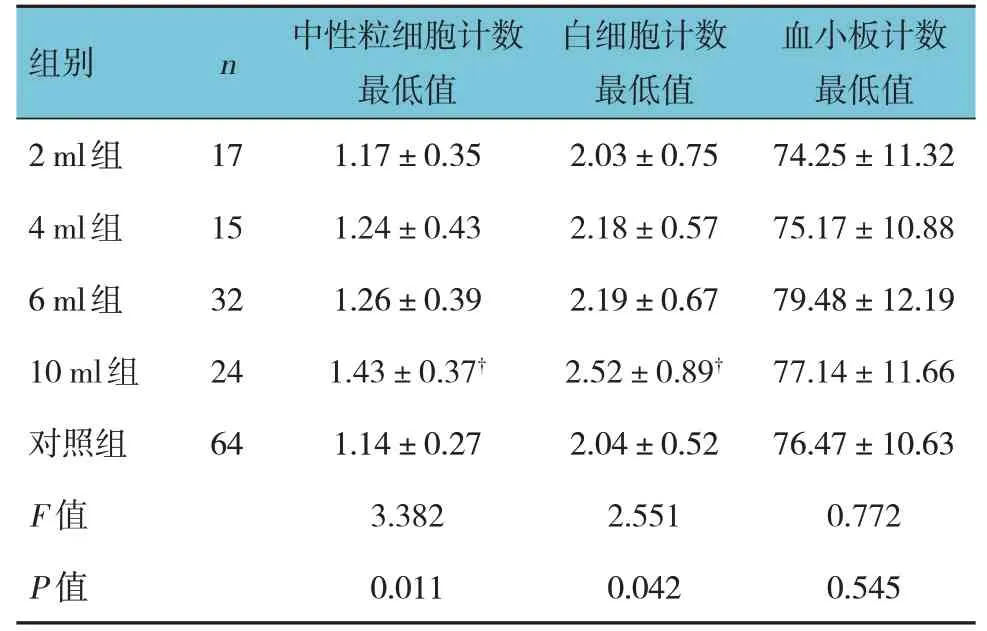
表3 各组血细胞最低值比较(×109/L,±s)
注:†与对照组比较,P<0.05。
组别n 血小板计数最低值中性粒细胞计数最低值白细胞计数最低值2 ml组4 ml组6 ml组10 ml组对照组F 值P 值74.25±11.32 75.17±10.88 79.48±12.19 77.14±11.66 76.47±10.63 0.772 0.545 17 15 32 24 64 1.17±0.35 1.24±0.43 1.26±0.39 1.43±0.37†1.14±0.27 3.382 0.011 2.03±0.75 2.18±0.57 2.19±0.67 2.52±0.89†2.04±0.52 2.551 0.042
2.3 各组患者使用G-CSF的时间比较
对照组、脾多肽注射液2 ml 组、4 ml 组、6 ml 组、10 ml 组使用G-CSF 时间比较,采用方差分析,差异有统计学意义(P<0.05);进一步两两比较,10 ml组G-CSF 的使用时间较对照组减少(P<0.05)。见表4。
表4 各组患者使用G-CSF的时间(d,±s)

表4 各组患者使用G-CSF的时间(d,±s)
注:†与对照组比较,P<0.05。
组别对照组2 ml组4 ml组6 ml组10 m组F 值P 值G-CSF使用时间3.25±0.82 3.23±0.77 3.22±0.85 3.07±0.73 2.54±0.90†3.593 0.008 n 64 17 15 32 24
2.4 各组患者不良反应比较
各组患者不良反应比较,差异无统计学意义(P>0.05)。各组患者的不良反应主要为恶心呕吐、神经毒性。见表5。
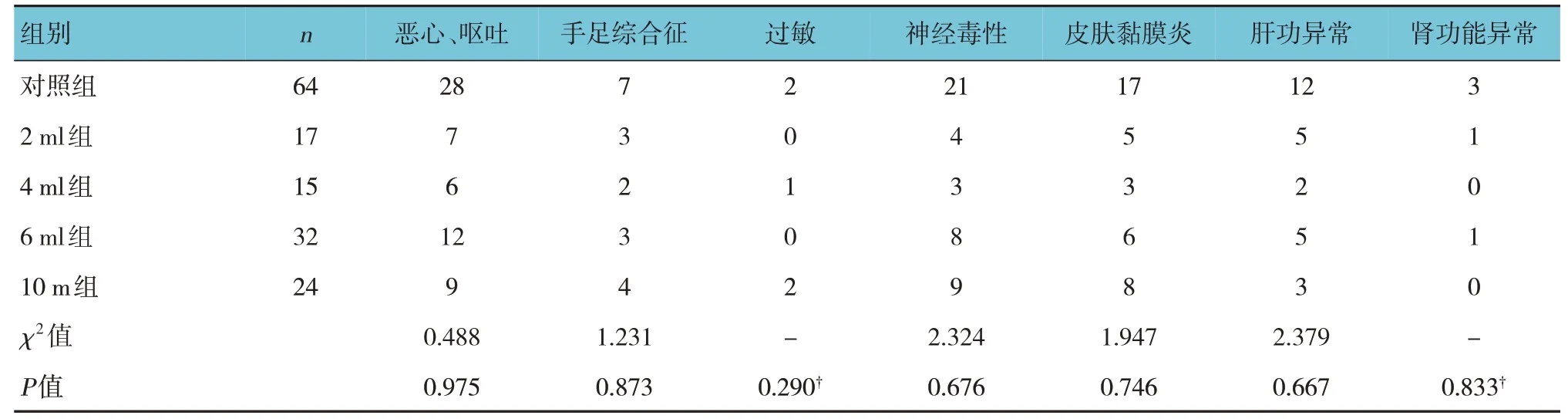
表5 各组不良反应发生率比较 例
3 讨论
近2年来,分子靶向药物和免疫治疗药物在非小细胞肺癌的治疗中有着越来越重要的地位,但是,化疗仍为非小细胞肺癌治疗的基石,对根治术后及驱动基因阴性的患者,化疗更是主要或唯一可能有效的治疗手段[9]。但化疗药物因其不可选择的细胞毒作用,经常合并严重的不良反应,其中骨髓抑制又是最常见的不良反应之一,严重影响的患者后续治疗,进而影响疗效[10]。长效聚乙二醇粒细胞集落刺激因子、非格司亭等在化疗后使用,具有持久提升白细胞及中性粒细胞的作用[11-12],但其价格昂贵,且不能在化疗期间使用,尤其不适合1、8 天化疗方案(例如吉西他滨方案)患者,限制了其在临床的应用。因此,如何减轻化疗后的骨髓抑制程度,具有重要的临床意义。
脾多肽为健康小牛脾脏提取的小分子多肽[13],含有氨基酸、核酸、总糖等成分[14],具有免疫调节作用,能促进T 淋巴细胞、NK 细胞功能,可刺激造血干细胞增殖[15-16],产生大量白细胞及血小板。既往临床研究已观察到脾多肽有刺激骨髓造血、减轻化疗骨髓毒性的作用[17-18]。
白向东等[19]将脾多肽用于乳腺癌术后辅助化疗方案中,结果提示不管激素受体状态,化疗期间联合脾多肽均能减轻白细胞下降程度,改善化疗耐受性。尚立群等[20]在老年晚期非小细胞肺癌患者化疗期间联合应用脾多肽,发现脾多肽组的白细胞、红细胞、血红蛋白、血小板等指标化疗后的下降程度均比对照组低。但以上研究均存在入组样本量偏少,于化疗第几周期作为观察周期在研究中缺乏说明等问题。另有一项Meta 分析[21]纳入25 项国内的随机对照研究共2 055 例患者,均显示化疗期间联合应用脾多肽有助于提高疗效,并降低白细胞、血小板减少发生率,但该研究所纳入的脾多肽研究剂量跨度较大,从4~10 ml 不等,因此无法确定脾多肽的最佳使用剂量。
本研究回顾性分析了该院既往化疗期间联合应用脾多肽患者,使用剂量为2~10 ml 不等,并根据不同的脾多肽剂量分组,以确定化疗期间可产生骨髓保护作用的脾多肽最佳剂量。结果显示,治疗组与对照组治疗前后的白细胞、血小板计数的最低值比较,差异无统计学意义。但将治疗组分为脾多肽注射液2 ml 组、4 ml 组、6 ml 组、10 ml组后再进行比较发现,10 ml 组白细胞、中性粒细胞下降程度最小,与对照组及其他剂量组比较,差异有统计学意义;但血小板差异无统计学意义。本研究只观察到大剂量脾多肽注射液对白细胞的下降程度有改善作用,并未观察到对血小板、红细胞的作用,这与尚立群等[20]的研究结论不一致。原因可能为尚立群等只是比较了化疗前后血细胞变化的平均值,并未指明比较的是化疗后第几天的血常规或者是否为最低值,另外,也可能因本研究样本量较少,尚未观察到大剂量脾多肽注射液对血小板、红细胞的影响。
各组使用G-CSF 的时间比较来看,脾多肽注射液10 ml 组使用G-CSF 时间最少,较其他剂量组明显缩短。各组不良反应比较,差异无统计学意义,显示脾多肽即使剂量加大到10 ml/d,仍有较高的安全性。
本研究为回顾性研究,为尽可能获得足够多的样本量,参考ECOG1594 的研究结论[22],紫杉醇联合顺铂、紫杉醇联合卡铂、多西他赛联合顺铂、吉西他滨联合顺铂4 种方案在白细胞、血小板下降方面的毒性无明显差异。因此,本研究纳入患者的化疗方案包括紫衫联合卡铂(顺铂)、多西他赛联合顺铂、吉西他滨联合顺铂方案,这样保证不同的化疗方案对骨髓抑制的程度具有一致性。
综上所述,脾多肽注射液10 ml 组较其他剂量组及对照组有明显骨髓保护作用,并且能减少G-CSF使用时间,提示今后可开展10 ml 脾多肽对化疗后骨髓保护的前瞻性随机对照研究。

