急性A型主动脉夹层患者发生急性肺损伤的影响因素分析*
刘健,宋然,宋朝国,姜丽杰,陈德峰,张健,贺宝臣
(1.邯郸市中心医院 心胸外与重症医学科,河北 邯郸056001;2.邯郸市第一医院呼吸与危重症医学科二病区,河北 邯郸056000)
急性A 型主动脉夹层是血液经主动脉内膜破损或薄弱处冲入内膜中层形成血管夹层血肿,并随循环血流压力在主动脉内向远处扩展,进而导致血管中层剥离[1]。其病情危重,可并发多器官功能衰竭,其中急性肺损伤(acute lung injury,ALI)是常见的并发症。据统计,急性A 型主动脉夹层患者围手术期ALI 的发生率高达50%,严重影响患者的预后[2]。研究发现急性A 型主动脉夹层患者血管损伤所致的凝血和纤溶系统功能紊乱可促进ALI 的发生,但具体的影响机制尚未完全阐明[3-4]。辅助性T 细胞17(T helper cell 17,Th17)是重要的免疫调控因子,参与机体炎症反应、自身免疫等过程,与哮喘、慢性阻塞性肺疾病等多种肺部疾病的发生密切相关[5],亦可能参与ALI 的发生、发展,但现阶段关于Th17 细胞与ALI 的关系鲜有报道。本研究拟通过分析Th17 细胞、凝血和纤溶系统与急性A 型主动脉夹层合并ALI 患者氧合能力的关系,探讨急性A 型主动脉夹层并发ALI 的影响因素,旨在为临床预防急性A 型主动脉夹层患者ALI 的发生提供参考。
1 资料与方法
1.1 一般资料
选取2017年1月—2019年12月于邯郸市中心医院就诊的急性A 型主动脉夹层患者347 例作为研究对象。纳入标准:①发病到就诊时间≤2 周;②经主
动脉血管CT 成像诊断为急性A 型主动脉夹层;③急性主动脉夹层分型参照Stanford 分型标准[6];④临床资料完整。排除标准:①慢性阻塞性肺疾病、肺部感染及其他原因引起的急性呼吸窘迫综合征;②心室衰竭或心功能Ⅲ级及以上;③纵隔、食管良性肿瘤及恶性肿瘤;④肝、肾、脑等重要器官功能障碍;⑤入院前2 周内有抗血小板、激素、非甾体抗炎药物应用史;⑥贫血、血小板减少性紫癜等血液系统疾病。本研究经医院医学伦理委员会批准,患者及其家属签署知情同意书。
1.2 方法
1.2.1 一般临床资料记录患者的基本资料,包括性别、年龄、体重指数(BMI)、吸烟史、饮酒史、高血压病史、糖尿病史、冠心病史、心电图ST 段波形、心包积液、胸腔积液、主动脉瓣关闭不全、左室射血分数、主动脉以远动脉受累情况、血气分析参数及白细胞计数。
1.2.2 生化指标的检测抽取患者入院后24 h 内静脉血10 ml(2 份)。1 份血样以3 000 r/min 离心15 min,取上清液置于-20℃冷冻保存备用。使用7170 全自动生化分析仪(日本日立公司)检测凝血、纤溶及其他生化指标:组织因子(TF)、组织因子途径抑制物(TFPI)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、D-二聚体、纤维蛋白原降解产物(FDP)、纤溶酶原激活物抑制剂(PAI-1)、血肌酐(Scr)、C 反应蛋白(CRP)、肌酸激酶同工酶(CK-MB)、血红蛋白(Hb)、血小板(PLT)(所用试剂盒均购于上海蓝源生物科技有限公司)。另1 份血样经红细胞裂解液裂解、PBS 清洗液清洗稀释至1×106个细胞/ml,流式细胞仪(美国BD 公司)分析Th17 细胞比例(所用试剂盒均购于美国Sigma 公司)。
1.2.3 分组标准根据患者血气分析结果及吸入氧浓度计算氧合指数(氧合指数=动脉氧分压/吸入氧浓度百分比);ALI 的诊断符合柏林标准[7];根据氧合指数对患者进行分组:氧合指数≤200 mmHg 纳入ALI组(115例),氧合指数>200 mmHg纳入NALI 组(232 例)。
1.3 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料均以均数±标准差(±s)表示,比较用t检验;计数资料以构成比(%)表示,比较使用χ2检验;影响因素的分析采用Logistic 逐步回归分析模型。P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般临床资料的比较
两组患者的年龄,胸腔积液或气胸、肺不张,肠系膜上动脉受累,肾动脉双侧受累,白细胞,CRP 比较,差异有统计学意义(P<0.05),ALI 组高于NALI 组;两组患者性别、吸烟史、饮酒史、高血压病史、糖尿病史、冠心病史、BMI、心电图ST段波形、心包积液、主动脉瓣关闭不全、左室射血分数、头臂干或左颈总动脉受累、腹腔干受累、肾动脉单侧受累、Hb、PLT、Scr、CK-MB比较,差异无统计学意义(P>0.05)。见表1。
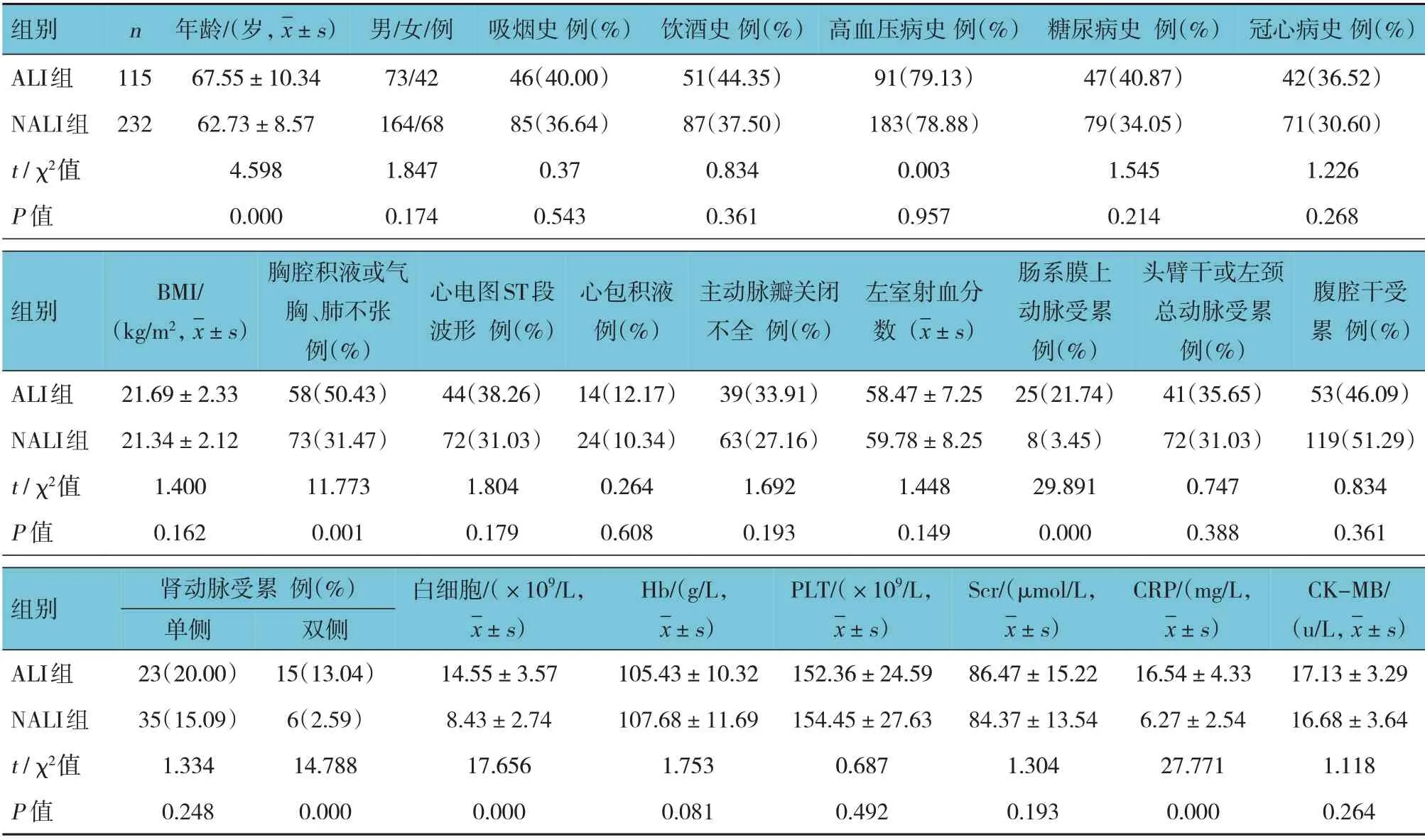
表1 两组患者一般临床资料的比较
2.2 两组Th17 细胞、凝血、纤溶系统指标的比较
两组患者的Th17 细胞、TF、TFPI、APTT、PT、D-二聚体、FDP 和PAI-1 比较,差异有统计学意义(P<0.05),ALI 组的Th17 细胞、TF、TFPI、D-二聚体、FDP 和PAI-1 高 于NALI 组,而APTT 和PT 低于NALI 组。见表2。
表2 两组患者Th17细胞、凝血和纤溶系统指标的比较(±s)

表2 两组患者Th17细胞、凝血和纤溶系统指标的比较(±s)
组别ALI组NALI组t 值P 值n 115 232 Th17细胞/%7.59±1.69 3.69±1.05 26.369 0.000 TF/(ng/ml)19.69±4.73 8.56±3.47 24.825 0.000 TFPI/(ng/ml)183.56±32.45 104.57±23.69 25.746 0.000 APTT/s 25.26±5.72 34.43±6.47 12.902 0.000 PT/s 10.32±3.27 14.59±3.74 10.425 0.000 D-二聚体/(mg/L)2.32±0.57 1.47±0.36 16.916 0.000 FDP/(mg/L)17.46±4.57 6.29±2.13 31.068 0.000 PAI-1/(ng/ml)87.55±19.79 41.64±14.73 24.289 0.000
2.3 ALI 组患者Th17 细胞、凝血和纤溶系统指标与氧合指数的相关性
Pearson 相关分析显示ALI 组患者的Th17 细胞(r=-0.805,P=0.000)、TF(r=-0.808,P=0.000)、D-二聚体(r=-0.695,P=0.000)、PAI-1(r=-0.729,P=0.000)与氧合指数均呈负相关。见图1。
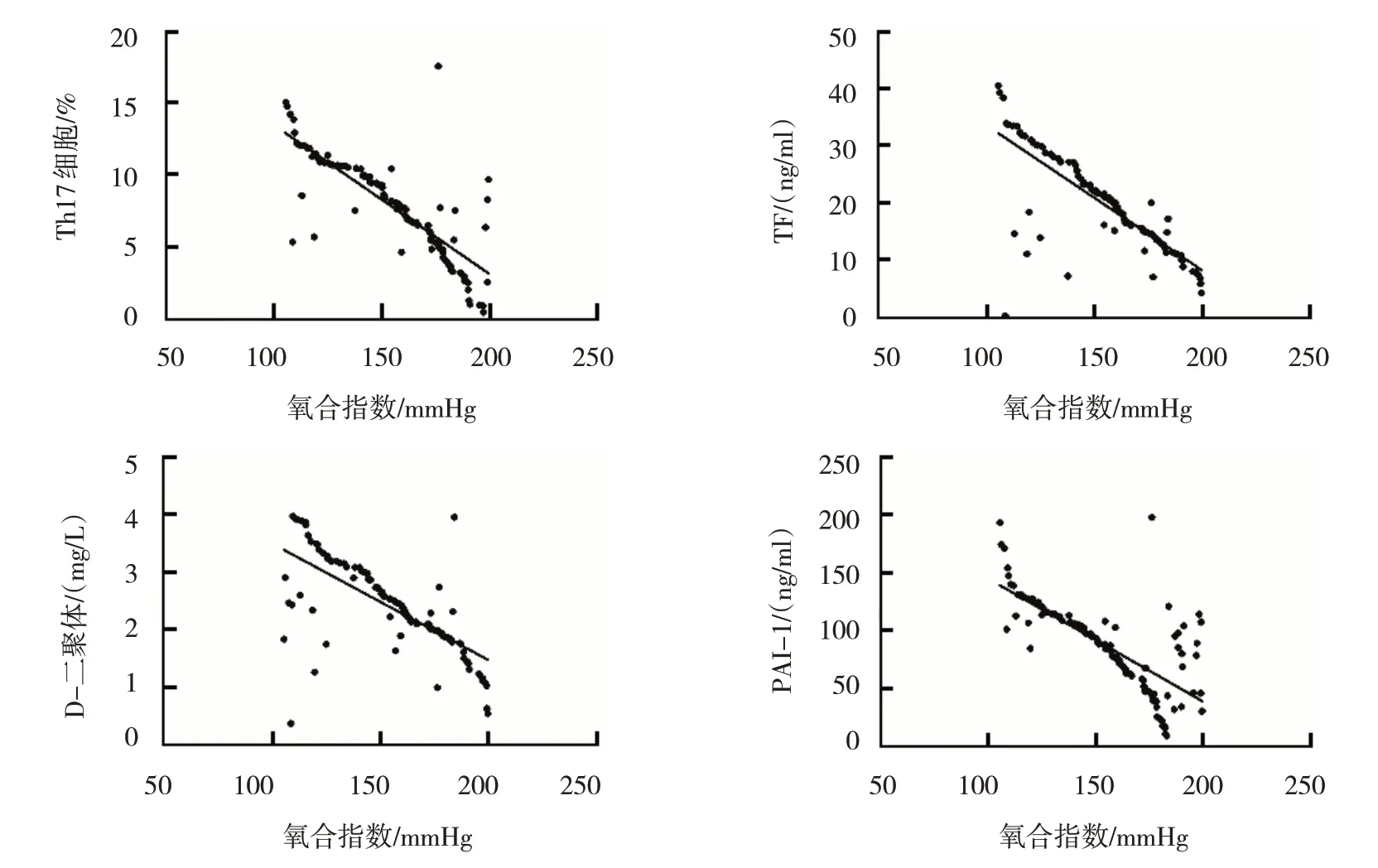
图1 ALI组患者Th17细胞、凝血和纤溶系统指标与氧合指数的相关性
2.4 急性A 型主动脉夹层患者并发ALI 的危险因素分析
以急性A 型主动脉夹层患者是否并发ALI 为因变量(NALI=0,ALI=1),以单因素分析有统计学意义的因素作为自变量(肠系膜上动脉受累:否=0、是=1,胸腔积液:否=0、是=1,年龄、Th17 细胞、TF、D-二聚体均为连续变量),采用Logistic 逐步回归分析模型分析ALL 的影响因素(α入=0.05,α出=0.10),结果显示:高龄[=1.849(95% CI:1.132,9.147)]、肠系膜上动脉受累[=3.429(95% CI:1.264,11.138)]、胸腔积液[=2.679(95% CI:1.627,10.149)]、Th17细胞比例升高[=2.647(95% CI:1.167,8.267)]、TF升高[=1.723(95% CI:1.117,8.445)]、D-二聚体升高[=1.746(95% CI:1.366,10.546)]均是急性A 型主动脉夹层患者并发ALI 的危险因素(P<0.05)。见表3。

表3 急性A型主动脉夹层患者并发ALI的Logistic逐步回归分析参数
3 讨论
急性主动脉夹层病情危重,特别是急性A 型主动脉夹层患者主动脉撕裂范围较大、病变广泛,常引起心脏瓣膜、心包、肺脏及腹腔脏器等功能障碍,肺脏氧合损伤是其常见并发症之一,可进展为急性呼吸窘迫综合征,严重影响疾病的转归[8]。据文献统计[9],急性A 型主动脉夹层患者ALI 的发生率将近50%。本研究急性A 型主动脉夹层患者ALI 的发生率为33.14%(115/347),与既往的研究结果接近。急性A 型主动脉夹层患者并发ALI 的机制较为复杂,其引发的凝血、纤溶系统异常导致肺氧合障碍和瀑布性炎症反应导致肺组织损伤是目前较为认可的机制[3],但机体炎症反应和凝血、纤溶系统的调控机制比较复杂,目前,尚无临床统一认可的相关指标用于评估及预测ALI 的发生。
凝血、纤溶系统紊乱是急性A 型主动脉夹层患者并发ALI 的重要机制之一,其引发的血栓形成及纤维蛋白沉积是导致肺氧合功能障碍的基础。TF是机体外源性凝血级联反应最重要的激活因子,其与Ⅶa 因子结合后激活Ⅹa 因子,进而促进凝血酶和纤维蛋白原的生成,导致APTT 和PT 缩短。正常情况下,循环血液中的TF 极少,但急性A 型主动脉夹层患者血管破损,机体应激反应促使淋巴细胞、活化的巨噬细胞及内皮细胞释放大量TF 入血,异常升高的TF 激活凝血酶引起肺循环血栓形成及纤维蛋白原沉积,导致肺氧合功能障碍[10]。TFPI 是机体TF、Ⅵ因子和Ⅹ因子的天然抑制物,可减少肺泡内纤维蛋白的产生及蛋白的渗漏,其恒定的表达可维持内皮细胞抗凝血功能及正常的血液流动,急性A型主动脉夹层患者产生大量的TF,间接的引起TFPI的升高以对抗凝血异常[11]。有研究[12]显示急性主动脉夹层围术期并发ALI 患者循环及肺泡灌洗液中的TF、TFAI 升高,且TF 与氧合指数呈负相关,提示TF与ALI 的发生密切相关。本研究显示急性A 型主动脉夹层并发ALI 患者的TF、TFAI 升高,而APTT 和PT下降,进一步分析显示TF 与氧合指数呈负相关,这也与既往的研究结果类似[4,12],TFAI 与氧合指数无相关性,可能是机体增加的TFAI 不足以对抗凝血激活状态,未能中和TF 的作用。D-二聚体是交联纤维蛋白经纤溶酶分解后的终产物,其可以较好地反映机体纤溶状态[13]。如前文所述,急性A 型主动脉夹层患者产生大量的TF 导致凝血异常形成大量的纤维蛋白,其经纤溶酶的分解引起D-二聚体和FDP 升高,提示机体纤溶亢进。机体纤溶亢进也是代偿性分解纤维蛋白的沉积,以防肺组织微小血栓的形成及肺泡透明膜的形成,因此D-二聚体反映纤溶状态同时,也反映了凝血情况[14]。PAI-1 是机体内最主要的纤溶酶原激活物抑制剂,正常情况下其对抗纤溶系统以维持正常凝血功能,当机体出现纤溶亢进、炎症刺激等病理状态时其大量表达,以对抗纤维蛋白的分解,故其可以间接地反应机体的纤溶状态[15]。孙博等[16]研究显示,急性A 型主动脉夹层发生ALI 患者围手术期的D-二聚体水平与氧合指数呈负相关,邰文琳等[17]研究发现PAI-1 是急性肺损伤患者预后不良的指标之一,这都提示D-二聚体和PAI-1 可预测ALI 的发生。本研究结果显示,急性A型主动脉夹层并发ALI 患者的D-二聚体、FDP 和PAI-1 水平升高,且D-二聚体和PAI-1 与氧合指数均呈负相关,与既往的研究结果一致。
急性A 型主动脉夹层发生时主动脉内膜撕裂脱落,血液进入假腔与中层细胞外基质接触引起炎性细胞活化,导致级联炎症反应,进而引起肺组织损伤、肺泡毛细血管通透性增加[18]。Th17 细胞是CD4+T 淋巴细胞的亚群之一,其促使炎症因子白细胞介素-17(Interleukin-17,IL-17)高表达。贺宝臣[19]研究发现急性A 型主动脉夹层患者并发ALI 时外周血Th17 细胞比例升高,且对急性A 型主动脉夹层患者发生ALI 具有较高的诊断价值。还有一项临床研究[20]发现急性呼吸窘迫综合征患者外周血Th17 细胞明显增加,其与病情严重程度及预后密切相关,推测其可以反应肺损伤的严重程度。本研究显示,急性A 型主动脉夹层并发ALI 患者外周血Th17 细胞升高,且与氧合指数呈负相关,这也印证了既往的结论,同时本研究显示Th17 细胞的升高与患者氧合功能的下降密切相关,更进一步证实了其对ALI 的促进作用。急性A 型主动脉夹层患者外周血Th17细胞升高的机制尚不明确,可能与级联炎症反应导致的免疫应答失衡有关,Th17 细胞升高导致IL-17大量释放入血,其与受体结合可使中性粒细胞、巨噬细胞等大量炎症细胞聚集于肺组织,加重肺局部炎症反应,引发肺氧合功能障碍[18-20]。
急性A 型主动脉夹层并发ALI 的影响因素较多,何诚等[21]研究显示炎症、胸腔积液、肠系膜上动脉受累及是急性A 型主动脉夹层患者并发ALI 的危险因素。杨彦伟等[22]研究显示,高龄、高IL-6 水平是急性A 型主动脉夹层发生ALI 的危险因素。本研究结果显示,急性A 型主动脉夹层并发ALI 患者的外周动脉受累比例、炎症因子、凝血及纤溶指标均升高,进一步分析发现高龄、肠系膜上动脉受累、胸腔积液、Th17 细胞比例升高、TF 升高、D-二聚体升高均是急性A 型主动脉夹层患者并发ALI 的危险因素,与既往研究相比有相似之处,也更加全面地诠释了急性A 型主动脉夹层患者并发ALI 的影响因素。高龄患者身体机能较差,急性A 型主动脉夹层引起的循环障碍及炎症反应更易损伤其肺组织。胸腔积液可导致胸膜腔压力增加,易诱发限制性通气障碍,损伤患者呼吸功能进而引发ALI。急性A型主动脉夹层患者肠系膜上动脉受累时,肠壁缺血水肿,诱发大量炎症因子释放入血,增加ALI 的概率[23]。Th17 细胞、TF、D-二聚体分别是反映机体炎症反应、凝血和纤溶系统的指标,其水平越高,患者体内炎症反应、凝血和纤溶系统异常也越明显,其作为急性A 型主动脉夹层并发ALI 的影响因素也进一步印证了前文所述三者与ALI 的发生密切相关。
综上所述,急性A 型主动脉夹层合并ALI 患者的Th17 细胞,凝血、纤溶系统指标异常与肺氧合指数的下降密切相关,且Th17 细胞、TF、D-二聚体、年龄、肠系膜上动脉受累及胸腔积液是诱发急性A型主动脉夹层患者ALI 的影响因素,临床中可据此对患者进行个体化治疗以降低ALI 的发生率。

