HIV阴性儿童马尔尼菲篮状菌病2例临床分析并文献复习
范江花,罗海燕,杨龙贵,王承娟,杨 珍,黄 康,王梦荧,肖政辉
[1. 湖南省儿童医院急救中心(急诊综合一科),湖南 长沙 410007; 2. 南华大学儿科学院,湖南 衡阳 421000]
马尔尼菲篮状菌病(Talaromycesis marneffei,TSM)是由马尔尼菲篮状菌(Talaromycesmarniffei,TM)引起的一种少见深部真菌病,多见于人类免疫缺陷病毒(HIV)阳性宿主或免疫抑制宿主[1],免疫功能正常宿主少见,发生于儿童更为少见[2],主要累及单核巨噬细胞系统,临床表现复杂多样,病死率高,极易误诊。近年来,儿童侵袭性真菌感染日益受到重视,儿童播散性TSM罕见报道,而STAT1基因突变免疫缺陷致儿童播散性TSM报道更罕见,因此现将本院收治的2例非HIV儿童播散性TSM报告如下,并结合相关文献进行复习,以提高TSM的早期诊断及鉴别诊断,提高临床医生对该病的认识。
1 病例资料
1.1 一般资料 病例1,男性,2岁,因发现右下肢肿块2个月余,反复发热,咳嗽20 d入院。外院多所医院治疗无好转,查胸部CT考虑结核感染可能,予HRZE抗结核治疗仍未见效, PPD皮试及结核感染T细胞均阴性,考虑依据不足,入本院治疗。体格检查:神清,营养不良貌,浅表多处淋巴结肿大,颈软,双肺可闻及湿啰音,心率130次/分,腹膨隆,皮下脂肪薄,肝肋下5 cm,质硬,脾未及,右下肢近踝关节处可见一约5 cm×6 cm大小肿块,质硬,无压痛及红肿,皮温不高,肢端暖。实验室检查:血常规正常,降钙素原(PCT)2.07 ng/mL,C反应蛋白(CRP)48.70 mg/L,血沉(ESR)62 mm/h;肝功能:清蛋白25.50 g/L,丙氨酸氨基转移酶(ALT)202.10 IU/L,天门冬氨酸氨基转移酶(AST)518.40 IU/L,乳酸脱氢酶(LDH)690.0 IU/L;真菌β-1.3-D-葡聚糖检测(G试验)及曲霉菌抗原正常;血、真菌培养阴性;体液免疫及淋巴细胞免疫基本正常。胸部CT增强示肺结核并血播散、合并真菌感染;支气管镜示右中开口肉芽增生阻塞,黏膜糜烂坏死;腹部彩超示肝大,淋巴结肿大融合:深部真菌感染?淋巴瘤?炎性包块?下肢CT右侧腓骨中下段病变,考虑感染性病变?合并病理性骨折?淋巴结活检结果符合真菌感染(见图1A)。特殊染色结果:PAS(+)可找见真菌孢子。我院及北京医院骨髓培养均示TM生长。
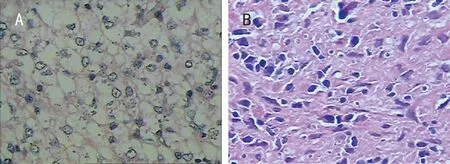
A: 病例1(2016月2月14日)淋巴结活检组织细胞内可见真菌孢子样结构。B: 病例2(2019年4月26日)淋巴结活检可见大量真菌胞子结构。
病例2,女性,4岁10个月, 因发热、咳嗽14 d入院,当地医院治疗无好转,既往体质欠佳,2岁6个月起有反复灰指甲和口腔溃疡病史,有长期服用中药史。体格检查:神清,贫血面容,左锁骨上可扪及蚕豆大小串珠状淋巴结,活动度差,边界欠清,部分可融合,颈软,双肺可闻及少许湿啰音,心率100次/分,腹膨隆,肝肋下4~5 cm,脾肋下7~8 cm,质硬。实验室检查:血常规白细胞计数(WBC)2.94×109/L,血红蛋白(Hb)77 g/L,血小板计数(PLT)81×109/L;PCT 8.01 ng/mL;肝功能:AST 125.3 IU/L,清蛋白 26.8 g/L,PPD及结核感染T试验阴性;G试验2 327.1 pg/mL,曲霉菌抗原0.688;体液免疫及淋巴细胞免疫基本正常;骨髓细胞学示增生明显活跃,可见中毒颗粒。血培养阴性,两次痰真菌培养、骨髓普通+真菌培养均示TM;胸腹部CT平扫+增强显示:(1)脾大,脾脏内结节状不均匀强化,性质待定;(2)肺部感染(真菌?结核?),腹膜后肿块彩超示脾大、肝大,腹腔及腹膜后淋巴结大,盆、腹腔积液。淋巴结活检符合真菌性淋巴结炎(见图1B)。特殊染色结果:真菌荧光免疫染色及PAS染色(+)。
1.2 诊疗经过 病例1先后予以伏立康唑(3周)、两性霉素B脂质体抗真菌感染(2周),护肝等治疗,病情好转出院。随访:出院后一直予以伊曲康唑口服,右下肢肿块逐渐消退,多次肺泡灌洗及骨髓真菌培养均阴性后再服药6个月,共1年后停药,现随访患儿未再复发,偶有感冒,体质一般,已上幼儿园,目前正在准备造血干细胞移植过程中(等待配型结果中)。病例2予以伏立康唑抗真菌感染(家属因经济原因拒绝用两性霉素B),用药2 d后体温正常,病情好转出院。随访:出院后一直口服伏立康唑治疗,多次复查各项指标均阴性,肺部CT病变吸收,腹部彩超脾肋下未及,肝肋下17 mm,共7个月后停药。目前患儿体质尚可,无其他特殊不适。见图2、3。
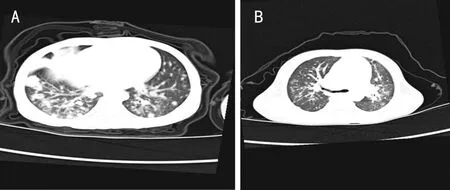
A: 2016年1月22日肺部CT示片状高密度影及弥漫性分布斑点状、大小不一结节状密影;B: 2016年3月22日示片状高密度影及弥漫性分布条索状、结节状高密度影范围较前明显缩小。

A:2019年4月19日肺部CT示双肺弥漫分布小结节模糊影;B:2019年7月13日复查示左肺上叶可见少许淡薄斑片状影,未见结节模糊影。
1.3 基因检测结果 病例1行免疫缺陷相关基因检测示:免疫缺陷病(STAT1基因突变),病例2因经济因素未完善免疫缺陷相关基因检测。
2 文献复习
以“马尔尼菲青霉菌/病”或“马尔尼菲篮状菌/病”为关键词,检索时间为2010年1月—2020年1月,在万方医学网数据库和中国知网数据库检索中文共484篇,“马尔尼菲青霉菌/病”或“马尔尼菲篮状菌/病”和“儿童”共23篇,其中病例报告21篇。同时以“Penicilliummarneffei或Talaromycesmarneffei”为关键词对PubMed数据库进行检索,英文文献共340篇。以“Penicilliummarneffei或Talaromycesmarneffei”和“children”为关键词进行检索共24篇,病例报告10篇。因搜索到的英文文献病例大部分来自国内,因此将国内外文献一起总结。
HIV阴性儿童TSM病例共53例,年龄3个月~13岁,其中男性36例(67.9%),临床表现:大部分患儿以呼吸系统疾病为首发30例(56.6%),神经系统4例(7.5%),皮疹4例(7.5%),颈部肿块3例(5.7%),下肢肿块起病1例(1.9%);合并嗜血细胞综合征6例。其中发热45例(84.9%),肝大35例(66.0%),脾大30例(56.6%),淋巴结肿大30例(56.6%),皮疹(脓疱或结节)7例(13.2%),误诊肺结核5例(9.4%)。既往史:X-连锁高IgM 6例,反复口腔溃疡4例,反复肺炎4例,先天性巨结肠2例,早产2例,结核2例,高IgE综合征、G-6PD酶缺乏、白血病、水痘、左下肺囊腺瘤样畸形合并感染各1例。确诊方法:骨髓培养24例(45.3%),血培养23例(43.4%),淋巴结活检16例(30.2%),肺泡灌洗培养8例(15.1%),肺活检4例(7.5%),痰真菌培养2例(3.8%),脑脊液、腹腔穿刺液、皮肤、肿块分泌物培养各1例,支气管内膜、皮肤、脑组织活检各1例。治疗:伏立康唑14例,两性霉素B脂质体+伊曲康唑11例,伏立康唑+伊曲康唑8例,两性霉素B脂质体+伏立康唑4例,两性霉素3例,氟康唑3例,伊曲康唑2例,两性霉素+氟康唑1例,未治疗7例。预后:好转32例(60.4%),死亡21例(39.6%)。
3 讨论
TSM是由TM感染引起的一种深部真菌病,多见于HIV阳性患者,HIV阴性儿童播散性TSM报道很少[3],由于其临床表现缺乏特异性,常导致临床误诊及漏诊[4]。TM为条件致病菌,是迄今所发现的唯一能使人类致病的双相青霉菌,是东南亚地区重要的致病性热变形真菌[5],吸入分生孢子为主要传播途径[6]。根据其生物特性2011年由马尔尼菲青霉菌更名为马尔尼菲篮状菌[7]。TM感染病情进展快,病死率高,因此快速准确地诊断对改善患儿预后起着至关重要的作用[8]。TM通常经肺侵入人体,肺常是全身性播散性感染的首要器官。也可通过网状内皮系统播散,出现淋巴结、肝脾大及三系或两系减少。本文病例2有发热及咳嗽,但咳嗽症状及肺部体征均不明显,而肺部CT改变均较重。因此,早期行肺部CT检查有助于临床判断。TSM临床缺乏特异性,易与隐球菌病、结核病等混淆,给临床诊断带来困难,而HIV阴性TM感染典型临床表现仍未明确[2]。Qiu等[9]发现HIV阴性TM感染合并胸腔积液患者中,31.1%被误诊为结核感染,并长期接受抗结核治疗。真菌培养或组织病理学检查是诊断TSM的金标准[10]。本院病例1以肢体肿块起病,后出现呼吸系统症状,误诊为结核感染。病例2以发热,肝脾大及三系减少起病,高度考虑血液系统疾病,最后2例均行骨髓培养及淋巴结活检确诊。因此,在临床上出现治疗疗效欠佳,应尽早行培养或组织活检以明确诊断。病例2 G试验和半乳甘露聚糖检测(GM试验)均增高,但病例1均正常,因此不能只根据G试验、GM试验结果否定侵袭性真菌感染的可能,需结合临床判断。TSM多发生于HIV阳性患者,但也可发生于HIV阴性者,表明HIV阴性和没有继发性免疫缺陷的TSM患者可能有潜在的未被认识的免疫缺陷。因此,对HIV阴性侵袭性真菌感染患儿进行基因检测是很有必要的。研究证实,HIV阴性TSM常有免疫功能异常,如严重联合免疫缺陷、先天性中性粒细胞缺乏、高IgE和高IgM综合征等[11-12]。(IFN-γ)/STAT1信号通路和STAT3-介导Th17分化等基因缺陷可能与HIV阴性儿童真菌感染相关[2,13]。Lee等[14]研究发现,信号传导与转录活化因子1(STAT1)功能获得性紊乱是儿童侵袭性真菌病的潜在病因。Zeng等[11]回顾7例非HIV-TSM婴幼儿,其中5例有反复肺炎、鹅口疮及嗜血细胞综合征等基础疾病。文献总结报道了19例免疫缺陷患者中15例为侵袭性真菌感染,10例为x-连锁高IgM综合征,3例高IgE综合征,4例STAT1获得性紊乱,2例常染色体隐性IFN-γRI缺陷[15-16]。本文文献复习病例中近50%患儿既往存在不同程度的免疫基础疾病,说明TSM患者大部分跟免疫功能缺陷或异常相关。本文报道的2例患儿均存在免疫功能异常,但T细胞免疫及体液免疫均无异常,其中病例1基因检测示STAT1基因突变,确诊为免疫缺陷病;病例2既往有反复灰指甲及口腔溃疡病史,为慢性皮肤黏膜念珠菌感染(CMC)的特征。STAT1是细胞多种信号传导途径相交叉的枢纽,其基因突变可导致原发性免疫缺陷病(PID)的发生[17-18]。98% STAT1功能获得性突变可能发展为CMC感染[19],若发生侵袭性真菌感染或癌症,提示预后不良[20]。本文病例1确诊STAT1基因突变,既往无CMC感染,而未确诊的病例2既往却有CMC感染的临床特点。STAT1基因突变致侵袭性真菌感染的报道甚少,甘川等[21]报道5例STAT1功能获得性基因突变儿童慢性皮肤黏膜念珠菌病中仅1例为侵袭性真菌感染。病例1即为STAT基因突变所致侵袭性TSM。STAT1功能获得性突变患者70%~80%的淋巴细胞数、淋巴细胞功能及免疫球蛋白处于正常水平。目前STAT1基因突变致免疫缺陷病除干细胞移植外,尚缺乏有效疗法。国外有15例患者接受了造血干细胞移植(HSCT)治疗,其中仅有6例存活(40%)。因此HSCT可以作为一种有效的治疗方式,但其并发症可能导致移植后重建失败而降低存活率[22]。
TSM的治疗方案目前尚无统一建议,早期诊断及有效、低毒、规律的抗真菌药物是治疗的关键。TSM抗菌药物治疗方案首选两性霉素B,接着用伊曲康唑序贯治疗[23]。但两性霉素B可致肝肾功能损伤、重度低血钾等严重不良反应,具有一定局限性。伏立康唑是新型广谱三唑类抗真菌药,可作为TSM的治疗药物应用于临床。Ouyang等[24]分析伏立康唑在治疗播散性TM感染安全性和疗效性发现,14例患者中10例第16周完全缓解,3例部分缓解,只有1例无反应,均证实伏立康唑是一种有效、耐受性良好的治疗方法[25]。本组2例播散性TSM中病例1先后予以静脉滴注伏立康唑、两性霉素B脂质体静脉滴注,后改用伊曲康唑口服维持治疗,1年后停药;病例2予以伏立康唑静脉滴注4周后改口服,7个月后逐渐停药,均取得良好的治疗效果。
综上所述,TSM临床表现复杂多样,缺乏特异性,容易误诊及漏诊,给临床诊断带来困难。因此,对于抗菌药物治疗无效,且普通感染无法解释的多系统损伤,应警惕本病可能,尽快完善血、骨髓、肺泡灌洗液培养,以及组织活检(皮肤、淋巴结等)等检查进一步明确,同时积极查找导致TSM可能的基础疾病,如免疫缺陷相关基因检测,从而达到早期诊断,早期治疗,降低病死率的目的,改善预后。

