微波消融联合3D打印技术在骨转移癌治疗中的应用
高峰, 韦永中, 李菊明, 马益民
骨转移癌是癌症晚期的表现之一,易发生病理性骨折。目前对于原发灶已切除或可以切除且全身仅有单处骨转移的患者,临床手术治疗以病段切除+肿瘤假体置换为主,而对于已有多发转移或原发灶无法切除以及全身情况较差不能耐受手术的患者,以肿瘤病灶刮除+骨水泥填塞术为主。但该种手术方式无法达到良好的“阴性切缘”,术后复发率较高。微波消融技术利用肿瘤组织较正常组织对热损伤更为敏感的特点,将射频电流通过微波针传导入肿瘤组织,利用水分子之间的摩擦产生热量,升高局部温度,使蛋白质变性,肿瘤细胞凝固坏死[2]。3D打印技术复原病灶组织及周围解剖,优化烧灼点及微波针穿刺路径。江苏省人民医院采用微波消融联合3D打印技术对局部骨转移病灶进行处理,再予病灶刮除+骨水泥填塞术,效果显著,现报道如下。
1 资料与方法
1.1 研究对象 选取2015年1月至2019年7月在我院就诊的骨转移癌患者42例,术前根据患者意愿选择术式,分成微波消融联合3D打印病灶刮除+骨水泥填塞组(观察组)和病灶刮除+骨水泥填塞组(对照组)。入选标准:①癌症病史,影像学检查确诊四肢或骨盆骨转移。②预计生存期>3个月。③已发生或有发生病理性骨折风险(四肢病灶Mirels评分>8分,髋臼病灶Harrington分级Ⅱ~Ⅲ级;骶骨及髂骨病灶较大;疼痛症状明显;且涉及骶髂关节面;或有神经症状)。④全身情况尚可,可以耐受手术,但无法承受病灶广泛切除,术后恢复时间较长的患者。观察组20例,男性11例,女性9例;平均年龄53.4岁(34~77岁);单发转移灶12例,多发转移但仅需处理单处骨转移病灶8例;原发癌种:肺癌9例,肝癌4例,乳腺癌2例,肾癌2例,胃癌、甲状腺癌、前列腺癌各1例;手术部位:股骨8例,骨盆5例,肱骨3例,胫骨2例,肩胛骨2例;17例患者采用微波消融联合3D打印病灶刮除+骨水泥填塞结合螺钉、钢板或髓内钉固定术,3例患者仅采用微波消融联合3D打印病灶刮除+骨水泥填塞术。对照组22例,男性13例,女性9例;平均年龄54.5岁(32~75岁);单发转移灶13例,多发转移但仅需处理单处骨转移病灶9例;原发癌种:肺癌8例,肝癌5例,乳腺癌、肾癌、胃癌各2例,甲状腺癌、前列腺癌各1例,原发灶不明1例;手术部位:股骨8例,骨盆8例,肱骨3例,胫骨2例,肩胛骨1例; 19例患者采用病灶刮除+骨水泥填塞结合螺钉、钢板或髓内钉固定术,3例患者仅采用病灶刮除+骨水泥填塞术。
1.2 手术方法 所有患者术前检查全身PET/CT或ECT,手术部位X线、CT、MR,部分患者检查CTA,3D打印复原手术区域解剖结构,明确肿瘤范围及与周围重要血管神经关系和距离,分析肿瘤瘤种、部位、血供,必要时术前行肿瘤血管栓塞术。
观察组术中根据不同部位肿瘤,常规手术切开,根据术前设计,充分显露并将肿瘤和正常组织分开,生理盐水纱布保护正常组织,尽可能游离并牵开保护周围重要血管神经,如显露困难,则根据术前影像学及3D打印模型(图1)做好其位置的预判。术野无法直接观察或不易接触到的肿瘤组织,在B超引导下避开血管神经,经皮穿刺至肿瘤组织进行烧灼。术中结合金属网格透视定位,将微波针(南京亿高微波系统工程有限公司,ECO-100A型冷循环微波刀)插至术前设定区域,功率60 W,根据肿瘤大小及形状,多点烧灼,每个单点烧灼约5 min,确保烧灼范围覆盖肿瘤整体。测温针不断测量微波针针尖及周围正常组织温度,通过泼洒生理盐水降温等方式,使针尖周围组织保持在80~100 ℃,肿瘤外正常组织温度保持在40 ℃以下。完成消融后彻底刮除病变区域肿瘤组织,高速磨钻磨锉髓腔壁及皮质表面,尽可能保留皮质骨结构,无水酒精及灭菌水浸泡,冲洗后填塞骨水泥,螺钉、钢板或髓内钉固定(图2)。对照组术中直接刮除肿瘤组织,视情况予以内固定处理。

图1 患者男,48岁,肝癌移植术后1年右侧骶骨转移,术前骨盆MR图(a)、骨盆CT图(b);3D打印效果图(c、d);微波烧灼后效果图(e);术后骨盆X线图(f)
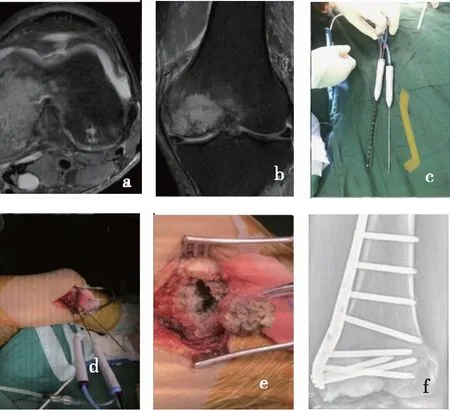
图2 患者男,52岁,肺癌病史2年,膝关节骨转移,术前膝关节MR图(a、b);微波消融针和测温针(c);术中烧灼肿瘤组织同时测量烧灼点及周围正常组织温度(d);烧灼后的肿瘤组织呈焦炭或“熟肉”状态(e);填塞骨水泥后置入锁定钢板(f)
骨转移癌患者由于全身情况普遍较差,术中尽可能遵守减少不必要的创伤,缩短手术时间,减轻患者经济负担的原则,因此,对部分病灶处于非负重区,所侵犯的骨骼力学结构尚存的患者,可不使用内固定材料或简化使用内固定材料。
所有患者术后留置引流管至引流量少于30 ml后拔除,术后3 d开始功能锻炼,术后每3个月复查X线及MR,进行疼痛及患肢功能评分。
1.3 评价指标及方法 比较两组患者术中出血量,术前、术后1周及术后3个月的疼痛视觉模拟评分(VAS评分)。采用MSTS评分评价患者术后患肢功能,MSTS评分:优25~30分,良20~25分,中15~20分,差15分以下,术后12个月取其最佳评分。
2 结果
2.1 术中出血量及术后并发症比较 观察组术中出血量(176.0±9.2)ml少于对照组(389.0±14.8)ml,差异有统计学意义(χ2=6.329,P<0.05)。
截至2020年7月31日或患者死亡日期 ,所有患者均获随访。生存时间均>3个月。观察组中1例胃癌肱骨中段转移患者术后出现虎口感觉麻木,腕关节及拇指背伸功能障碍等患肢桡神经损伤症状,予口服神经营养及消肿药物1月后症状逐渐好转。对照组1例肺癌髂骨转移患者术后伤口渗出较多,予床边清创,重新缝合后伤口愈合。其余患者术后未出现感染、血管神经损伤等急性并发症。1年复发率统计中,观察组和对照组中各有2例因复查MR伪影较大,患者拒绝穿刺明确,故剔除出组。观察组包括已故患者有3例明确局部复发,复发率为16.37%(3/18),但无内固定失效者;对照组明确局部复发率为30.00%(6/20),1例内固定失效。观察组局部复发率低于对照组,但差异无统计学意义,见表1。患者均因全身情况较差或个人原因,未接受再次手术,选择放疗等保守治疗。

表1 两组复发率比较(例)
2.2 术前、术后1周及术后3个月疼痛比较 两组术前VAS评分差异无统计学意义(P>0.05);两组术后1周、术后 3个月VAS评分均有下降,观察组VAS评分低于对照组,差异具有统计学意义(P<0.05),见表2。
表2 两组术前、术后VAS评分比较(分,
2.3 术后患肢功能比较 术后12个月两组患肢MSTS评分情况详见表3,观察组MSTS评分优于对照组,差异有统计学意义(P<0.05)。
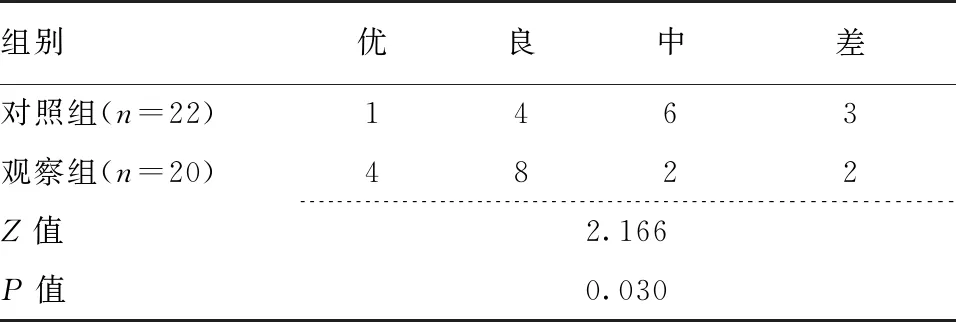
表3 术后12个月两组MSTS评分等级比较(例)
2.4 术后生存比较 观察组和对照组生存率相比,差异无统计学意义(P>0.05)(图3)。
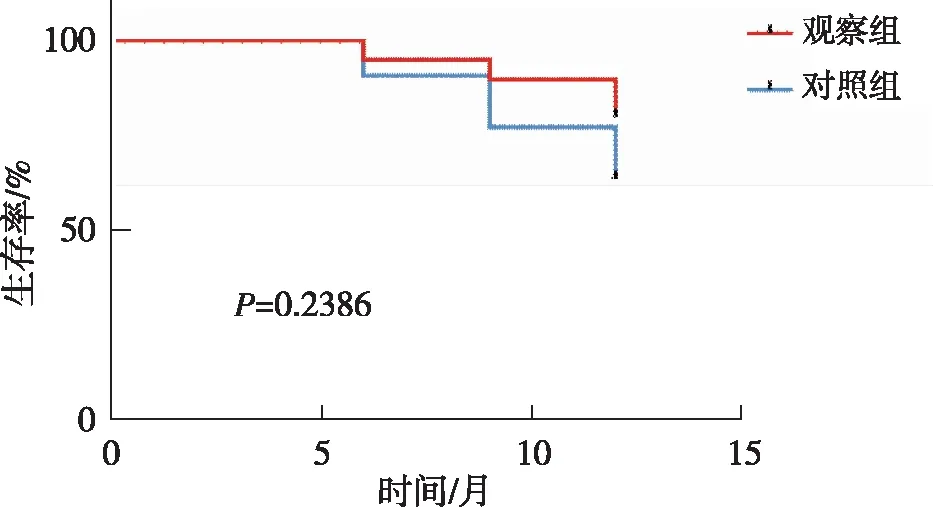
图3 两组患者生存率比较(Kaplan-Meier曲线)
3 讨论
骨骼是继肺和肝脏之后人体第三大癌症转移靶器官,几乎所有的恶性肿瘤都有骨转移风险[3-5],其发生率远高于原发恶性骨肿瘤。因骨转移癌导致的病理性骨折大大增加了患者的痛苦,严重降低了患者的生活质量,因此对转移病灶进行姑息性手术对改善患者症状,降低病理性骨折风险至关重要[6-8]。
Fan等[9]在2003年首次将微波消融技术应用于骨肿瘤的治疗并取得成功。随后Kinczewski等更多学者在此领域进行探索并证实了微波消融技术治疗骨肿瘤的效果[10-14]。本研究中我们发现,采用微波消融技术处理骨转移灶后再行刮除,多点烧灼过的肿瘤组织基本呈焦炭或“熟透”状态,肿瘤内部的肿瘤血管及血窦已被烧焦,刮除过程相较于对照组的直接刮除,出血明显减少,术野更加清晰,肿瘤刮除也更彻底。术后复发率观察组低于对照组,但因为样本量较少,差异无统计学意义(P>0.05)。其原因可能为:①减少了术中出血可以有效减少术野的污染范围,降低医源性肿瘤种植转移的发生率[15]。②微波消融技术可以在保留骨骼结构的前提下,有效杀灭皮质骨内病灶,其热能辐射范围广,对于杀灭残留的卫星病灶效果更佳[16]。进一步评估患者术前、术后的疼痛和患肢功能情况,结果显示,术后观察组疼痛缓解情况和患肢功能明显优于对照组,我们认为这与手术创伤小、术中对于肿瘤组织的灭活更加彻底并且保留了更多的正常的骨骼组织有关,这与Gennara,李运等[17-18]的观点一致。
目前已有部分学者提出了微波消融技术应用于骨转移癌治疗的理念[19],但微波消融造成术区周围正常组织尤其是重要血管神经的热损伤一直是困扰术者的难题。我们在术前完善相关影像学检查的同时,采用3D打印技术复原病灶组织及周围解剖,优化烧灼点及微波针穿刺路径的设计,尽可能保证肿瘤整体被烧灼的同时,避免过多损伤周围正常组织尤其是血管神经。术中对于烧灼点及周围正常组织温度进行控制也是可行且必要的[20]。我们在术中尽可能显露肿瘤,盐水纱布覆盖并牵开保护正常组织,烧灼过程中泼洒生理盐水控温,测温针不间断测温烧灼范围(保持80 ℃以上)及正常组织温度(保持40 ℃以下)。部分术野无法直接观察或不易接触到的肿瘤组织,在B超引导下避开血管神经,经皮穿刺至肿瘤组织进行烧灼。在本次研究中,观察组出现1例术后桡神经损伤,予营养神经等对症处理1月后患肢功能逐渐恢复。考虑为术中复位牵扯或骨水泥发热灼伤导致该患者桡神经损伤所致。但本研究样本较少,相关临床数据可能存在一定偏移,对于热损伤的原因有待进一步的探讨。
综上所述,术前通过3D打印精确设计手术入路,术中测温准确控制微波消融的热能辐射范围,结合肿瘤病灶刮除+骨水泥填塞内固定治疗四肢及骨盆骨转移癌是一种相对有效、安全的外科治疗方法。该手术方式能够有效缓解骨转移患者的疼痛,恢复患肢功能,提高患者生活质量。

