壳聚糖季铵盐/海藻酸钠纳米粒子对溶菌酶/NO的双重药物负载
孙 燕,柳 永,李伟东,费骥慧,陈兴江
(1.贵州省烟草科学研究院,贵州 贵阳 550001;2.杭州师范大学钱江学院,浙江 杭州 310036;3.浙江科技学院生物与化学工程学院,浙江 杭州 310023)
1 前 言
自然界中的细菌既可呈自由漂浮存在,亦可附着于某些表面形成生物膜[1]。不少抗菌剂虽能有效抑制自由漂浮的细菌,但不能很好地杀灭生物膜细菌[2-3]。细菌生物膜的本质是微生物在基体表面形成的群落,群落被胞外多糖包围,抗菌剂难以有效地穿透胞外多糖层的保护。杀灭生物膜中细菌所需抗菌剂的剂量,通常是消灭浮游细菌所需剂量的1000 倍[4-6]。更值得注意的是,许多医学上的细菌感染是由于细菌生物膜引起的,如手术植入、未愈合的伤口感染、糖尿病以及囊性纤维化等[1-2]。因此,迫切需要启动新的能够根除细菌生物膜的抗菌模式的研究和应用。
NO是二十世纪八十年代后期发现的气质性细胞信使分子,除参与多种生理反应外,在哺乳动物对病原体的免疫应答反应中也发挥着重要作用[7]。NO的抗菌活性是由于其反应性副产物如三氧化二氮和过氧化亚硝酸盐等所激发的亚硝化反应和氧化反应引起的,可最终导致细菌细胞膜的破裂[8]。目前,NO释放材料已经在病菌致灭领域出现了较广泛的研究,原因是NO不会导致耐药细菌产生。NO供体研究包括小分子亲核NO,如二乙胺和精胺亲核NO、大分子如壳聚糖亲核NO[9-10]和超支化大分子亲核NO等[11-12]。研究显示多数亲核NO供体的释放不可控,释放太快,缓释效果并不明显。溶菌酶(lysozyme,EC3.2.1.17)也是一种细菌难以产生耐受性的药物,它水解的部位是细菌细胞壁上的通用肽聚糖结构,形成细胞壁破损,导致细胞内溶物外渗死亡。溶菌酶(以鸡蛋白溶菌酶为例)等电点为10.8,在人体液pH值为7.4下带正电荷,可与酸性病毒因子,如病毒外壳蛋白和核酸等结合,达到失活病毒的效果。有机整合NO和溶菌酶的抗菌作用,有可能形成双重杀菌的高效杀菌剂。
本研究拟探索一种特异性抗菌的新途径-NO和溶菌酶协同修饰的复合纳米材料的制备改性,以获得便于识别致病菌并及时释放NO和溶菌酶的复合纳米材料。为达到缓释效果,研究选取两种天然存在、可生物降解并可生物医用的高分子材料,即N-(2-羟基)丙基-3-三甲基氯化铵壳聚糖(HTCC)和海藻酸钠(SA),作为载体材料。首先利用两种大分子之间的离子交联作用,制成负载溶菌酶的纳米粒子,然后将负载溶菌酶的纳米粒子与NO气体在高压下反应,最终制得协同负载溶菌酶和NO两种药物的纳米材料。选取HTCC是因为可以规避纯的壳聚糖的正电性与正常细胞表面存在丰富的静电络合作用,因为这种作用在体内和体外都不可控,最终会在一定程度上导致细胞的毒性效应[13]。另外,HTCC具备永久正电性和生理环境下的水溶性,而且这种壳聚糖衍生物的抗菌活性在制药学上有潜在的应用价值[14-15]。选择SA是由于其可以与带正电的多糖形成很好的离子交联作用,制备成粒径大小可控的纳米粒子,并且对水溶性药物的包封效果显著[16]。
2 实 验
2.1 材料与试剂
壳聚糖(CS,Mv=400 kDa,脱乙酰度≥90%),SA,溶菌酶(23500 U/mg),为生物纯。冰醋酸、异丙醇、硝酸银(AgNO3)、亚硝酸钠、无水甲醇、2,3-环氧丙基三甲基氯化铵(GTMAS)、磺胺和甲醇钠等均为分析纯。PBS缓冲溶液,化学纯。溶菌酶检测试剂盒、NO测定试剂盒(Griess试剂盒)、NO气体(纯度99.9%),均为国产试剂。大肠杆菌DH5α菌株,烟草青枯菌FSQ、生防菌枯草芽孢杆菌BS136菌株和解淀粉芽孢杆菌BaS菌株为贵州省烟草科学院保存菌种。
2.2 溶菌酶负载HTCC/SA复合纳米粒子的制备及表征方法
2.2.1HTCC的制备 参照文献[17]的方法,合成HTCC:在150 mL三颈烧瓶中加入CS 4.0;GTMAC 3.6 g和60 mL蒸馏水。80 ℃下回流,恒温搅拌(400 r/min,7 h)。反应结束,将产物装入截留分子量14 kDa的透析袋中,于蒸馏水中透析,至透析液经AgNO3(0.1 mol/L)检测无白色沉淀时止。旋转蒸发浓缩后烘干得到粉末状HTCC。
2.2.2负载溶菌酶的HTCC/SA复合纳米粒子的制备 (1)将所制得的HTCC溶于蒸馏水中,配成1 mg/mL的HTCC溶液。
(2)将1 mg/mL的SA水溶液与1 mg/mL的溶菌酶水溶液按不同体积比混合,不断搅拌至有微弱蓝色荧光出现并稳定存在,即得到SA/溶菌酶复合纳米粒子溶液;取上述SA/溶菌酶复合纳米粒子溶液,滴于1 mg/mL的HTCC溶液中,并不断磁力搅拌,至有蓝色荧光出现并稳定存在(记为A纳米溶液)。
(3)将A纳米溶液低温高速(4 ℃,20000 g)离心,去掉上清液,沉淀冷冻干燥,得到干燥的负载溶菌酶的HTCC/SA复合纳米粒子。
2.2.3测定溶菌酶的载药量和包封率 依照溶菌酶检测试剂盒说明书进行 ①试剂配制:取菌粉1支,在匀浆管中,与1 mL菌粉溶剂轻缓研磨3 min,即得贮备菌液;将贮备菌液以菌粉溶剂稀释20倍即得应用菌液;取2 mg标准品分散于1 mL蒸馏水中,混匀得到2 mg/mL的标准品贮备液,再取适量的标准品贮备液,用蒸馏水稀释成不同浓度。将应用菌液及各种浓度的溶菌酶标准液置于0 ℃的冰水中预冷5 min以上。
②测定标准液的透光度,按表1进行操作。

表1 溶菌酶标准溶液的测试配方
37 ℃准确水浴15 min,立即取出置于0 ℃冰水浴中3 min,逐管于530 nm处,以蒸馏水为100%透光度,测各管透光度。
③按上述方法测定第2.2.2节(3)中上清液的透光度,根据标准曲线换算成游离溶菌酶的浓度。
④按式(1)、(2)计算包封率和载药量,求3次求平均值:
包封率=(溶菌酶的总浓度-游离溶菌酶的浓度)/溶菌酶的总浓度×100%
(1)
载药量=包封率×溶菌酶总质量/纳米粒子的质量×100%
(2)
2.3 负载溶菌酶的HTCC/SA复合纳米粒子接枝NO的制备
取少量负载溶菌酶的HTCC/SA复合纳米粒子加入到甲醇钠与无水甲醇(50 mL)溶液中,要求[Na+]/[NH]的物质的量之比等于3。高压反应釜先用N2鼓泡30 min,然后抽真空。接着再通NO,维持压力0.6 MPa,室温下搅拌反应4 d。反应完成后,通N2鼓泡30 min。过滤釜中产物,以无水甲醇洗涤3 次后,于室温下真空干燥12 h,转移至真空干燥器中-20 ℃下储存备用。
2.4 负载溶菌酶的HTCC/SA复合纳米粒子的透射电镜(TEM)观测
采用悬滴法于喷涂超薄碳膜的铜网上制备透射电子显微镜观测样本,以2%磷坞酸溶液染色,并于室温下自然风干。使用型号为A JEM-2010 JEOL的TEM对干态纳米粒子的形貌、结构与尺寸大小进行观测。
2.5 溶菌酶/NO协同负载HTCC/SA复合纳米粒子的红外光谱(FTIR)分析
对负载NO前后的复合纳米粒子样品进行红外光谱表征。采用KBr压片法光谱扫描样本:取少量干燥复合纳米粒子粉末于玛瑙研钵中,加入干燥的KBr粉末在红外灯下充分研磨混合,压片并进行红外分析。红外光谱的扫描精度为4 cm-1,扫描次数为32 次,扫描范围为4000~400 cm-1。
2.6 溶菌酶/NO协同负载HTCC/SA复合纳米粒子的差示扫描量热(DSC)分析
HTCC/SA复合纳米粒子的DSC测试:首先将温度从室温升到100 ℃,保持5 min;然后降低到-20 ℃,同样保持5 min;再次从-20 ℃即热到290 ℃,保持5 min,最后降回到25 ℃。升降温速率均设为10 ℃/min。溶菌酶/NO协同负载HTCC/SA复合的米粒子的DSC测试:除不做升到100 ℃并保持5 min步骤外,其余操作同HTCC/SA复合纳米粒子的DSC测试。
2.7 溶菌酶和NO的体外释放
取10 mg协同负载溶菌酶/NO的HTCC/SA复合纳米粒子样品干粉于透析袋中,加入PBS缓冲液5 mL,放入盛有35 mL PBS缓冲液的密闭玻璃瓶中,在37 ℃的水浴下磁力搅拌释放。每隔一定时间取样2 mL,同时补充PBS缓冲溶液2 mL。
取出的1 mL样品液用第2.2.3节中的测定透光度的方法来计算溶菌酶的释放量。
用PBS缓冲溶液配制0~25 nmol的亚硝酸钠标准溶液制备标准曲线。
取出的1 mL样品液依次与GriessⅠ(1 mL)和GriessⅡ(1 mL)混合,在闭光的条件下,稳定15 min后会观察到紫色或紫红色出现,此时NO已反应生成亚硝酸盐,然后用紫外-可见分光光度计(UV-Vis)测定其540 nm处的吸光度,通过标准曲线测定NO释放浓度。
2.8 复合纳米粒子的体外抗菌效果分析
以革兰氏阴性菌大肠杆菌DH5α菌株,烟草青枯菌FSQ菌株,革兰氏阳性菌生防菌枯草芽孢杆菌BS136和解淀粉芽孢杆菌BaS菌株为实验菌株。于超净工作台中,在直径90 mm的培养皿中倒入约20 mL溶化的固体营养琼脂培养基(蛋白胨 10.0 g/L,牛肉浸膏3.0 g/L,氯化钠5.0 g/L,琼脂粉15.0 g/L,pH值为7.3 ± 0.1,121 ℃高压灭菌15 min),静置冷却固化。向固化培养基上加入0.2 mL试验菌株悬液(菌液浓度为OD600=0.1),并将菌液均匀涂布于培养基表面,保持培养皿盖敞开状态下于超净工作台中吹干至表面无流动液体。最后在培养基上等距离取5个点,各放置直径5 mm无菌滤纸圆片1 片,并在滤纸片上分别加入以下测试样品溶液10 μL:(a)HTCC∶SA=15∶5、(b)HTCC∶SA∶Lys=15∶5∶1(NO接枝)、(c)HTCC∶SA∶Lys=15∶5∶3(NO接枝)、(d)HTCC∶SA∶Lys=15∶5∶5(NO接枝)和(e)浓度与(d)相同的溶菌酶水溶液。将培养皿置于生化培养箱中于30 ℃下倒置培养24 h,然后观察记录透明圈有无与大小。
3 结果与讨论
3.1 复合纳米粒子的FTIR分析
图1是溶菌酶/NO双重载药复合纳米粒子的红外谱图。图中曲线a可见CS在1596 cm-1处有一个伯胺N-H的特征峰,而此峰在HTCC的红外谱图(曲线b)中消失,取而代之的是HTCC在1536 cm-1处出现了仲胺的特征峰。同时HTCC在1483 cm-1处出现了一个新的峰,这是季胺基团的甲基上的C-H反对称弯曲振动,反映出CS的2位NH2上发生了反应,生成了仲胺键,表明季铵盐改性壳聚糖成功,制得了HTCC。
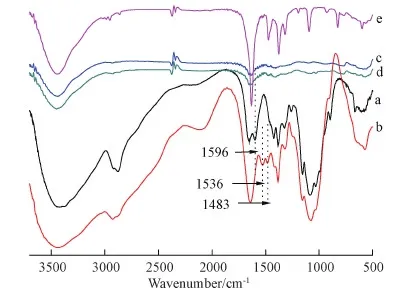
图1 复合纳米粒子的红外光谱图
同时,SA在与HTCC复合后,HTCC与SA之间强的静电作用导致HTCC在3440 cm-1处的羧基和氨基的伸缩振动峰向高波数移动并变窄,表明静电作用消弱了HTCC中的分子内氢键作用;经过包埋溶菌酶后这个峰又重新变宽;溶菌酶在1530 cm-1处仲酰胺的C-N伸缩振动峰消失,在1624 cm-1处的羧基的不对称伸缩振动向高波数移动,这表明溶菌酶是发生化学作用包埋在了HTCC/SA复合纳米粒子中。而经过NO修饰后的溶菌酶负载复合纳米粒子红外谱图在1376和1319 cm-1处为N-N=O基团的N=O伸缩振动。
3.2 复合纳米粒子中溶菌酶的包封率和载药量
当HTCC∶SA∶Lys的质量比=15∶5∶1时,纳米粒子的包封率和载药量分别为52.90%和6.80%;当HTCC∶SA∶Lys=15∶5∶3时,包封率和载药量分别为84.20%和27.81%;当HTCC∶SA∶Lys=15∶5∶5时,包封率和载药量分别为92.10%和46.20%。图2结果显示,随着溶菌酶用量的增多,溶菌酶与SA之间的离子交联作用加大,所以包封率和载药量均逐渐增大。

图2 复合纳米粒子中溶菌酶的载药量和包封率
3.3 复合纳米粒子的TEM分析
图3为HTCC/SA负载溶菌酶的复合纳米粒子的TEM照片。从图3(a)可见HTCC与SA进行离子复合形成的纳米粒子尺寸较小,大约在40~200 nm左右,且形成的纳米粒子结构较致密,说明HTCC与SA之间的离子交联作用较充分。当HTCC∶SA∶Lys=15∶5∶1时(图3(b)),可以清晰地看到形成的纳米粒子尺寸变大,大部分都在300 nm左右,这说明溶菌酶与SA的离子交联作用出现的同时,削弱了SA与HTCC之间的离子交联作用,导致HTCC和SA通过离子交联作用形成的纳米粒子变得较松散,所以纳米粒子尺寸明显增加。随溶菌酶浓度进一步增加,当HTCC∶SA∶Lys=15∶5∶3时(图3(c)),形成的纳米粒子尺寸进一步增加到400~500 nm左右;当HTCC∶SA∶Lys=15∶5∶5时(图3(d)),由于溶菌酶与SA的离子交联作用较显著,直接导致SA与HTCC之间的作用进一步削弱,在TEM照片中甚至找不到形状较规整的纳米粒子。
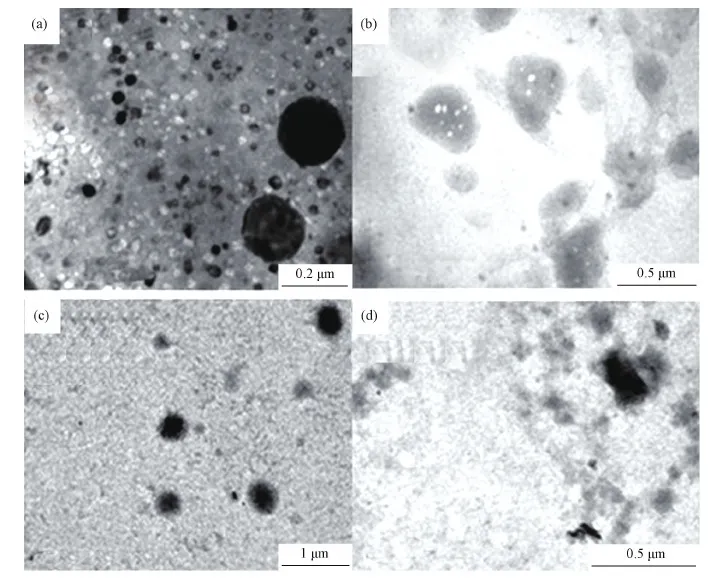
图3 不同复合纳米粒子的TEM照片
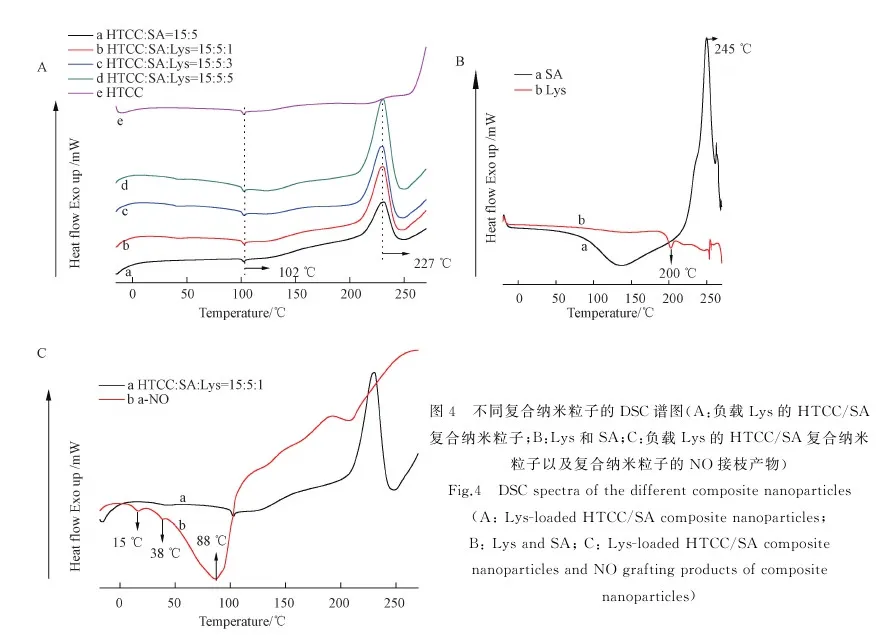
3.4 复合纳米粒子的DSC分析
从图4A可见,负载Lys的HTCC/SA复合纳米粒子系列产物都出现了HTCC的玻璃化转变温度(102 ℃),同时在227 ℃都出现了放热峰,可能是因为SA发生氧化反应导致,且与纯的SA相比,此氧化反应温度提前,峰形宽而矮,这可能是由于SA物理交联所致。另一方面,Lys在200 ℃出现熔融吸热峰(图4B),此峰在载药纳米粒子中消失,说明Lys很好地包裹进HTCC和SA组成的载药系统中,且Lys在纳米粒子中是以化学包埋的方式存在的,发生了化学键合作用。从图4C结果看,负载Lys的HTCC/SA复合纳米粒子进行NO接枝后,其DSC曲线与单纯的负载Lys的HTCC/SA复合纳米粒子有明显的不同。接枝NO后的样品(图4C-b)在15 ℃和38 ℃左右分别出现一个较弱的吸热峰;从50 到100 ℃还有一个是较强的吸热峰。上述三个吸热峰可能是纳米粒子和NO分子之间的键解离作用导致的。
3.5 复合纳米粒子的Lys体外释放性能研究
选择pH=7.4的PBS缓冲溶液作为释放介质,从释放曲线图5可以看出,首先出现一个Lys的突释,释放量达到了12%~15%左右。图5c显示Lys的最大突释率为14.72%,之后连续缓慢释放,60 h后达到23.50%。Lys的突释是由于纳米粒子表面吸附的Lys快速从纳米粒子表面解吸造成的。接下来的几十个小时释放缓慢,这主要是由于Lys的释放需要一个较复杂的过程,首先是介质中的水分子通过纳米粒子表面的空隙扩散渗透到纳米粒子内部,从而使得纳米粒子在缓冲液中出现溶胀,然后纳米粒子孔隙尺寸随之变大,进而药物分子才能有效扩散出来。纳米粒子的这种特点有助于实现对药物的控制释放,从而达到缓慢恒速释放。
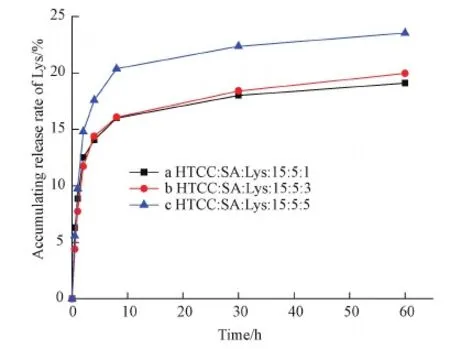
图5 复合纳米粒子的Lys的体外释放曲线图
3.6 复合纳米粒子中NO的体外释放性能研究
选择pH=7.4的PBS缓冲溶液作为释放介质,进行NO体外释放研究(图6)。从图可见,纳米粒子系列产物的NO释放性能相似,释放最大总量接近,集中在90~110 nmol/mg,其中NO的最大释放总量为108.10 nmol/mg(图6a)。另外要说明的是溶菌酶的载药量和包封率对NO的释放没有明显交互影响。
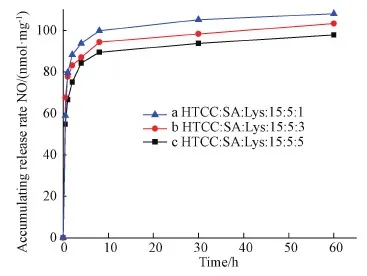
图6 复合纳米粒子中NO的体外释放曲线图
3.7 复合纳米粒子体外抗菌性能研究
从图7可以看出溶菌酶/NO双重载药复合纳米材料,虽然在大肠杆菌DH5α的培养中,其抑菌圈不明显,但是复合纳米材料对另外三种菌株:青枯菌FSQ菌株、枯草杆菌BS136菌株和解淀粉芽孢杆菌BaS菌株均具有较好的抑菌活性。尤其对青枯菌FSQ的抑菌活性表现出明显的溶菌酶浓度正相关性,如图7中的d和e所示,这两个不同样品处理中溶菌酶浓度是相当的,但抑菌圈差异显著,这反映出溶菌酶、NO修饰与HTCC在抑制青枯菌FSQ菌株上具有一定的协同增效作用。

图7 溶菌酶/NO协同负载HTCC/SA复合纳米粒子的抗菌图(a)HTCC∶SA=15∶5;(b)HTCC∶SA∶Lys=15∶5∶1(NO接枝);(c)HTCC∶SA∶Lys=15∶5∶3(NO接枝);(d)HTCC∶SA∶Lys=15∶5∶5(NO接枝);(e)与(d)浓度相等的Lys水溶液
4 结 论
本研究以HTCC/SA复合纳米粒子作为药物载体,先包埋溶菌酶,再接枝NO,研究了不同复合纳米粒子的载药量和包封率,对纳米粒子进行了表征,并测定了溶菌酶和NO的体外释放性能。研究结果表明:
1.复合纳米粒子成功负载了溶菌酶。随着溶菌酶用量的增多,包封率和载药量逐渐增大。当HTCC∶SA∶Lys=15∶5∶5时,包封率和载药量分别达到最大值,为92.10%和46.20%。
2.HTCC存在NH仲胺基团,能够负载NO可以形成N-N=O结构。
3.溶菌酶的最大释放百分率为23.50%,NO的最大释放总量为108.10 nmol/mg。
4.复合纳米粒子对青枯菌FSQ菌株、枯草芽孢杆菌BS136菌株、解淀粉芽孢杆菌BaS菌株均具有较好的抑制效果。

