磷酸铁锂/石墨烯复合材料的制备及锂回收应用
方雨虹 ,方明,刘海刚,唐宏学,郭会宾,晋冠平
(1.合肥工业大学化学与化工学院,安徽省可控化学与材料化工重点实验室,安徽 合肥 230009; 2.青海甘河化工设计研究有限公司,青海 西宁 810000)
锂被认为是21世纪的能源金属,长期以来被认为是一种有前景的可再生能源材料[1]。近年来,锂离子电池有了巨大的技术进步和大规模应用,在储能设备、电动汽车、制药行业等许多领域发挥着越来越重要的作用[2]。众所周知,锂主要有2种获取方式:固态锂矿和液态锂资源,包括锂辉石、橄榄石、盐湖卤水、地下卤水和海水。据报道,超过60%的锂储量是在卤水中发现的,尤其是在美国和中国[3]。
卤水虽然含有丰富的锂资源,但也有较高的镁含量,这导致了卤水提锂有一系列的技术和成本问题[4]。吸附法是一种低成本、环境友好且应用最广的方法。传统的LiCO2和LiMnO4锂离子筛吸附剂在酸性 条件下会溶解,导致循环性能下降[5]。1997年,Padhi和Goodenough[6]发现了一种磷酸盐的正极材料——磷酸铁锂(简称LFP),它具有橄榄石和空间中略微扭曲的六边形紧凑堆积结构[7],由FeO6八面体和PO4四面体组成空间骨架,Fe2+和Li+填充八面体间隙[8],其中Li+具有流动性,可在充放电过程中可逆地脱嵌。同时LFP作为锂离子电池正极材料,在水溶液中具有良好的化学稳定性和循环性能。
与传统的锰系离子筛吸附剂相比,LFP具有原料来源广泛、价格低廉、热稳定性好、环境友好等优点[9]。虽然LFP材料存在电子导电性差、扩散系数小等缺点[10],但随着学者们对LFP性能改进的深入研究,LFP的大速率放电容量得到了显著提高。许多商用磷酸铁锂电池已广泛应用于航空航天、电动汽车、太阳能储能设备、小型医疗设备和便携式仪器等领域[11]。
本文采用溶胶-凝胶法制备的LFP作为吸附剂,通过滴涂法将混合均匀的LFP、胺基化石墨烯(GNs)和粘结剂聚偏氟乙烯(PVDF)滴涂于钛网上,制成工作电极,以电化学的方法从盐湖卤水中提取Li+。
1 实验
1.1 试剂
七水合硫酸亚铁(FeSO4·7H2O)、磷酸二氢铵(NH4H2PO4)、乙酸锂(CH3COOLi)、抗坏血酸、30%过氧化氢(H2O2)、1-甲基-2-吡咯烷酮(NMP)、N,N-二环己基碳二亚胺(DCC)、N,N-二甲基甲酰胺(DMF)和乙二胺(EDA),均为分析纯。钛网(100目)的直径为(1.0 ± 0.5) cm。
1.2 LFP/GNs复合材料的制备
1.2.1 溶胶-凝胶法制备磷酸铁锂(LFP)
0.5 mol/L七水合硫酸亚铁和0.5 mol/L磷酸二氢铵在50 mL的去离子水中溶解,用氨水调节pH至4左右,在充分搅拌下缓慢滴加30% H2O2至溶液呈淡黄色,继续搅拌1 h,得到前驱体a。将2.55 g CH3COOLi、25%抗坏血酸和前驱体a溶解在150 mL的无水乙醇中,60 °C充分搅拌,直到乙醇溶液挥发完。样品干燥后放入管式炉中煅烧,在N2气氛下以5 °C/min的速率升温,400 °C下保温3 h,750 °C下保温10 h,得到产品LFP。
1.2.2 胺基化石墨烯(GNs)的制备
称取一定量干燥的氧化石墨烯(GO)[12]分散于DMF中,超声一定时间,得到GO分散液。然后将分散液倒入圆底烧瓶中,加入一定量DCC,室温搅拌活化一段时间。待活化反应结束后,滴加300 μL EDA,升温至90 °C,继续搅拌24 h。反应结束后过滤,并用DMF淋洗滤饼多次,最终制得GNs,干燥后待用。
1.2.3 滴涂法制备LFP/GNs/Ti电极
将制备好的LFP、GNs和PVDF按质量比80∶10∶10混合,加到NMP中混合成浆料,超声混匀成悬浮液,使用移液枪每次移取50 μL滴涂在钛网上,自然风干后再次滴涂,一共重复10次,最后一次放入烘箱中,85 °C烘干10 h待用。
1.3 电化学制备锂离子印记LFP/GNs/Ti电极
采用三电极体系,以LFP/GNs/Ti为工作电极,铂片(Pt)为对电极,饱和甘汞电极(SCE)为参比电极,在电解池中加入30 mL 0.5 mol/L NH4Cl溶液,在-0.8 V至0.8 V的电位范围内循环伏安300圈,扫速为50 mV/s。电极上的LiFePO4发生氧化后可将Li+脱附下来,形成具有锂离子印记的FePO4。反应结束后,在50 °C下真空干燥5 h,即得到具有锂离子印记的LFP/GNs/Ti电极。脱Li+时发生的反应[6]见式(I)。

1.4 电化学吸附水溶液中的Li+
采用与1.3节相似的三电极体系,以上述制备的锂离子印记LFP/GNs/Ti电极为工作电极。分别研究在不同电位(-0.5 ~ 0.2 V)、pH和浸泡时间的情况下Li+的吸附量。LFP/GNs/Ti上发生的反应如式(II)所示。

平衡吸附量(qe)由式(1)计算[13]。

式中ρ0、ρs分别为溶液中Li+的起始和最终浓度(单位:mg/L),V为溶液体积(L),m为吸附剂的干重(g)。
采用准一阶模型[式(2)]和准二阶模型[式(3)]描述LFP/GNs/Ti吸附Li+的动力学行为[14]。

式中qt为任意时刻Li+的吸附量(单位:mg/g),t为吸附时间(单位:min),k1(单位:h-1)和k2[单位:g/(mg·h)]为吸附速率常数。
1.5 电化学脱附锂
采用三电极体系,以含锂的LFP/GNs/Ti电极[记为LFP/GNs/Ti(Li+)]为工作电极。在30 mL的0.5 mol/L NH4Cl溶液(以盐酸调节其pH至4)中,通过循环伏安法来脱附Li+。操作步骤与1.3节相似,考察扫描圈数对Li+脱附的影响,通过原子吸收分光光度计测定溶液中Li+的浓度。根据循环伏安曲线能否归位来评估Li+脱附效果。Li+的脱附率(R)由式(4)计算[11]。

式中w0为脱附前工作电极中Li+的质量分数(即吸附量),wd为脱附的Li+在工作电极材料中的质量分数。
1.6 表征方法
采用荷兰帕纳科有限公司生产的X’Pert PRO MPD型X射线衍射仪(XRD)表征晶型。
采用日本日立公司生产的SU8020型场发射扫描电子显微镜(FE-SEM)表征材料形貌。
采用美国Perkin Elmer公司生产的AA800型原子吸收分光光度计测定Li+的浓度。
2 结果与讨论
2.1 电化学分析
如图1所示,在-0.484 V和-0.307 V附近存在一对氧化还原峰[15],说明在水溶液中的Li+能够在LFP材料中可逆地嵌入、脱出。

图1 LFP/GNs/Ti电极在0.1 mol/L LiCl溶液中的循环伏安曲线(扫速50 mV/s) Figure 1 Cyclic voltammogram of LFP/GNs/Ti electrode in 0.1 mol/L LiCl solutions at a scan rate of 50 mV/s
2.2 XRD分析
由图2中的谱线可以看出,LFP/GNs/Ti电极材料的所有衍射峰均符合LFP的标准图样(JCPDS No.40-1399),LFP主要沿着(210)、(111)、(211)、(301)等晶面生长,且晶体衍射峰尖锐,无明显杂质峰;而在吸附Li+后,LFP依旧保持尖锐的峰形。利用式(5)(即谢乐公式)计算出LFP晶粒的平均粒径(Dc)为18.45 nm左右。

图2 LFP/GNs/Ti电极吸附Li+前后的XRD谱图 Figure 2 XRD patterns of LFP/GNs/Ti electrode before and after adsorption of Li+

式中0.89为Scherrer常数,λ为X射线衍射波长(0.154 nm),β为衍射峰半高宽,θ为衍射角。
2.3 FE-SEM分析
从图3a可以看出,吸附前LFP被GNs纳米片均匀包裹连接,且LFP是准球形颗粒。图3b展示的是吸附后的LFP电极,其表面光滑,具有比表面积大的优点。大部分石墨烯纳米片环绕在LFP颗粒上,部分石墨烯纳米片分散嵌在LFP颗粒中。
2.4 LFP/GNs/Ti电化学辅助吸附与脱附行为
2.4.1 pH对吸附效果的影响
pH主要从两个方面影响材料的吸附效果:一是材料本身对酸碱的耐受度,二是吸附剂的存在形态。由图4可以看到,pH从3.0升到6.0的过程中,Li+的吸附量逐渐增大;而在pH 6.0以后,Li+吸附量开始下降。在酸性条件下,LFP会溶解成简单离子,以Fe2+和Fe3+的形式存在[16-17];在碱性条件下,LFP会分解为Fe(OH)3固相和Li3PO4固相,不利于电子的传递。因此,弱酸性环境更利于Li+的吸附。
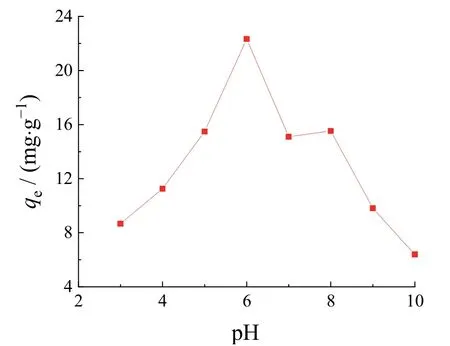
图4 -0.2 V下pH对LFP/GNs/Ti电极Li+吸附容量的影响(Li+起始浓度75 mg/L,温度25 °C) Figure 4 Effect of pH on adsorption capacity of Li+ on LFP/GNs/Ti in a solution containing 75 mg/L Li+ initially at 25 °C and -0.2 V
2.4.2 电位对吸附效果的影响
从图5a可知,在pH = 6的75 mg/L Li+溶液(30 mL)中,-0.5 V至-0.3 V内的吸附量随着电位的正移而增加,在-0.3 V后缓慢下降,这是因为电位达到-0.3 V后FePO4中的Fe3+被还原为Fe2+。由于体系中存在Li+,在库仑力的作用下,Li+作为平衡离子嵌入FePO4晶格而形成LiFePO4[18]。于是研究了-0.3 V下LFP/GNs/Ti电极对Li+吸附量随时间的变化(见图5b),结果发现在360 min时已经接近最大值,此时吸附容量为30.1 mg/g。

图5 LFP/GNs/Ti电极在不同电位下对Li+的平衡吸附量(a)以及在-0.3 V下不同时间的Li+吸附量(b) Figure 5 Equilibrium adsorption capacity of Li+ on LFP/GNs/Ti electrode at different potentials (a) and the adsorption capacity of Li+ at -0.3 V for different time (b)
图6a和6b分别为LFP/GNs/Ti电极在电化学辅助吸附Li+过程中的准一阶和准二阶动力学拟合结果。由表1可知:准二阶动力学模型的决定系数(R2)大于准一阶动力学的决定系数,所以LFP/GNs/Ti电极吸附Li+的动力学过程更符合准二阶动力学模型,同时说明LFP/GNs/Ti电极吸附Li+是化学吸附过程。

表1 在25 °C、pH 6和-0.3 V的条件下LFP/GNs/Ti电极吸附Li+的准一阶和准二阶动力学模型参数 Table 1 Parameters of pseudo-first order and pseudo-second order models for adsorption of Li+ on LFP/GNs/Ti electrode at 25 °C, pH 6, and -0.3 V
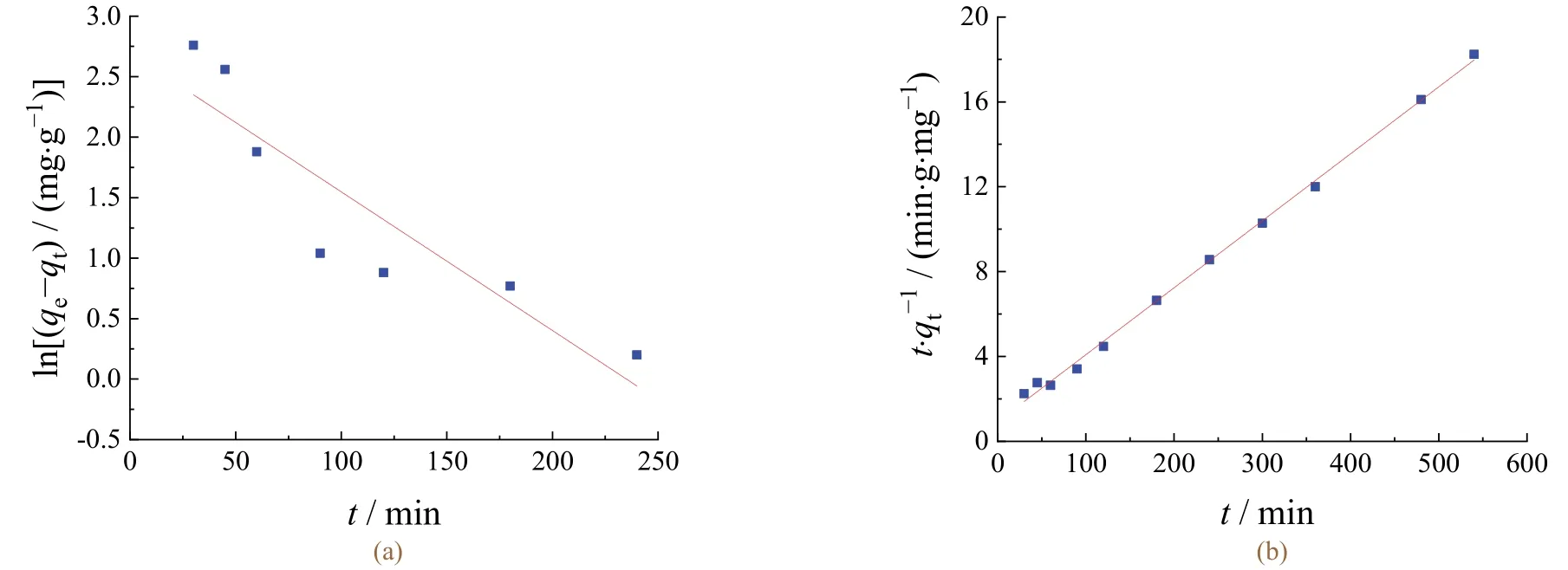
图6 在-0.3 V下LFP/GNs/Ti电极吸附Li+的准一阶(a)和准二阶(b)动力学拟合曲线 Figure 6 Fitted pseudo-first order (a) and pseudo-second order (b) kinetic curves for the adsorption of Li+ on LFP/GNs/Ti electrode
2.4.3 其他离子的影响
在200 mg/L的Li+溶液中研究了Na+、K+、Mg2+、Ca2+等离子对Li+回收率的影响。在最佳条件(pH 6,-0.3 V)下,将LFP/GNs/Ti电极置于的分别含有Na+、K+、Mg2+和Ca2+的二元混合物(其他离子与Li+的质量浓度比为1∶1)水溶液(35 mL)中,吸附相同的时间,结果Li+在含Na+、K+、Mg2+和Ca2+溶液中的吸附量分别为25.25、44.74、48.85和50.67 mg/g。由于LFP晶格结构狭窄,因此电极对一价阳离子的选择性与水合阳离子的大小有关,顺序为:Li+> Ca2+> Mg2+> K+> Na+[19]。Na+的离子半径为0.102 nm[20],与Li+的离子半径(0.076 nm)最相近,因此Na+在溶液中会干扰LFP/GNs/Ti电极吸附Li+。
2.4.4 解吸行为
NH+4因尺寸和Li+相当,可应用于Li+的脱附实验。 NH+4通过与LFP/GNs/Ti电极上的Li+进行离子交换而实现脱附Li+的过程。由图7可以看到,在30 mL的0.5 mol/L NH4Cl溶液(pH 4)中,LFP/GNs/Ti(Li+)循环伏安扫描300圈内-0.42 V和0.45 V左右的电流峰由高逐渐变低,最后与未吸附Li+时的伏安曲线(即曲线e)基本重合。当循环伏安扫描达到300圈时,Li+的脱附量为27 mg/g,相当于吸附量的90%。
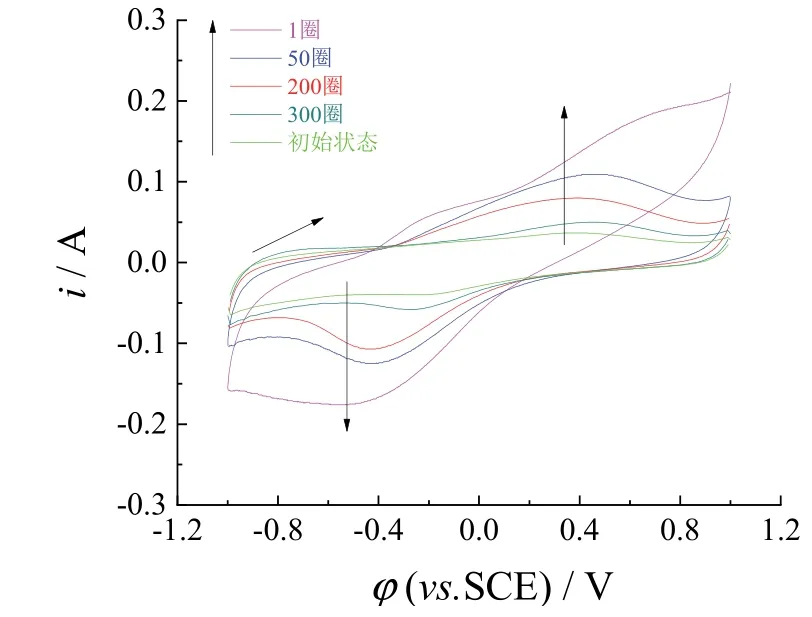
图7 吸附了Li+的LFP/GNs/Ti电极在0.5 mol/L NH4Cl溶液的循环伏安曲线(扫速30 mV/s) Figure 7 Cyclic voltammograms of Li+-bearing LFP/GNs/Ti electrode in 0.5 mol/L NH4Cl at a scan rate of 30 mV/s
电去离子解吸过程中,Li+从LFP中释放出来,按式(II)发生结构转换,同时 4NH+由于尺寸匹配和浓度较高,会占据LFP的晶格,防止Li+再次进入。
上述实验结果表明:采用电辅助吸附-脱附法回收水溶液中Li+是可行的。
2.4.5 卤水锂的吸附应用
采用所得到的LFP/GNs/Ti电极,将电化学辅助技术应用于盐湖卤水中Li+的回收。将LFP/GNs/Ti电极(0.020 1 g)置于35 mL的卤水中,施加-0.3 V用于吸收Li+,时间6 h;然后将电极置于30 mL的0.5 mol/L NH4Cl溶液(以盐酸调节pH至4)中,采用循环伏安法在-0.8 V至0.8 V的电位范围内以30 mV/s扫描300圈进行脱附,脱附率可达90%。
3 结论
(1) 采用滴涂法制备了LFP/GNs/Ti复合电极,通过XRD、FE-SEM对其形貌和微观结构进行表征,发现LFP呈纳米球状颗粒,平均粒径约20 nm,大部分石墨烯纳米片环绕在LFP颗粒上,部分石墨烯纳米片分散嵌在LFP颗粒中。
(2) 采用电化学辅助吸附-脱附法,以LFP/GNs/Ti为工作电极,考察了pH、电位、时间等因素对水溶液中Li+分离的影响。恒电位静态吸附过程中,LFP/GNs/Ti电极对Li+的吸附符合准二阶动力学模型,说明吸附Li+的速率控制步骤是化学吸附过程。
(3) LFP/GNs/Ti电极在最佳条件(pH 6,电位-0.3 V,时间6 h)下处理75 mg/L的LiCl溶液,吸附量可达30.1 mg/g。在循环伏安脱附实验中,以pH为4的0.5 mol/L NH4Cl溶液进行脱附,0.8 V至-0.8 V之间扫描300圈,Li+的脱附率可达90%,同步实现了电极的再生。该工艺可应用于卤水中Li+的提取。

