荧光PCR熔解曲线技术在结核病耐药诊断中的应用价值
王 悦 孟湃喆 于艳红▲
1.沈阳市第十人民医院结核病实验室,辽宁沈阳 110044;2.沈阳市医学院医学检验技术专业,辽宁沈阳 110034
结核病(tuberculosis,TB)位居全球单一致死性传染病的首位,每年约有50 万利福平耐药病例,其中78%为耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)[1]。我国是全球耐药结核病负担最大的三个国家之一[2-3]。由于传统的药敏试验方法费时、繁琐,无法满足快速临床诊断的要求[4-5],许多快捷高效的分子技术已更多应用于TB 检测,包括荧光PCR熔解曲线法、线性探针耐药检测法或DNA 微阵列等。荧光PCR熔解曲线技术特点是在扩增完成后增加了熔解曲线的分析过程,比较样本与阳性对照间熔点差异(△Tm值)。该技术对rpoB基因与利福平耐药相关81bp 进行突变检测;对与异烟肼耐药相关的ahpC启动子、inhA94 密码子、inhA启动子以及katG315 密码子的相关位点进行特异检测。
1 材料与方法
1.1 材料
1.1.1 研究对象 回顾性分析2019年7月—2020年7月沈阳市第十人民医院收取的254 例痰样本检验结果,三项检测为同一患者的同一样本,排除标准为治疗超过2 周的患者。以MGIT 960 药敏试验为参考标准,探讨熔解曲线技术在结核病耐药诊断中的应用价值,并采用线性探针耐药检测技术对不一致结果进行复检。本研究经过沈阳市第十人民医院医学伦理委员会审核批准。
1.1.2 主要仪器及试剂 Bio-Rad CFX96 实时荧光PCR 扩增仪(Bio-Rad Laboratories);Lab-Aid 824 核酸提取仪、结核分枝杆菌利福平/异烟肼耐药突变检测试剂盒(厦门致善生物科技股份有限公司);MGIT 960 全自动结核分枝杆菌快速培养法仪及配套试剂(Becton,Dickinson and Company);全自动核酸印记微生物检测系统(GTGBlot 48)及配套试剂(法国生物梅里埃股份有限公司)。
1.2 方法
收集254 例痰样本检验结果,熔解曲线法与MGIT 960 药敏试验不一致的结果应用世卫组织推荐的线性探针耐药检测法进行复检,三种方法如下。
MGIT960 药敏试验:痰标本前处理按照《结核病诊断实验室检验规程》[6]规定进行,完成接种后,进行培养,仪器报阳后对培养物进行抗酸染色镜检确认,阳性者进入药敏试验。
熔解曲线法前处理:取培养法前处理液化完成的痰液1.5 mL,高速离心后弃上清并加入TB DNA 提取液重悬沉淀,灭活后进行核酸提取、配液、扩增等工作流程。检验结果是通过四个通道的样品与阳性对照之间熔解曲线熔点(Tm)的差异判断样品是否发生突变,熔点均一致(误差不超过1℃)时判定为野生型(敏感);四个通道中任意通道中样品的熔点低于阳性对照2℃判定为突变型(耐药)。
线性探针耐药检测法:标本处理按照法国生物梅里埃的试剂盒说明书进行,包括DNA 提取、扩增、杂交、制备流程。判读标准为野生条带均显色且突变条带无显色时为敏感,野生条带有缺失或突变条带显色为耐药。
1.3 统计学方法
所有检测结果、患者基本信息采用SPSS 19.0 统计软件进行统计分析。以MGIT 960 药敏试验结果为参考标准,计算熔解曲线法检测的敏感性、特异性、一致性、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)和Kappa值以及对MDR-TB 结果的判定能力。敏感度=真阳性例数/(真阳性+假阴性)例数×100%;特异度=真阴性例数/(真阴性+假阳性)例数×100%;PPV=真阳性例数/(真阳性+假阳性)例数×100%;NPV=真阴性例数/(真阴性+假阴性)例数×100%;一致性=(真阳性+真阴性)/(真阳性+假阳性+真阴性+假阴性)例数×100%;Kappa值≥0.75 表示两者一致性较好;0.4≤Kappa<0.75 表示两者一致性一般;Kappa<0.4 表示两者一致性较差。
2 结果
2.1 基本情况
收集的254 例患者信息显示,初治患者166 人(65.4%);年龄18~88 岁,平均(52±14.6)岁;41~60年龄段人数为123 人(48.4%),男性199 人(78.3%)。
2.2 药敏结果
在利福平药敏试验结果中,熔解曲线法的敏感性、特异性分别为89.6%、95.6%,Kappa值≥0.75,与参考标准一致性较好;两种检测技术共有14 例不一致。在异烟肼药敏试验结果中,熔解曲线法的敏感性、特异性分别为81.5%、98.9%,Kappa值≥0.75,与参考标准一致性较好;两种检测技术共有14 例不一致(表1)。
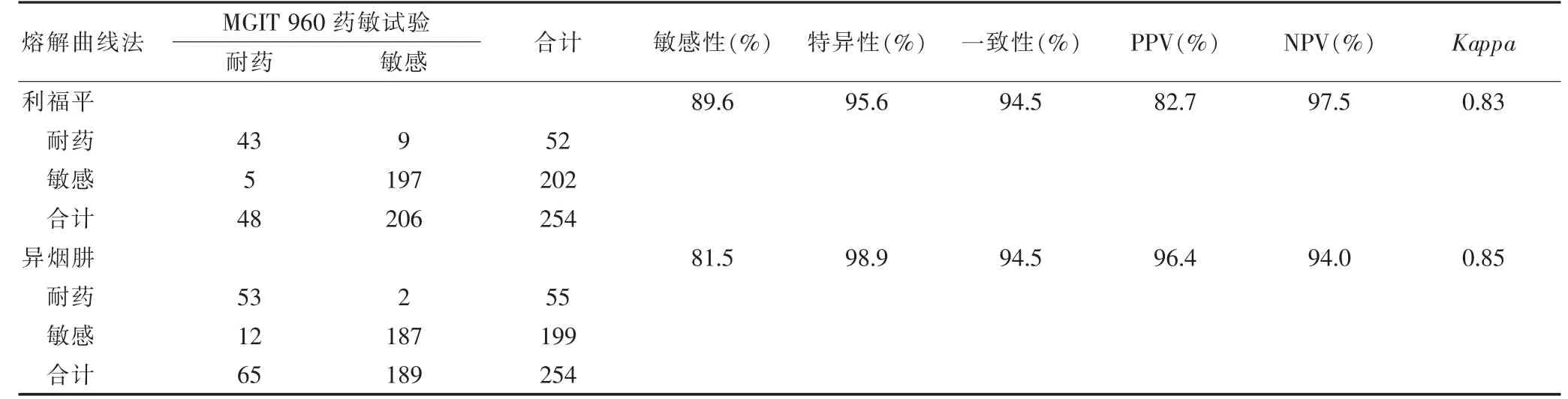
表1 熔解曲线法检测利福平和异烟肼耐药与MGIT 960 药敏试验结果的比较(例数)
2.3 应用线性探针耐药检测技术对不一致结果进行复检
254 例药敏结果中,熔解曲线共有28 例结果与参考标准不同。其中有17 例是熔解曲线法显示敏感,而MGIT 960 药敏试验为耐药,线性探针耐药检测复检为12 例耐药,5 例敏感;有11 例是熔解曲线法显示耐药,而MGIT 960 药敏试验为敏感,线性探针耐药检测复检为3 例敏感,8 例耐药。
2.4 熔解曲线法检测MDR-TB 的效能
检测所有病例MDR-TB 的能力与参考标准比较,熔解曲线法的敏感性、特异性分别为80.5%、95.8%,Kappa值为0.76,二者一致性较好。初治患者的敏感性和特异性均高于复治患者,其Kappa值为0.93,优于复治患者的0.60(表2)。
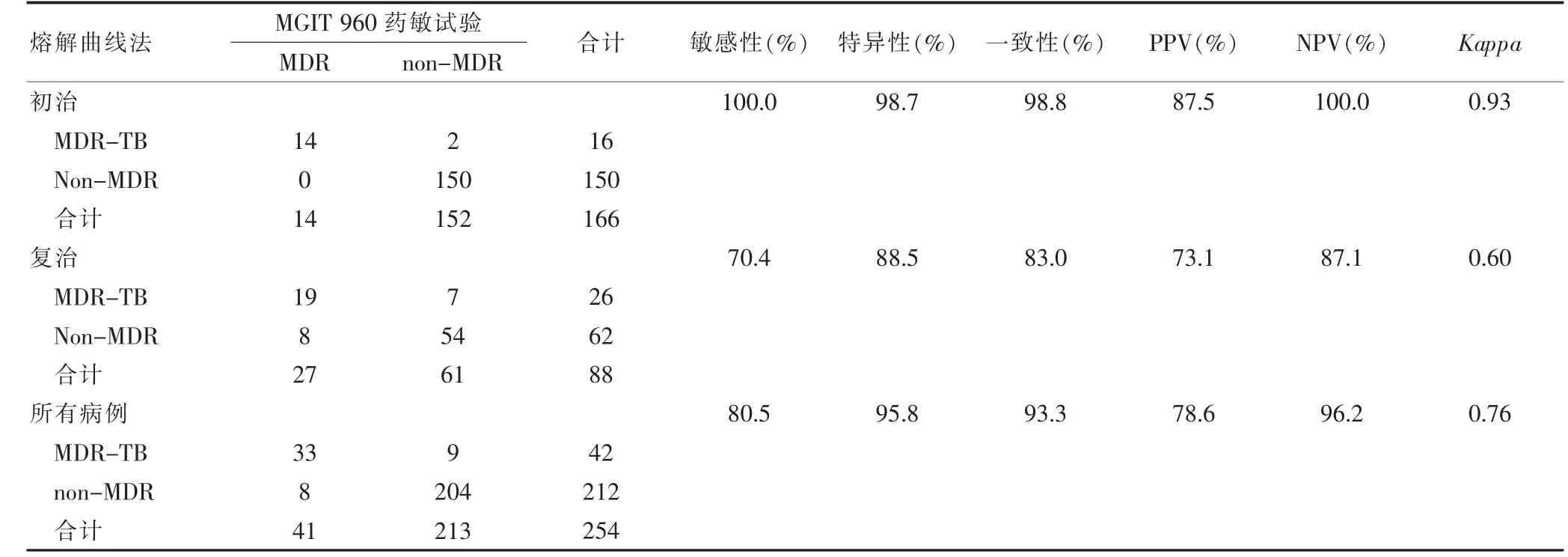
表2 熔解曲线法对不同治疗史样本患者MDR-TB 结果的判定(例数)
3 讨论
与MGIT960 药敏法比较,荧光PCR熔解曲线法对两种药物的耐药检测指标较好,但是异烟肼耐药检测的敏感性略低于利福平,可能是由于利福平耐药突变的检测限略高的原因。关于不一致结果的产生原因较复杂,MGIT 960 药敏法耐药而熔解曲线法敏感的可能原因:①分子法是针对特定突变位点的密码子的检测,不能覆盖所有的突变位点;②耐药机制除了位点突变还存在外排泵[7-8]等;③可能存在异质性耐药[9],一般分子法的检测限在20%左右,而培养法的检测限可达到1%[10]。MGIT 960 药敏法敏感而熔解曲线法检测耐药的可能原因:①体外培养可能导致耐药菌亚群比例下降、低于培养法检测灵敏度[11];②异质性耐药或DNA 纯度不够,导致熔解曲线出现各种杂合峰或复杂曲线,受到仪器性能和人工判读的影响较大[12];③可能与MGIT 960 药敏法的利福平终浓度设置过高有关(培养管中的药物终浓度为利福平1.0 μg/mL,异烟肼0.1 μg/mL);④分子药敏检测出rpoB基因511位点和inhA突变时,表型药敏往往检测结果为阴性[13]。参考《结核分枝杆菌耐药性监测专家共识》[14]的建议,当分子药敏试验和表型药敏试验结果不一致时,需参考对不同抗结核药品分子药敏试验检测敏感度和特异度[15]。
应用线性探针耐药技术对不一致结果的复检显示,在利福平耐药检测方面,线性探针更倾向于与参考标准一致,由于是对不一致结果进行复检,不能以与参考标准结果符合度高更多而断定线性探针方法优于熔解曲线法。我国对异烟肼耐药的菌株中约有3%携带axyR-ahpC基因突变[16],与线性探针比较,是熔解曲线法的检测优势,所以复检指标中线性探针与参考指标比较的符合度低于利福平。进一步研究发现,不一致结果中抗酸染色镜检3+以上即菌量较多标本,两种分子法一致且都与参考标准不同,这很可能与异质性耐药和检测限有关。
对于MDR-TB 的判定,熔解曲线法更适用于初治人群,这可能是由于:①复治患者治疗过程中药物选择作用下产生的突变并不引起氨基酸改变;②复治患者在治疗中出现的耐药突变更为复杂,超出了分子法检测突变的范围[17]。本实验的不足在于没有对不一致结果进行测序,可以在未来的研究中进一步验证。
综上所述,荧光PCR熔解曲线法实现了模块封闭性自动化检测,虽然无法取代表型药敏技术,但是其快速、准确的特点,仍适用于结核病耐药初筛,MDR-TB 患者可以通过尽快原则适当地进行二线药物快速治疗,取得更好的疗效。

