栉孔扇贝鳃细胞原代培养与B[α]P细胞毒性检测技术的研究*
张子仙 田依萌 刘 志 潘鲁青①
(1. 中国海洋大学海水养殖教育部重点实验室 中国海洋大学 山东 青岛 266003;2. 黄岛出入境检验检疫局 山东 青岛 266555)
多 环 芳 烃(polycyclic aromatic hydrocarbons,PAHs)主要来源于有机物的热解或不完全燃烧,作为一种持久性有机污染物,具有内分泌毒性、神经毒性、免疫毒性和生殖毒性等。 其中, 苯并(a)芘(benzo[a]pyrene, B[α]P)是致癌性最强的PAHs(朱利民等, 1993; 杨帆等, 2013)。随着海上石油和轮船运输业的快速发展和工农业、生活污水的大量排放,海洋环境污染日趋严重。研究表明,大连海域、青岛近岸海域、海口湾海水PAHs 污染含量分别为65~1130、8.23~272.02 和420.2~2539.1 ng/L(李先国等, 2012; Lietal, 2015),我国近岸部分海域PAHs 已接近中等污染水平。
双壳贝类分布广泛,营滤食性生活,代谢率较低,对PAHs 有较强的生物富集作用,常被作为海洋污染监测的指示生物(Birmelinet al, 1999; Faucetet al,2003; Gacicet al, 2014)。许多学者研究利用鱼类组织细胞评估体外生态毒理风险和监测水域环境污染状况(Fent, 2001; Bolset al, 2005)。已有学者将双壳贝类原代培养的组织细胞用于增塑剂、重金属等污染物的毒性评估和生物监测,如4 种增塑剂对珠蚌(Unio pictorum)组织细胞毒性检测方法的研究表明,中性红比色法适于检测双酚A 对外套膜、鳃和性腺细胞的活性影响,MTT 比色法更适于检测DiDP 对消化盲囊细胞的毒性(Yurdakök-Dikmenet al, 2018)。重金属对淡水贻贝(Lasmigona costata)鳃组织细胞的毒性检测方法为台盼蓝排斥拒染法(Nogueiraet al, 2013),由此说明污染物对贝类原代培养细胞毒性在检测方法上存在差异。目前,贝类原代组织细胞培养刚刚起步,在组织(外套膜、鳃、消化盲囊和性腺)消毒处理和细胞分离制备等技术方面仍不够完善(Daugavetet al,2015; Yurdakök-Dikmenet al, 2018)。
栉孔扇贝(Chlamys farreri)是我国浅海重要的经济贝类,基于双壳贝类的生态习性,鳃组织作为直接与外界水环境接触的呼吸、滤食器官,鳃细胞的活力、形态和受损程度可直接反映海洋环境污染状况。本研究以栉孔扇贝为研究对象,在已有双壳贝类细胞培养方法的基础上,优化栉孔扇贝鳃细胞的制备技术和原代培养条件,并采用3 种细胞活性检测技术,比较分析B[α]P 对栉孔扇贝鳃细胞的毒性作用,旨在为双壳贝类原代细胞培养和海洋PAHs 毒性评估提供技术支持。
1 材料与方法
1.1 实验材料
实验所用栉孔扇贝购于山东青岛市沙子口贝类养殖场,壳高为(6.0±0.5) cm,暂养在塑料水槽中,海水盐度为31,温度为(18±1)℃,pH 为8.0,连续充气,日换水量1/2,暂养密度为4~6 个/L,投喂螺旋藻(Spirulina)粉,日投饵量为软体部鲜重的0.5%。暂养2 d 后,选取健康个体,去除贝壳表面附着物,置于经 0.22 μm 滤膜过滤的海水中,加入适量双抗(1000 U/mL 青霉素、1000 μg/mL 链霉素),养殖2 d。
1.2 鳃细胞的制备
选取活力好的栉孔扇贝,用过滤灭菌海水冲洗贝壳表面,参考郎刚华等(2000)的方法,用无菌脱脂棉蘸取75%酒精消毒贝壳,晾干。在超净工作台中,取鳃组织置于培养皿中,称重,然后用过滤灭菌的海水冲洗数次(去除残留的血细胞),再用消毒液(由无菌海水、青霉素100 U/mL-链霉素100 μg/mL 双抗和庆大霉素80 μg/mL 配制)冲洗鳃组织3 次,然后浸泡于消毒液中除菌。将浸泡后的鳃组织用CMFS (HEPEs 20 mmol/L、NaCl 500 mmol/L、KCl 12.5 mmol/L、EDTA 5 mmol/L、1%庆大霉素,pH=7.3,渗透压=1100 mOsm)缓冲液冲洗3 次,置于CMFS 溶液中,将鳃组织剪至1~2 mm3小块,将剪碎的组织块转移至等体积混合的CMFS 和胰蛋白酶(浓度为0.25%)中,26℃振荡消化,加入适量的L15 培养基(10%胎牛血清、1%庆大霉素,pH=7.3,渗透压=1100 mOsm)。将鳃细胞悬液先后经400 目和150 目的灭菌金属细胞筛过滤,离心5 min,弃上清液,加入不含血清的L15培养基,重悬沉淀,再次离心5 min,弃上清液,加入L15 培养基重悬,将细胞密度调整至1.2×105cells/mL ,接种至96 孔细胞培养板,置于26℃、5% CO2细胞培养箱中静置培养。
1.3 鳃细胞原代培养方法优化
1.3.1 消毒时间 消毒液浸泡时间设置为10、20、30 和40 min 4 个组,每组均设3 个平行组,按设置的消毒浸泡制备鳃细胞,取细胞悬液,在 NIKON TS100 倒置显微镜下观察鳃细胞形态和染菌情况,并采用台盼蓝拒染法计数鳃细胞,用活细胞占总计数细胞的百分比表示细胞存活率。
1.3.2 胰蛋白酶消化时间的筛选 胰蛋白酶消化时间设置为15、20、25 和30 min,每个组均设3 个平行组,按设置的胰蛋白酶消化时间制备鳃细胞,取细胞悬液稀释10 倍滴至血球计数板上,于光学显微镜下计数,细胞收获量以每克鳃重分离的细胞总数表示,并计算细胞存活率,方法同上。
1.3.3 离心力的筛选 鳃组织经消化后,离心、重悬收集鳃细胞,离心力设置为150、200 和300g,每组均设3 个平行,按设置的离心力制备鳃细胞,存活率计算方法同上,并观察鳃细胞形态。
1.4 鳃细胞原代培养基的优化
实验以L-15 作为基本培养基,设置4 个胎牛血清浓度梯度5%、10%、15%和20%,每组均设3 个平行,分别培养6、12 和24 h,存活率计算方法同上。
1.5 B[α]P 实验梯度设置
实验所用B[α]P 为美国Sigma 公司生产,采用DMSO 作为助溶剂配制B[α]P 储备液,将储备液加入L-15 培养液中配制各染毒实验梯度,染毒梯度设置为2、4、8 和16 μg/mL,以未加B[α]P 组为对照组,且各实验染毒组DMSO 浓度均为0.1%。经预实验显示,DMSO 处理组和对照组的鳃细胞活性无明显差异。将制备的鳃细胞以1.2×105cells/孔接种于96 孔培养板中,加入含有B[α]P 的L-15 培养液,以6 个孔为1 个平行组,每个实验梯度均设3 个平行,进行原代细胞培养,分别在6、12 和24 h 时取鳃细胞培养液,检测鳃细胞活性。
1.6 鳃细胞活性的检测方法
1.6.1 台盼蓝拒染法 参考Katsumiti 等(2018)的方法,收集培养的鳃细胞,调整细胞浓度为106cells/mL,取9 滴血细胞悬液,加1 滴0.4%台盼蓝染料,混匀,在3 min 内用血球计数板分别计数活细胞和死细胞数量,计算鳃细胞相对活性(%)=实验组细胞存活率/对照组细胞存活率×100%。
1.6.2 中性红比色法 在B[α]P 染毒的细胞培养液中,加入10 μL 0.33%的中性红溶液,黑暗处孵育1 h,弃上清液,用PBS 洗涤底部沉淀2 次,加入100 μL乙酸乙醇裂解液(乙酸1%、乙醇50%),20℃下孵育15 min,分别在波长550 和630 nm 下用酶标仪测定吸光度值(OD 值),并以OD550nm-OD630nm值为结果,计算鳃细胞相对活性(%)=OD实验组/OD对照组×100%。
1.6.3 CCK8 法 在96 孔鳃细胞培养板中,每孔加入10 μL CCK8 溶液,在37℃、CO2培养箱中孵育4 h,然后去细胞培养液,用酶标仪测定450 nm的OD值,计算鳃细胞活性(%)=(OD实验组/OD对照组)/(OD对照组-OD空白组)×100%。
1.7 数据处理与分析
所有数据均以3 个平行组数据的平均值±标准差(Mean±SD)表示,采用SPSS 22.0 软件进行单因素方差分析(one-way ANOVA)和Duncan 检验法统计分析。
2 结果
2.1 栉孔扇贝鳃细胞制备方法的优化
2.1.1 消毒时间对栉孔扇贝鳃细胞存活率的影响
由表1 可知,栉孔扇贝鳃组织在消毒10、20 和30 min 时,原代培养鳃细胞存活率无明显差异,而消毒40 min 时存活率显著下降;经倒置显微镜观察,消毒10 和20 min 时染菌明显,30 min 时无染菌现象,细胞状态良好(图1)。

表1 消毒时间对栉孔扇贝鳃细胞存活率的影响Tab.1 Effects of disinfection time on the survival rate of C. farreri gill cell

图1 栉孔扇贝鳃组织在不同消毒浸泡时间下细胞染菌情况(40×)Fig.1 Contamination of C. farreri gill cells after disinfectant treatment for different time (40×)
2.1.2 胰蛋白酶消化时间对栉孔扇贝鳃细胞存活率的影响 由表2 可见,胰蛋白酶消化时间对栉孔扇贝鳃细胞收获量影响显著。在消化15、20 和25 min时,原代培养鳃细胞存活率无明显差异,而消化30 min时,存活率显著下降。因此,基于鳃细胞收获量和存活率,栉孔扇贝鳃组织胰蛋白酶的最佳消化时间为25 min。

表2 胰蛋白酶消化时间对栉孔扇贝鳃细胞收货量和存活率的影响Tab.2 Effects of trypsin digestion time on the amount and survival rate of C. farreri gill cell
2.1.3 相对离心力对栉孔扇贝鳃细胞存活率的影响
表3 显示,相对离心力对栉孔扇贝鳃细胞存活率影响显著。经倒置显微镜观察:离心力过大时,鳃细胞破损,内容物释出,细胞碎片较多(图2)。因此,相对离心力为150g时,栉孔扇贝原代培养鳃细胞存活率较高,细胞完整性好。

表3 相对离心力对栉孔扇贝鳃细胞存活率的影响Tab.3 Effects of relative centrifugal force on the survival rate of C. farreri gill cell
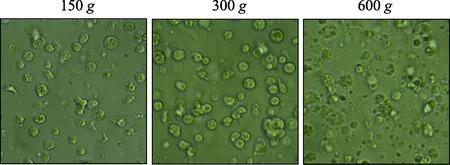
图2 不同相对离心力收集后的栉孔扇贝鳃细胞Fig.2 The gill cells of C. farreri collected by different relative centrifugal force
2.2 栉孔扇贝鳃细胞原代培养基的优化
从表4 可以看出,添加胎牛血清对栉孔扇贝原代培养鳃细胞存活率有明显影响。6~12 h 内,各处理组鳃细胞存活率无显著变化;培养24 h 时,5%和20%胎牛血清处理组存活率明显下降,而10%和15%处理组存活率略有下降,显微观察显示,鳃细胞饱满,活力好(图3)。
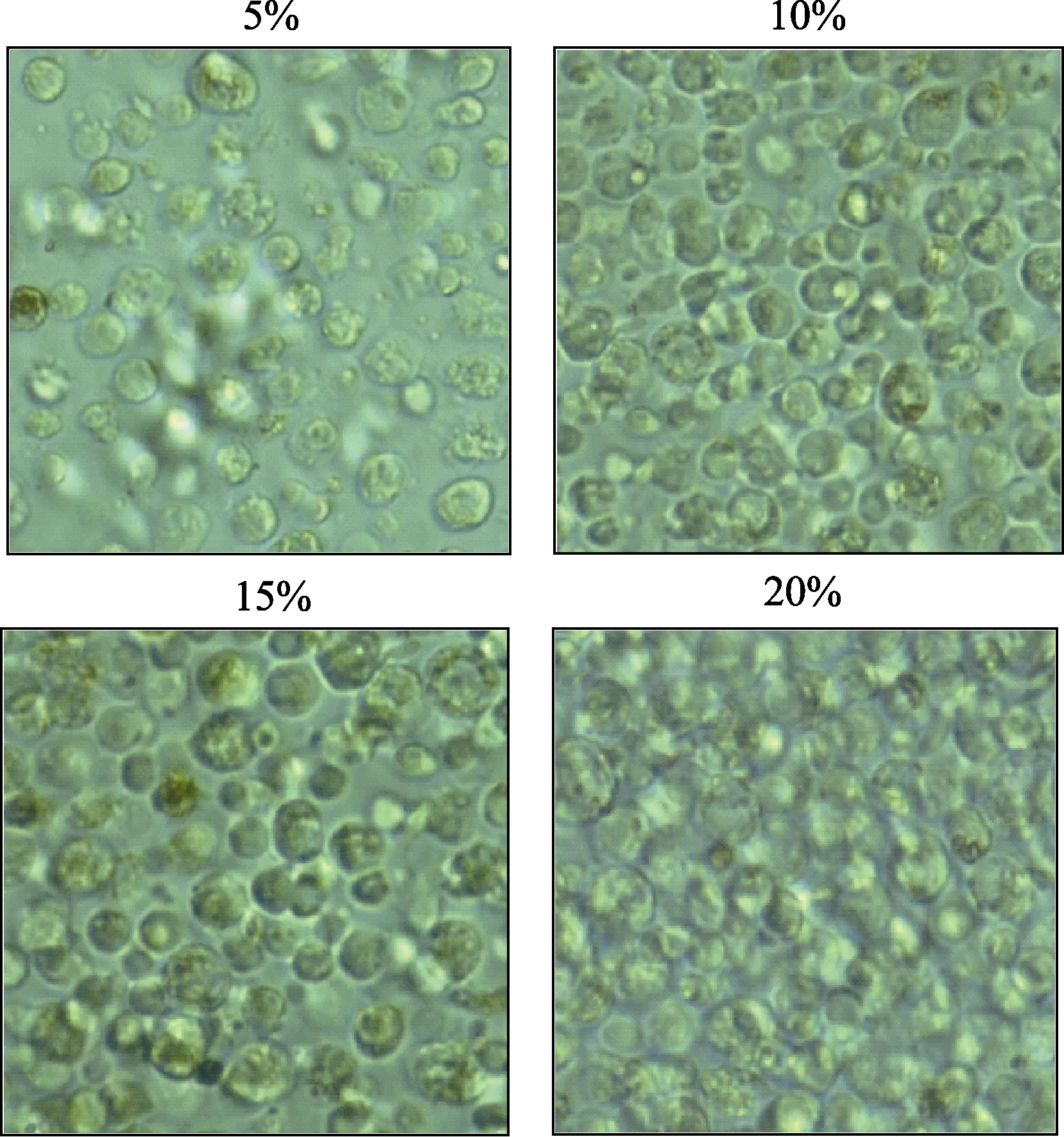
图3 栉孔扇贝鳃细胞在不同浓度胎牛血清下原代培养24 h 的显微观察结果Fig.3 Gill cells of C. farreri after cultured under different FBS concentration
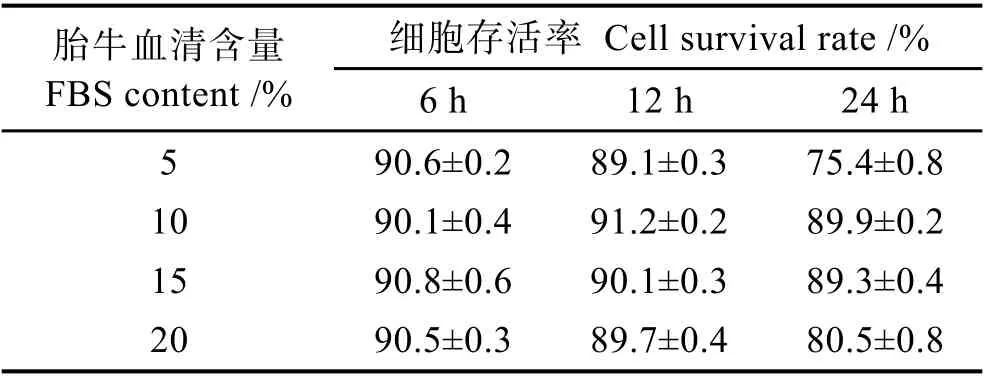
表4 添加胎牛血清对栉孔扇贝鳃细胞存活率的影响Tab.4 Effects of FBS on the survival rate of C. farreri gill cell
2.3 B[α]P 对栉孔扇贝鳃细胞活性的影响
采用台盼蓝拒染法检测显示,B[α]P 对栉孔扇贝原代培养鳃细胞活性无显著影响(P>0.05) (图4a)。由CCK8 试剂法检测得出,B[α]P 对栉孔扇贝鳃细胞活性仅16.0 μg/mL 处理组在12 和24 h 表现出显著的抑制效应(P<0.05)(图4c)。而中性红比色法显示,除1.0 μg/mL 处理组在6、12 h 和2.0 μg/mL 组在6 h 外,B[α]P 对栉孔扇贝鳃细胞活性具有显著影响(P<0.05),其毒性与B[α]P 染毒浓度、时间呈正相关(图4b)。

图4 B[α]P 对栉孔扇贝鳃细胞活性的影响Fig.4 Effects of B[α]P on the viability of C. farreri gill cell
3 讨论
越来越多的研究将贝类细胞作为体外模型用于环境监测和生态毒理学研究,而细胞的生存能力和功能活性是体外毒性实验的关键(Galganiet al, 2005)。本研究通过改进栉孔扇贝鳃细胞的制备方法和原代培养条件,分离得到了具有更高活力、更多数量且不易染菌的原代细胞。
3.1 贝类组织原代细胞制备技术
贝类鳃组织作为与外界水体直接接触的呼吸、滤食器官,鳃细胞的状态和活力直接受海水环境的影响,因此,选择鳃细胞作为毒性实验材料具有一定的代表性。而鳃丝表面富含黏液,极易附着微生物群,在原代细胞培养取材过程中,需进行严格的除菌处理(Yoshinoet al, 2013)。邓瑞鹏等(2004)将僧帽牡蛎(Saccostrea cucullata)鳃组织于消毒液(由青链霉素1000 U/mL 和 0.1%复方洗必泰配制而成)中浸泡50 min,鳃细胞培养传至第3 代并无明显染菌现象。据季爱昌等(2018)报道,栉孔扇贝心脏组织在消毒液(青霉素100 IU/mL-链霉素500 µg/mL、庆大霉素100 IU/mL、制霉菌素2 µg/mL)中处理20 min,成功建立了可长期存活的原代培养细胞系。本研究利用青霉素100 U/mL-链霉素100 μg/mL 双抗、庆大霉素80 U/mL 配制而成的消毒液,消毒浸泡30 min 时,除菌效果最佳,能够保证鳃细胞原代培养活性。这说明在双壳贝类原代细胞培养中,组织消毒液成分主要为抗生素,且抗生素种类、剂量和消毒时间与除菌效果密切相关。研究表明,双壳贝类组织的消毒处理是细胞原代培养的关键,应根据原代培养细胞的目的和要求,选择适宜的消毒液和消毒时间。
与外植体法相比,酶消化法能在较短时间内分离并获得大量的原代细胞,且均一性好、便于观察、细胞增殖速度较快,这对毒理学实验至关重要(邓瑞鹏等,2004; 艾庆辉等, 2012)。同时,酶解所获细胞经金属细胞筛去除未消化完的较大细胞团和组织,一般通过离心获得原代细胞。常用于分离脊椎动物细胞的胰蛋白酶、EDTA 剂量和酶解时间易使某些无脊椎动物细胞受损,而降低酶浓度或酶解温度、缩短处理时间能有效减少对细胞的损伤(Yoshinoet al, 2013; 康恺等,2020)。苗晶晶(2010)将栉孔扇贝消化盲囊置于CMFS缓冲液和胰蛋白酶分离2 h,获得6 种不同类型的消化盲囊细胞,原代培养 24 h 细胞存活率>80%。Yurdakök-Dikmen 等(2018)采用0.125%胰蛋白酶温育珠蚌鳃组织块4 h,获得活力良好的鳃细胞。Faucet等(2003)分别采用180g离心5 min、200g离心10 min收集紫贻贝(Mytilus edulis)消化盲囊、鳃原代细胞。本研究采用等体积的CMFS 和0.25%胰蛋白酶混合液,在26℃下消化栉孔扇贝鳃组织25 min,150g离心5 min 后获得大量分布均匀、高存活率的原代细胞。说明在双壳贝类组织原代细胞制备过程中,酶解浓度、时间和离心力、离心时间与细胞存活率、形态、活性直接相关。
3.2 贝类组织细胞原代培养条件
在双壳类的外套膜、消化盲囊、鳃和心脏等组织细胞培养中,多采用L-15 作为基础培养基。同时,胎牛血清含有大量细胞生长所必需的营养物质,常作为动物细胞培养基中的添加成分。Faucet 等(2003)研究表明,紫贻贝消化盲囊细胞在L-15 培养基中,培养72 h 后细胞活性可达75%以上。Le Marrec-Croq等(1999)将欧洲大扇贝(Pecten maximus)心脏细胞培养在L-15 海水培养基中,可在体外培养1 个月左右。据Birmelin 等(1999)报道,在紫贻贝消化盲囊细胞的L15 培养基中加入10%胎牛血清,原代细胞培养存活时间长达13 d。Lang 等(2000)在培养栉孔扇贝外套膜原代细胞时发现,M199 培养基中添加20%胎牛血清,细胞存活时间、活性明显提高。季爱昌等(2018)比较了3 个胎牛血清浓度(5%、10%和20%)对栉孔扇贝心脏原代细胞的培养效果。研究表明,添加5%胎牛血清时,细胞存活时间最长,且更易从组织块中迁出。本研究表明,在L-15 培养基中添加10%和15%胎牛血清时,栉孔扇贝鳃原代细胞活性最高。L-15 培养基仅能满足双壳贝类组织细胞的存活、活性等,而添加胎牛血清可明显提高细胞生存状态。目前,双壳贝类组织细胞培养还处于探索阶段,尚未达到细胞系水平。因此,关于双壳贝类组织细胞培养基优化还需进一步研究。
3.3 B[α]P 对栉孔扇贝鳃细胞毒性效应
由于海洋无脊椎动物尚未培养出永久细胞系,因此,大多数研究集中在原代培养细胞的应用上,如用软体动物细胞评估环境中污染物的毒性(Pennecet al,2001)。目前,体外细胞毒性检测方法有很多,如台盼蓝拒染法、四甲基偶氮唑(MTT)、二甲氧唑黄(XTT)比色、CCK8 法、中性红(NR)比色法和结晶紫比色法等,而相较于MTT 和XTT 等方法,CCK8 法没有细胞毒性,操作便捷,且更稳定、更灵敏(Suet al, 2017)。Domart-Coulon 等(2000)采用MTT 法检测有机杀虫剂Mexel-43 对长牡蛎(Crassostrea gigas)心脏细胞、蛤仔(Ruditapes decussatus)鳃细胞的活性影响。Morcillo等(2016)研究表明,相较于NR 比色法,MTT 法更适合测定重金属对金头鲷(Sparus aurata)成纤维细胞的毒性。本研究表明,栉孔扇贝鳃细胞在B[α]P 胁迫浓度范围2~16 μg/mL 时,采用NR 比色法检测显示,鳃细胞活性显著下降,且下降程度与B[α]P 胁迫时间、胁迫浓度呈显著正相关;CCK8 法检测的鳃细胞活性仅在16 μg/mL B[α]P 处理12 h 后明显下降;台盼蓝拒染法未检测出B[α]P 对鳃细胞活性的影响。由此可见,不同海洋生物的组织细胞对不同种类的污染物敏感度不同,应筛选不同的细胞活性检测方法,这一点需引起研究者重视。
Pennec 等(2001)利用荧光素二乙酸酯(FDA)法、MTT 法、NR 方法检测了原油(含大量PAHs)对欧洲扇贝消化盲囊原代培养细胞的毒性影响,认为MTT 法和NR 比色法可以反映PAHs 对细胞的毒性作用。Gòmez-Mendikute 等(2003)和刘静等(2009)研究表明,NR 比色法可分别作为检测贻贝(Mytillus galloprovincialis)和栉孔扇贝血细胞在B[α]P 胁迫下毒性效应的方法。这与本研究NR 比色法适合检测B[α]P 胁迫下栉孔扇贝鳃细胞活性的研究结果类似。台盼蓝拒染法、CCK8法和NR 比色法分别被用于评估膜结构的完整性、线粒体损伤和溶酶体损伤,说明PAHs 对双壳贝类组织细胞溶酶体损伤最为严重,其受损程度远大于线粒体。研究表明,PAHs 作为一种亲脂类有机污染物,能够穿过细胞膜进入细胞,而溶酶体通过释放代谢酶与PAHs 发生化学反应,有助于消除PAHs 对细胞的毒性作用,可能对PAHs 毒性较为敏感,适合作为PAHs 对细胞毒性实验的检测指标。
综上所述,本研究优化了栉孔扇贝鳃细胞的制备方法,改进了培养基营养成分,为鳃原代细胞分离和培养提供了一种操作简便、快速可行的方法。同时,探索B[α]P 对鳃原代培养细胞的毒性检测方法,筛选出中性红比色法可以作为评价B[α]P 对栉孔扇贝鳃细胞毒性的检测方法,为海洋环境PAHs 污染的细胞毒性评估提供了科学依据。

