翡翠绿葛仙米生活史特征研究
王 卫,易思富,田 云
(1. 湖南农业大学 生物科学技术学院,长沙 410128; 2. 常德炎帝生物科技有限公司,常德 415000)
葛仙米(Nostocsphaeroideskützing),又名球状念珠藻,是一种传统的药食两用蓝藻[1],属蓝藻门(Cyanophyta)、蓝藻纲(Cyanophyceae)、段殖藻目(Hormogonales)、念珠藻科(Nostocaceae)和念珠藻属(Nostoc)[2-5]。人工养殖葛仙米群体为球状,野生葛仙米主要形状呈球形胶质状或者其他不规则形状,呈墨绿色或者黄褐色[6-7]。葛仙米的主要活性成分有多糖、蛋白质、氨基酸、维生素和矿物质等[8]。葛仙米对多种自由基具有良好的清除作用,也能够增强自身的氧化防御体系和抗氧化能力[9]。葛仙米是国家卫生健康委员会批准的新食品原料[10]。
葛仙米生活史主要为藻殖段繁殖史[11-12]。藻殖段(hormogonia)是一种由不可移动的藻丝体断裂而释放出的许多短而直的可移动的藻丝。其形态上和营养藻丝体具有明显区别,组成藻殖段的细胞内具有折光性较强的伪空泡[13],藻殖段分化是多种金属离子协同作用,信号转导参与且复杂的过程[14]。与营养藻丝体相比,藻殖段表现出了更高的对低光高温应变能力[15]。葛仙米具有多型性,这些多型性既表现在葛仙米生活史中不同发育阶段的多样性,也表现在不同藻株在生态型上的多样性和同一藻株在不同环境条件下的形态多样性。葛仙米可通过藻殖段、出芽、异形胞等进行繁殖,且不同繁殖方式的生活史形态特征具特殊性[16]。目前,藻殖段繁殖的形态特征已被广泛认知,其他繁殖方式的形态特征仅有零星报道,可见葛仙米的生活史具有在现有研究中还没有发现的生理特点。本研究以翡翠绿葛仙米为材料,以诱导翡翠绿葛仙米释放的藻殖段为发育起点,采用显微镜观察藻殖段发育形态特征,采集分析图片构建翡翠绿葛仙米从藻殖段至藻体破裂的生活史图谱,为进一步深入研究翡翠绿葛仙米提供参考。
1 材料与方法
1.1 材料
从常德炎帝生物科技有限公司葛仙米培植基地中选育,并经分类鉴定,保存的翡翠绿葛仙米。
配制BG-110培养基所用试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 藻殖段诱导
选取粒径5 mm、形态圆润、藻表光滑的翡翠绿葛仙米,用75%乙醇消毒5 s,用无菌蒸馏水洗净,装入塑料透明蒸煮袋,加40 mL BG-110液体培养基,抽真空30 s后封口。在37 ℃、光强12 000 Lx的条件下,静置处理48 h。将藻体撕裂成两瓣,接于250 mL无菌BG-110液体培养基中,在8 ℃、光强500 Lx的条件下,通气培养至藻体完全分解,于8 000 r/min离心10 min,收集上清液,获得藻殖段。
1.2.2 生活史形态特征观察
(1)从藻殖段到微球体的生活史形态特征。将按1.2.1中诱导的藻殖段,稀释100倍后,接于BG-110固体培养基上,在25 ℃,光强2 000 Lx的条件下,静置培养,每隔3 d取样制片,在Olympus BX53显微镜下观察藻殖段发育成微球体过程中的生活史形态特征,并用Olympus DP80采集图像。
(2)微球体出芽生活史形态特征。将培养获得的微球体,接于BG-110固体培养基上,在25 ℃,光强5 000 Lx的条件下,静置培养,每隔3 d取样制片,在Olympus BX53显微镜下观察微球体出芽繁殖过程中的生活史形态特征,并用Olympus DP80采集图像。在继续采用BG-110液体培养液通气培养藻丝体的过程中,取不同培养期的藻体,在体视镜下观察并用尺量粒径并拍照。
1.2.3 图片整理
在Olympus BX53显微镜下观察并用Olympus DP80采集的图片,经人工初步筛选及分类整理后,用Photoshop CS6剪切处理。
2 结果与分析
2.1 藻殖段生活史形态特征
将诱导所得藻殖段滤液稀释100倍接种于BG-110固培养基上,取样制片,在显微镜下观察(100~1 000倍),拍照记录藻殖段发育过程中的生活史形态特征,整理分析并构建藻殖段发育为藻丝体的生活史图谱,其结果如图1所示。
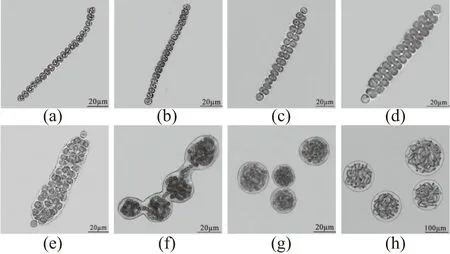
(a)藻殖段;(b)两端异形胞分化,伪空泡消失,藻细胞完成分裂准备;(c)部分细胞横向分裂;(d)细胞全部横向分裂成为“双线期”;(e)细胞分裂增殖,群内异形胞分化;(f)藻体胶质鞘多位点向内凹陷;(g)缢裂成多个球形的微球体;(h)藻丝体。图1 藻殖段到藻丝体的发育过程Figure 1 The developmental process from hormogonium to filamentation of seriate colonies
由图1可知,将藻殖段接于BG-110固体培养基上,在适宜温度光照下培养过程中,定期取样制片镜检藻殖段发育的生活史形态特征。其结果表明,藻殖段的生活史包括藻殖段阶段[图1(a)]、非丝状体阶段[图1(b)~(f)]、微球体阶段[图1(g)]及由微球体发育成内部藻丝呈丝状分布的藻丝体阶段[图1(h)]。其中非丝状体阶段包括以下5个时期:原异形胞分化及细胞分裂准备期[图1(b)]、细胞横向分裂期[图1(c)]、“双线期”[图1(d)]、细胞分裂增殖及群内异形胞分化期[图1(e)]和藻体胶质鞘多位点向内凹陷期[图1(f)]。以上结果证实:在藻殖段发育过程中,可通过非丝状体内凹缢裂增殖来增加微球体数量,且缢裂受阻会导致微球体畸形和数量锐减。由此可见,在葛仙米规模化育种过程中,非丝状体内凹横缢增殖期是调控微球体畸形率与产量的关键期。
2.2 不同长度藻殖段原异形胞分化
将藻殖段接种于BG-110固体培养基上,取样制片,在显微镜下观察(400倍),拍照记录不同长度藻殖段发育过程中的原异形胞分化,其结果如图2所示。

(a)极短藻殖段的原异形胞分化(含5~15个藻细胞);(b)短藻殖段的原异形胞分化(含20~30个藻细胞);(c)长藻殖段的原异形胞分化(含30~50个藻细胞);(d)超长藻殖的原异形胞分化(含50~100个藻细胞)。图2 不同长度藻殖段发育中的原异形胞分化(箭头所示)Figure 2 Original heterocyst differentiation of hormogoniums with various length in the development process (arrow head) 说明:原异形胞为在藻殖段萌发初期,由组成藻殖段的、未行细胞分裂的藻细胞分化形成的异形胞。如此与组成藻殖段的藻细胞萌发后经数代细胞分裂,再由子代藻细胞分化的异形胞进行区别。
2.3 短藻殖段异形胞分化
将长度较短的藻殖段接于BG-110固体培养基上培养,取样制片,在显微镜下观察(400倍),拍照记录藻殖段发育过程异形胞分化特点,其结果如图3所示。

(a)端异形胞期;(b)“双线期”;(c)细胞增殖期;(d)群内异形胞分化期。图3 短藻殖段发育中的异形胞分化(箭头所示)Figure 3 Heterocyst differentiation of the short hormogonium in the development process (arrow head)
由图2和图3可知,无论藻殖段细胞数量多少,两端均会分化出两个原异形胞。在发育过程中,藻殖段内原异形胞分化与藻殖段细胞数量有关,组成藻殖段的细胞数量越多,原异形胞分化越多[图2(a)~(c)]。但随细胞数量的增加[图3(b)和(c)],在短藻殖段发育而来的非丝状体内出现异形胞分化[图3(d)]。其结果表明,长藻殖段萌发时期的藻殖段内原异形胞分化和短藻殖段发育成非丝状体内异形胞分化具有一个共同特点是藻细胞数量相对较多。由此可见,异形胞分化受细胞数量促进,是葛仙米藻殖段繁殖调控的关键靶点,这可能与随藻细胞数量增多对来自异形胞的促生长因子的需求量增加有关。
2.4 微球体生活史形态特征
将微球体接种于BG-110固体培养基上,取样制片,在显微镜下(100~1 000倍)观察,拍照记录微球体发育过程生活史形态特征,整理分析图片,并构建微球体出芽繁殖的生活史图谱,其结果如图4所示。
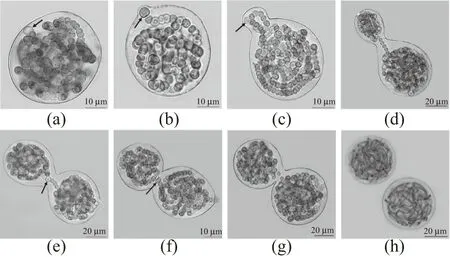
(a)微球体;(b)“雏芽”;(c)藻丝向芽体内移动,芽体增大;(d)内凹横缢,母体与芽体由群间单连藻丝连接;(e)群间单连藻丝内的细胞分化为异形胞;(f)异形胞迁移至中部;(g)群间单连藻丝断裂,细胞凋亡;(h)藻体缢裂,芽体从母体脱落,发育成藻丝体。出芽关联异形胞如图中箭头所示。图4 微球体出芽繁殖过程Figure 4 The process of germinal reproduction of microspheres
由图4可知,将微球体接于BG-110固体培养基上,在适宜温度光照下培养过程中,定期取样制片镜检微球体发育的生活史形态特征。结果发现微球体可通过出芽繁殖。出芽过程可分为具有边缘异形胞分化的微球体[图4(a)]、雏芽期[图4(b)]、藻丝向芽体内迁移及细胞分裂增殖期[图4(c)]、群间单连藻丝期[图4(d)]、群间单连藻丝内异形胞分化迁移期[图4(e)和(f)]和群间单连藻丝断裂与细胞凋亡期[图4(g)]。藻体缢裂,芽体脱落进而发育成成熟的藻丝体[图4(h)]。其结果表明,微球体可出芽繁殖,其实质为葛仙米藻体进行“藻体分裂”增殖。此外,在出芽过程中的异形胞分化与雏芽形成、芽体从母体脱落前的群间单连藻丝断裂有关,说明异形胞是葛仙米出芽繁殖调控的关键靶点。

(a)藻丝体;(b)粒径0.5 mm的藻体;(c)粒径1 mm的藻体;(d)粒径2~3 mm的藻体;(e)粒径3~4 mm的藻体;(f)粒径4~5 mm的藻体;(g)粒径6~7 mm的藻体;(h)藻体破裂释放藻殖段(箭头所指为藻体破裂形成“溃疡样斑”)。图5 从藻丝体到藻体破裂的发育过程。Figure 5 Developmental process from the filamentation of seriate colonies to the rupture of the frond
由图5可知,藻丝体经藻丝体→0.5 mm→……→6~7 mm的发育过程,最终在群体表面出现破裂形成“溃疡样斑”,使藻体被逐步分解而释放出藻殖段。结果表明:翡翠绿葛仙米生活史还包括随藻体粒径增大直至藻体破裂形成藻殖段而开始下一轮生活史的“异径藻体”阶段。
综上所述,以藻殖段为发育起点的生活史包括:藻殖段、微球体、藻丝体和异径藻体4个阶段,在异径藻体发育过程中,随藻体粒径增大直至藻体破裂形成藻殖段而开始下一轮生活史。在藻殖段发育过程中,有藻殖段繁殖和出芽繁殖,以“藻体分裂”增殖。此外,异形胞分化受藻细胞数量促进,与出芽繁殖“雏芽”形成和群间单连藻丝断裂有关,且结果说明异形胞是葛仙米藻体生长分化调控的关键靶点。
3 讨论与结论
3.1 藻体增殖效应
繁育大量藻种是保证规模化连续生产的关键。生活史形态特征研究发现,翡翠绿葛仙米生活史包括藻殖段发育到微球体的生活史和微球体出芽繁殖生活史,与邓中洋等[17]研究发现葛仙米藻体通过释放藻丝形成新的藻体和出芽生殖的结果一致。以“藻体分裂”的方式增殖,即胶质鞘两面内凹横缢到最后缢裂成两个或多个微球体。微球体再通过出芽繁殖增加藻体数量,最终发育为成熟藻丝体,出芽繁殖是增加藻体数量的主要方式。因此,在葛仙米规模化生产制种过程中,关注葛仙米的“藻体分裂增殖效应”,特别是优化促进出芽繁殖的条件,提高微球体出芽率而达到藻种增产的目的,从而更好地满足规模化生产对藻种的需求。
3.2 异形胞分化
异形胞由营养细胞分化而来,涉及一系列独特的基因表达程序。鱼腥藻PCC 7120是研究异形胞分化的模式生物,大量研究结果表明,异形胞形成的主要调节因子是HetR,异形胞发育的负调控因子是HetN,由HetR诱导的异形胞形成所必需的两个基因为hetP、hepA,CalA是异形胞分化调控阻遏子,HetR通过磷酸化来控制异形胞的分化。此外,alr1298基因表达、与HetR存在上位性关系的Pkn22激酶、与异形胞糖脂层有关的核苷二磷酸糖差异构酶(HgdA)、跨膜蛋白HglK也在异形胞分化发挥作用。再者,缺氮条件及MgSO4均可促进念珠藻的异形胞的分化,硝酸钠则抑制异形胞分化[18-25]。本研究结果表明,异形胞分化受细胞数量的促进。藻殖段两端原异形胞分化与藻殖段长度无关,藻殖段内的原异形胞数量与藻殖段长度有关。表现为藻殖段越长,藻殖段内异形胞分化越多,在较短藻殖段发育过程中,随藻体内细胞数量增加而异形胞分化增多。葛仙米异形胞的功能具有多样性,异形胞的功能绝非局限于固氮。本研究中还发现,在藻殖段萌发过程中,异形胞参与藻殖段发育的整个过程,对藻殖段生活史形态特征的构建具有重要作用。在出芽繁殖过程中,异形胞与“雏芽”形成、藻体分裂有关。为满足不同生理特性需要而出现异形胞的分化,在生活史不同时期分化异形胞可能存在功能上的差异性。在生产实践中,微观上调控基因表达,宏观上营造缺氮条件,可促使异形胞分化。
3.3 藻体分裂
在生活史形态特征研究中,在出芽繁殖后期,连接两个准子藻体的单连藻丝内出现异形胞分化而后藻丝在异形胞处断裂。有研究表明,Yfr1是一种小RNA,是一个重要的细胞壁内稳态调节因子,Yfr1在结合态氮缺乏时表达量增加而念珠藻生长受到损害,在异形胞与营养细胞的连接处易于发生断裂[26]。可见,葛仙米藻丝中营养细胞与异形胞处的断裂可能与Yfr1基因表达存在必然联系。本研究还发现,藻体缢裂是非丝状体分裂成微球体及微球体出芽繁殖芽体脱落的原动力,但从发育趋势猜想藻体胶质鞘分裂有两个过程,一是分裂动力可能是“增殖拉伸”,随芽体内细胞增加,芽体体积增大,拉伸内凹处胶质鞘,且胶质鞘向内凹陷处细胞凋亡而外分泌胶质较少,胶质鞘向内深度凹陷变细,最终缢裂;二是胶质修复,胶质鞘具有流动性,通过胶质自蠕动修复或是藻体内细胞分泌胶质修复,维持胶质鞘的完整性,使得外层胶质鞘不会因藻体分裂而留下创伤面。

