短链脂肪酸酯生物合成研究进展
陆家声,章晓宇,蒋羽佳,章文明,信丰学,姜 岷
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,南京 211816)
短链脂肪酸酯在食品和化学工业中都有广泛应用,预计到2022年,短链脂肪酸酯的全球市场将超过20亿美元[1]。乙酸乙酯、丁酸丁酯等是GB2760—86规定允许使用的食用香料,在食品领域具有广泛的用途[2-3],同时也广泛用于化妆品和香精中[4-6]。各种短链脂肪酸酯由于其生物降解性和低毒性而被用作工业溶剂,或者用作增塑剂和聚合物添加剂;可用作润滑剂、涂料;还可用来替代燃料或生物柴油。例如:丁酸丁酯,其辛烷值为97.3,高于EN228(欧洲汽油标准)中规定的最低值95,并且与汽油、航空煤油和柴油等具有良好的兼容性和相似的理化性质,在低温下仍具有良好的燃烧性能,使其成为潜在的航空燃料成分[7]。
短链脂肪酸酯天然存在于蔬菜、水果和浆果中,然而其天然含量低,提取成本昂贵。目前短链脂肪酸酯的大规模工业生产是以酸和醇为原料,浓硫酸为催化剂,通过酯化反应在高温和高压下合成(图1)。该工艺虽然技术成熟、产品收率高,但存在副反应多、设备腐蚀严重、“三废”排放量大等弊端[8]。为克服上述问题,研究人员开发了通过使用固定化脂肪酶的酶法工艺,在常温、标准大气压和温和pH条件下,通过脂肪酶催化醇和酸进行酯化合成酯。这种酶促反应通常具有高特异性和效率,副产物少,下游回收成本低等优点[8-9],但是其合成收率较低、底物和酶成本较高,限制了其大规模应用。因此迫切需要开发新型生产工艺,以实现短链脂肪酸酯的高效合成。
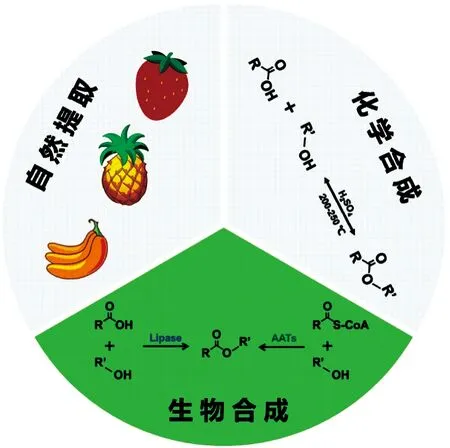
图1 短链脂肪酸酯的合成途径Figure 1 Synthesis pathways of short chain fatty acid esters
随着合成生物学和发酵工程技术的发展,利用生物发酵法合成短链脂肪酸酯已引起广泛关注。生物发酵法合成短链脂肪酸酯以可再生的生物质为原料,具有反应条件温和、产品纯度高、过程绿色环保等优势;且生物发酵合成的短链脂肪酸酯更受消费者青睐,其价格要远远高于化学合成的短链脂肪酸酯,因此,在食用香精和日化香料等领域具有更广泛的市场。目前,微生物发酵合成短链脂肪酸酯仍处于实验室水平,但近年来,国内外研究人员已开展生物发酵法合成短链脂肪酸酯的工作,基于合成机制可分为4类(图2),研究较为深入的是基于醇酰基转移酶和酯酶催化合成短链脂肪酸酯。本文介绍国内外生物发酵法合成短链脂肪酸酯,特别是丁酸丁酯的最新研究进展,指出目前所面临的问题和挑战,展望未来的研究方向。

(a)基于醇酰基转移酶;(b)基于酯酶;(c)基于半缩醛脱氢酶;(d)基于Baeyer-Villiger单加氧酶。图2 短链脂肪酸酯的生物合成途径Figure 2 Biosynthesis of short chain fatty acid esters
1 短链脂肪酸酯的生物合成机制
微生物合成短链脂肪酸酯过程中的酶促途径分别涉及:醇酰基转移酶(AATs)、酯酶(esterases)、半缩醛脱氢酶(HADH)和Baeyer-Villiger单加氧酶(BVMOs)。醇酰基转移酶和酯酶催化的反应是氧化还原中性的,而BVMOs和HADH分别需要NAD(P)H或NAD(P)。
1.1 醇酰基转移酶
醇酰基转移酶(AATs)可以在细胞内催化醇与酰基CoA缩合反应生成短链脂肪酸酯[10],包括乙酸丁酯、丁酸丁酯等[图2(a)]。各种醇酰基转移酶在酵母和水果中被发现(包括草莓、香蕉、甜瓜和苹果)[11-12]。醇酰基转移酶与蜡合酶/二酰甘油酰基转移酶(WS/DGA)的区别在于底物偏好相对较短的碳长度[13]。基于此,AATs常被用于生产短链酯的合成,而WS/DGA则多被用于生产长链酯如生物柴油等的合成[14-16]。
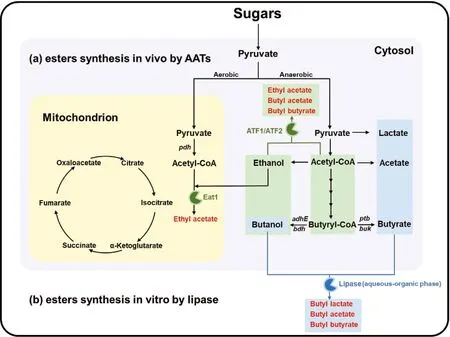
(a) 通过醇酰基转移酶体内合成酯; (b) 通过脂肪酶体外合成酯。图3 体内/体外合成短链脂肪酸酯的代谢途径Figure 3 Metabolic pathways for esters synthesis in vivo and in vitro
在野生型酿酒酵母(Saccharomycescerevisiae)中,醇酰基转移酶ATF1和ATF2分别由基因ATF1和ATF2编码,它们主要参与酿酒酵母中乙酸酯的形成[11,17-18]。有研究证实,在工程大肠杆菌(Escherichiacoli)菌株中,ATF1对C4醇和乙酰CoA的底物偏好优于C6醇和乙酰CoA[19],但ATF2的底物偏好尚未详细定义。在其他酵母菌株中也发现了ATF1和ATF2的同系物,包括卡尔斯伯格酵母(S.carlsbergensis)、光滑假丝酵母(Candidaglabrata)、乳酸克鲁维酵母(Kluyveromyceslactis)[20-21]。微生物AATs属于两个结构上不相关的蛋白质家族[22]。一种是乙酰转移酶1 (ATF1)、乙酰转移酶2 (ATF2)和酰基转移酶A (ATFA),它们具有O-酰基转移酶的一些特征,其中包含保守的HXXXD和DFGWG基序,HXXXD基序参与酰基转移。第二种AATs由乙醇己酰基转移酶1 (Eht1)和乙酯生物合成1 (Eeb1)的旁系同源物以及最近发现的乙醇乙酰转移酶1 (Eat1)组成[23]。另外,还从水果中发现多种醇酰基转移酶,如草莓(SAAT和FaAAT2)、香蕉(BanAAT)、甜瓜(MAAT)和苹果(AAAT)等。这些水果中的醇酰基转移酶具有广泛的底物特异性,范围从C1醇到C10醇或更高级的醇。
1.2 酯酶
酯酶包括脂肪酶,是一种普遍存在的酶。与催化醇与酰基CoA酯化的醇酰基转移酶相反,脂肪酶催化醇与酸的酯化[图2(b)],在有机相中产生酯[24]。因此,在脂肪酶介导的酯的生产过程中,醇和酸被用作前体。脂肪酶与酸反应生成脂肪酶-酸复合物,然后该复合物异构化形成酰基脂肪酶中间体。在下一步中,酰基脂肪酶捕获醇产生另一个复合物,该复合物异构化形成酯-脂肪酶复合物,最终酯从综合体中释放出来。另外,脂肪酶还可以通过其α/β-水解酶活性催化脂肪酸酯(包括三酰甘油)的水解[25-26]。
已经从各种微生物中鉴定出脂肪酶,包括无色杆菌属(Achromobactersp.)、芽孢杆菌属(Bacillussp.)、伯克霍尔德氏菌(Burkholderiasp.)、疏棉状嗜热丝孢菌(Thermomyceslanuginosus)、南极假丝酵母(C.antarctica)、皱假丝酵母(C.rugosa)等[27-28]。特别是南极假丝酵母脂肪酶B(CALB),它是一种众所周知的酶,能催化各种反应,包括香料和香料酯(短链酯)、生物二酯(长链酯)和改性甘油酯的合成,具有高活性、鲁棒性和底物的广谱可用性。在商业应用中,CALB通常以固定化形式在双相条件下使用,因为游离酶在含水条件下不稳定[29]。诺维信435 (N435)通过界面活化将CALB固定在LEWATIT®VPOC 1600树脂上,已被广泛用于各种酯的生物合成,包括丁酸丁酯、辛酸丁酯、棕榈酸香茅酯和咖啡酸甲酯等。
1.3 半缩醛脱氢酶
半缩醛是由醛和醇的自发反应在体内形成的。随后NAD(P)依赖性的半缩醛脱氢酶催化其形成酯[图2(c)]。严格意义上这种类型的酶是不存在的,因为HADH反应是某些醇脱氢酶的副作用[30]。半缩醛脱氢首次在甲基营养酵母中被观察到,因为当酵母以甲醇或乙醇为碳源生长时,高浓度的甲醛和乙醛分别积累,这对大多数生物都是有毒的[31]。半缩醛脱氢作用可能是通过半缩醛将醛转化为酯来解毒[32]。在甲醇毕赤酵母(Pichiamethanolica)、博伊丁假丝酵母(C.boidinii)和酿酒酵母(S.cerevisiae)的甲酸甲酯合成中发现了HADH的活性[33]。半缩醛脱氢可能有助于粗糙脉孢菌(Neurosporacrassa)、酿酒酵母(S.cerevisiae)、杰丁塞伯林德纳氏酵母(Cyberlindnerajadinii)和马克思克鲁维酵母(K.marxianus)中乙酸乙酯的形成,但这尚未在体内得到证实[34]。
1.4 Baeyer-Villiger单加氧酶
Baeyer-Villiger单加氧酶(BVMOs)是含有黄素的酶,因此需要NAD(P)H作为辅因子。它可以催化氧在醛和酮的C-C键之间的插入[图2(d)]。BVMOs的特征是具有FXGXXXHXXXW(P/D)序列基序,其在生活的所有领域中都有发现[35]。在自然界中,BVMOs参与次级代谢物的合成或启用非常规碳源的利用,如烷烃、酮或环状醇。BVMOs催化酮转化为酯,再进一步水解为易于代谢的醇和酸。这样的途径使戈登氏菌(Gordoniasp.)和维罗纳假单胞菌(Pseudomonasveronii)可以分别在丙烷或甲基酮上生长。目前,BVMOs的结构、功能和应用已在其他地方进行了广泛研究[36]。
2 微生物发酵合成短链脂肪酸酯
目前,ATTs在体内酯生产的代谢工程领域占据主导地位,因为该反应在热力学上是有利的(ΔG<0),并且不需要输入还原力。ATTs将一种醇和一种酰基CoA转化成酯(图3),在这个过程中释放出游离的CoA。醇和酰基CoA都容易在生物系统中产生,可以作为酯合成的有效前体。
在微生物发酵过程中(含水条件),脂肪酶催化酯化反应在热力学上是不利的(ΔG>0)。因此有研究开始尝试在发酵体系中加入有机萃取剂,实现酯的生产与原位萃取同时进行,以此推动反应向酯的生产方向进行。
目前利用HADH生产酯的代谢工程还没有报道,因为通过这种途径生产酯的过程会积累醛,而醛对细胞具有毒性,因此具有挑战性[31]。此外,半缩醛的形成是自发的,需要酸催化剂,这在生理的中性条件下是不存在的。
BVMOs将环酮生物转化为内酯(环酯)已得到广泛研究[37],但是这种体外过程依赖于昂贵的辅因子外部供应,如NAD(P)H。因此,从更便宜的底物如糖直接合成酯可能更经济,而且BVMO催化的酯生产也依赖于酮的供应,而酮不是常见的微生物代谢物。
2.1 利用醇酰基转移酶直接胞内合成短链脂肪酸酯
2.1.1 乙酸乙酯的天然合成
目前短链脂肪酸酯的天然合成主要集中在乙酸乙酯(表1)。已经有大量研究报道了各种酵母可以通过内源性AATs的催化作用,天然酯化酰基CoA和乙醇形成乙酸乙酯。然而,使用这种策略的乙酸乙酯产量特别低。主要原因可能是前体酰基CoA优先流向三羧酸(TCA)循环,而不是积累形成乙酸乙酯。因此假设当乙酰CoA在线粒体中积累时,大量乙酸乙酯的形成是代谢物溢出的现象[38]。具有从糖大量生产乙酸乙酯能力的酵母可以在胞质溶胶中将糖氧化成丙酮酸,然后在有氧条件下将丙酮酸转运到线粒体。在线粒体中,丙酮酸被氧化成乙酰CoA,然后流入TCA循环。如果TCA循环被破坏,乙酰CoA将在线粒体中积累,因为它不能进入TCA循环。在这种条件下,积累的乙酰CoA将通过AAT与乙醇形成乙酸乙酯。因此,抑制TCA循环积累乙酰CoA是增加乙酸乙酯产量的关键步骤。有研究采用铁限制作为合成乙酸乙酯的触发因素,在70 L搅拌反应器中进行中试发酵,使用马克斯克鲁维酵母(K.marxianus)从乳清中合成乙酸乙酯[39]。由于参与TCA循环的乌头酸酶(aconitase)和琥珀酸脱氢酶(succinate dehydrogenase)的活性依赖于铁,在铁限制条件下TCA循环将被破坏。当培养基中的初始铁浓度从182 μg/L降低到53 μg/L时,乙酸乙酯的产量从4.7 g/L提高到10.9 g/L,最终产率为 51.4%。Löbs等[40]采用CRISPR干扰系统(CRISPRi)可以实现精确的转录控制和途径优化,同时抑制马克斯克鲁维酵母中TCA循环的乌头酸酶、苹果酸脱氢酶和琥珀酸脱氢酶亚基1和2的基因表达。最终,重组菌株的乙酸乙酯产量达到野生菌株的3.8倍。综上所述,TCA循环对乙酰CoA积累的干扰可以提高乙酸乙酯的生产效率。

表1 生物发酵法合成乙酸乙酯的比较
电子传输链(ETC)是参与乙酸乙酯合成的另一个主要因素[41]。培养基中铜的缺乏不利于ETC工作,从而减缓NADH氧化NAD+,而乙酰CoA由于线粒体NAD+含量低,很难进入TCA循环[42]。ETC由4种多酶复合物组成,称为复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ。已经有研究[41]证明ETC抑制剂可以提高马克斯克鲁维酵母中的乙酸乙酯产量。ETC抑制剂羧苷能抑制复合物Ⅱ活性,轻度影响酵母生长和糖分消耗,乙酸乙酯的产量随羧化蛋白浓度的增加而增加。补充较低量的抗霉素A和氰化物(0.01 μmol/L抗霉素A和0.1 mmol/L氰化物)也可以提高最终乙酸乙酯的产量,但是过量会降低乙酸乙酯的产量。尽管ETC抑制剂可以有效地提高乙酸乙酯的产量,但由于其毒性和高成本,阻碍了其大规模生产。为了克服这个障碍,可以采用无害的CRISPRi来敲除ETC相关基因,包括琥珀酸脱氢酶亚基2(SDH2)、铁硫蛋白(RIP1)和转录激活因子MSS51,此时乙酸乙酯的产量可分别提高39%、52%和42%[40]。
2.1.2 代谢工程实现短链脂肪酸酯的合成
最常用的生物合成短链脂肪酸酯的方法仍然是通过AATs催化,研究比较充分的AATs是来自酿酒酵母ATF1和ATF2。ATF1占酿酒酵母乙酸乙酯产量的50%[46]。过量表达ATF1可显著提高乙酸乙酯滴度,而ATF2和Lg-ATF1效果不明显。然而,缺乏ATF1和ATF2的酿酒酵母菌株仍然保留了50%的乙酸乙酯产量。此外,ATF1、ATF2及其同源物似乎位于胞质溶胶或内质网中,而乙酸乙酯的产生主要发生在线粒体中。这一现象表明其他关键酶应该负责乙酸乙酯的合成。为了提高乙酸乙酯的产量,Dong等[43]通过插入强启动子PGK1p和终止子PGK1t分别过量表达了磷酸泛酸半胱氨酸连接酶(CAB2)、乙酰CoA合成酶(ACS2)和ATF1,以增加乙酰CoA的积累。利用基因工程酿酒酵母生产乙酸乙酯的产量达到610.26 mg/L,比摇瓶中原始菌株的9.22 mg/L高出60多倍。
最近,一个新的AATs家族被发现并命名为Eat1。乳酸克鲁维酵母中乙酸乙酯产量的80%应归功于Eat1的同源物,这些同源物存在所有已知的大量乙酸乙酯生产酵母中,如酿酒酵母、马克斯克鲁维酵母和异常威克汉姆酵母(Wickerhamomycesanomalus)[11]。Eat1已被证明位于酵母的线粒体中,其在酵母线粒体中的定位支持了乙酸乙酯合成利用线粒体乙酰CoA作为前体的假设。为证明Eat1在乙酸乙酯生物合成中的重要性,Kruis等[11]分别在酿酒酵母中过量表达Eat1、ATF1和ATF2。结果,过量表达Eat1的酿酒酵母的乙酸乙酯产量比其他两个代谢工程菌株高26倍。然而,酿酒酵母中乙酸乙酯产量低(理论途径最大值的1.32%)表明它可能不是最佳的生产宿主。这可能是因为酿酒酵母中的主要碳流量绕过线粒体,有利于细胞溶质乙醇的形成。出人意料的是,当在大肠杆菌中过量表达密码子优化的Eat1后,最终可从20 g/L葡萄糖和5.9 g/L乙醇产生4.87 g/L乙酸乙酯,最大途径收率为(32.93±0.11)%,表明大肠杆菌有潜力用于乙酸乙酯生产。研究表明当在大肠杆菌中表达时,Eat1的稳定性可以通过修剪被鉴定为线粒体靶向信号的N末端前序列来提高。因为原核宿主无法处理线粒体前序列,这可能导致Eat1异源表达受阻,从而使乙酸乙酯产量受损。Bohnekamp等[44]通过过量表达截短的Eat1变体(来源于异常威克汉姆酵母)并破坏乙酸激酶(ackA)和乳酸脱氢酶(ldhA)来改造大肠杆菌菌株,使其达到乙酸乙酯代谢通量最大化。因此,该工程菌株可以从55 mmol/L葡萄糖厌氧产生42.8 mmol/L(3.8 g/L)乙酸乙酯,为最大途径产量的72%。大肠杆菌中乙酸乙酯的高产量可能是由于大肠杆菌没有线粒体,乙酸乙酯的合成直接发生在细胞质中,从而减少了副产物途径的碳流量。
为了实现从可发酵糖直接生物合成乳酸酯,Lee等[47]提出了一个微生物转化平台。他们在大肠杆菌内设计了一个丙酮酸-乳酸酯模块,该模块通过乳酸脱氢酶(ldhA)将丙酮酸转化为乳酸,丙酸CoA转移酶(pct)将乳酸转化为乳酰CoA,以及醇酰基转移酶将乳酰CoA和醇缩合生成乳酸酯而组成。通过生成一个包含5个具有不同分配系数的丙酮酸-乳酸酯模块的文库,筛选出能够在外部醇供应下生产各种线性、支化和芳香族乳酸酯的最佳模块。通过将丙酮酸-乳酸酯模块和醇(即乙醇、异丁醇)模块共同引入模块化大肠杆菌(底盘)细胞中,首次展示了直接从葡萄糖微生物生物合成乳酸乙酯和乳酸异丁酯。为提高乳酸乙酯的产量,Lee等[47]将该途径重新模块化:产生乙醇和乳酸前体的上游模块和产生乳酰CoA并将其与乙醇浓缩以产生目标乳酸乙酯的下游模块。通过质粒拷贝数、启动子、核糖体结合位点和环境干扰来控制上游和下游模块的代谢通量,能够通过将乳酸乙酯产量提高4.96倍来探测和缓解代谢瓶颈。该研究发现AAT是乳酸酯生物合成中最限速的步骤,这可能是由于它对非天然底物乳酰CoA和醇的低活性和特异性造成的。
除了乙酸乙酯和乳酸酯,近年来也有大量研究探索了在溶剂梭菌拜氏梭菌(Clostridiumbeijerinckii)、丙酮丁醇梭菌(C.acetobutylicum)和大肠杆菌中构建醇酰基转移酶合成途径来实现丁酯的合成。在基因工程改造的微生物中,作为合成的前体,丁醇和酰基CoA可通过葡萄糖分解代谢或外部补充获得。拜氏梭菌和丙酮丁醇梭菌中存在天然的丁醇和酰基CoA合成途径,而模式微生物大肠杆菌缺乏酰基CoA或丁醇的合成途径,因此需要在大肠杆菌中构建合成途径。
野生型拜氏梭菌和丙酮丁醇梭菌可在胞内合成高浓度的乙醇、丁醇,而在胞内可合成乙酰CoA和丁酰CoA。这些都是醇酰基转移酶用来合成短链脂肪酸酯的底物,使之成为合成丁酸丁酯很有前途的宿主。最近,酿酒酵母的醇酰基转移酶基因ATF1被引入拜氏梭菌NCIMB 8052中,使其能够从葡萄糖直接生产乙酸丁酯[48]。通过一系列优化,在48 h 内可以从38.2 g/L葡萄糖中生成5.57 g/L乙酸丁酯(包括在水相中的1.03 g/L和在有机相中的45.3 g/L,水/非水相的体积比为10∶1),比以前的报道结果高665倍。同样地,在丙酮丁醇梭菌中表达AAT酶的基因对天然产生水果酯如乙酸丁酯、乙酸乙酯和丁酸丁酯是可行的选择[49]。其中,丁酰CoA和丁醇是由4种酶依次转化2个乙酰CoA分子形成的,分别为硫酶(thiolase)、3羟基丁酰CoA脱氢酶(3-hydroxybutyryl-CoA dehydrogenase)、巴豆酶(crotonase)和丁酰CoA脱氢酶(butyryl-CoA dehydrogenase)[50-51]。另外,丁酰CoA也可以通过CoA转移酶对丁酸的再甲基化而形成[52]。在最近一项研究中,选择具有强碳通量产生丁醇和丁酰CoA的丙酮丁醇梭菌ATCC 824被用作宿主,并通过引入来自草莓属(Fragaria×ananassa)或苹果属(Malussp.)的醇酰基转移酶进行工程改造[53]。其中,密码子优化的SAAT和AAAT基因可在thl启动子的控制下表达。表达草莓SAAT基因的工程化丙酮丁醇梭菌菌株CaSAAT通过分批培养可以合成50.07 mg/L的丁酸丁酯,占产生总酯的84.8%。同样的,表达苹果AAAT基因的工程化丙酮丁醇梭菌菌株CaAAAT可以合成40.60 mg/L的丁酸丁酯,丁酸丁酯的选择性为87.4%。这项研究证明在工程改造的丙酮丁醇梭菌中从葡萄糖一步发酵丁酸丁酯的可行性,也是首次利用一步发酵法直接合成丁酸丁酯的研究报道。目前,Noh等[54]使用的丙酮丁醇梭菌菌株CaSAAT和CaAAAT在丁酸丁酯滴度和选择性方面均表现出最佳性能。在酶和前体方面,应考虑其特异性对丁酸丁酯的产率影响,在丙酮丁醇梭菌的进一步工程改造中,用于高效生产丁酸丁酯。在这项工作中,证明通过利用草莓或苹果中的AAT与丙酮丁醇梭菌中C4途径的组合,选择性地生产丁酸丁酯。此外,在工程菌株的培养过程中,实现丁酸丁酯生产无需包括丁醇和丁酰CoA在内的前体外源。另外还发现在丙酮丁醇梭菌菌株CaSAAT和CaAAAT之间,丁酸丁酯在丙酮丁醇梭菌生产中的选择性没有显著差异,并且这些工程改造的丙酮丁醇梭菌菌株可以作为开发其他菌株的平台[55-58]。因此这些菌株进一步提高了丁酸丁酯的滴度和选择性。
与丙酮丁醇梭菌不同,大肠杆菌没有形成丁醇和丁酰CoA的天然途径。因此,如果选择大肠杆菌作为底盘细胞合成丁酸丁酯,必须异源引入代谢模块以合成丁醇和丁酰CoA。丙酸梭菌pct基因编码的酰基CoA转移酶被用于取代丁酰CoA生产模块[5]。工程大肠杆菌中的酰基CoA转移酶将外部补充的丁酸转化为丁酰CoA。Layton等[5]使用adhB和pdc基因编码的醇生产酶,并测试突变大肠杆菌中酯化反应的5种不同的醇酰基转移酶。在工程改造的大肠杆菌菌株中,含有SAAT和VAAT的菌株分别产生47.63 mg/L和 2.76 mg/L的丁酸丁酯,以及 134.43 mg/L和141.60 mg/L的丁酸乙酯。相反表达ATF1、ATF2和AeAT9(Actinidiaeriantha)的菌株产生约0.17~0.28 mg/L的丁酸丁酯。据报道[59-63],当提供合适的底物时,乙酸异戊酯、乙酸丁酯、乙酸乙酯和丁酸丁酯是通过在大肠杆菌中表达酿酒酵母基因ATF1或ATF2和草莓基因SAAT而产生的。提高添加到反应中的醇的浓度通常可以提高酯的产量。Horton等[54]在大肠杆菌和丙酮丁酸梭菌中异源表达酿酒酵母基因ATF1或ATF2和由SAAT编码草莓的醇乙酰基转移酶基因,以建立通过微生物生物合成产生几种酯的方案。在相同培养条件下,发现ATF1表达比ATF2表达或SAAT表达能产生更多的乙酸异戊酯和乙酸丁酯。此外,SAAT表达比ATF2表达能产生更多的乙酸异戊酯和乙酸丁酯。丁酸丁酯是由含有SAAT而不是ATF1或ATF2的大肠杆菌的无细胞提取物产生的。尽管ATF2在酵母中似乎是多余的,但是这两个基因均适用于探索大肠杆菌和丙酮丁醇梭菌的代谢通量。研究表明,最终产品丁酸丁酯是需要在丙酮丁醇梭菌中生产的,尽管表达ATF1和ATF2的大肠杆菌培养物中的无细胞提取物不产生丁酸丁酯,但是当检查大肠杆菌SAAT菌株的无细胞提取物时,发现草莓醇酰基CoA转移酶确实利用了丁酰CoA,并且可以生产丁酸丁酯。草莓SAAT利用高浓度丁醇和丁酰CoA的能力表明,它将是在丙酮丁醇梭菌中表达的理想酶。结果表明,ATF2可以在丙酮丁醇梭菌中表达并具有酶促活性,因此证明使用转基因丙酮丁醇梭菌生产酯的可行性。
因此,通过将酰基CoA和醇合成的子模块与AAT生产子模块结合起来在体内进行代谢可以实现一步法合成短链脂肪酸酯。同时,该策略还可以设计生成独特短链酯的组合库,如丁酸乙酯和丁酸丁酯等。但是,尽管可以以合理的水平生产一些短链脂肪酸酯,但使用该策略的酯的终浓度特别低。较低的滴度可能反映了固有底物(酰基CoA和醇)可用性有限,这使得构建体内高短链脂肪酸酯产率的合成途径成为主要挑战[64-65]。
2.2 胞外补充脂肪酶合成短链脂肪酸酯
与催化醇与酰基CoA酯化的醇酰基转移酶不同,脂肪酶催化醇与酸的酯化。在脂肪酶介导的短链脂肪酸酯的生产过程中,醇和酸被用作前体(图3)。通过酯酶进行酯的工业生产通常是在非水系统中使用有机溶剂或高底物浓度进行的[66]。因为化学反应只有在导致吉布斯能量(G)降低的情况下,才能在给定方向上维持通量,而在水相中酯化反应吉布斯自由能变(ΔG)大于0。也就是说,由于反应引起的吉布斯能变(ΔG)必须是负的,酯化反应才成立[67]。因此在脂肪酶介导的短链脂肪酸酯的生产过程中必须添加有机萃取剂,在添加萃取剂后,酯化反应吉布斯自由能变小 于0,说明添加萃取剂后反应可朝正向进行[68]。
目前,基于胞外补充脂肪酶合成短链脂肪酸酯的研究主要集中在丁酸丁酯中。由于梭状芽孢杆菌可以产生用于生产丁酸丁酯的前体,因此,一些研究采用丙酮丁醇梭菌、拜氏梭菌、酪丁酸梭菌与脂肪酶一起产生丁酸丁酯。
2.2.1 基于产丁醇梭菌丙酮-丁醇-乙醇发酵合成丁酸丁酯
在溶剂梭菌丙酮-丁醇-乙醇(acetone-butanol-ethanol, ABE)发酵途径过程中,酸的合成和溶剂的合成依次发生,即溶剂梭菌先合成乙酸和丁酸,然后合成丙酮、丁醇和乙醇,并且在产酸期合成的乙酸丁酸可诱导丁醇合成酶基因的表达并进一步转化成醇。丁醇是一种脂溶性的化合物,过高的浓度会裂解细胞膜,对细胞产生毒性作用,因此在ABE发酵过程中丁醇的浓度都低于20 g/L。过低的丁醇浓度也导致下游丁醇的分离成本过高。因此,若能通过ABE发酵将丁醇进一步衍生为更高附加值的丁酸丁酯,为丁醇的高值化衍生提供新的思路;且丁酸丁酯对细胞没有毒性作用,通过发酵工艺的优化可用于高浓度丁酸丁酯的生物合成[32],因此溶剂梭菌是丁酸丁酯生产的一个极佳平台。
虽然溶剂梭菌在ABE发酵过程中会有丁酸的合成,然而在溶剂合成期,大多数丁酸在醇脱氢酶的作用下会被用于丁醇的合成,这会导致丁酸和丁醇的比例非常低。因此,即使在外源添加脂肪酶的催化下,基于溶剂梭菌发酵产丁酸丁酯的产量也可以忽略不计。克服这一瓶颈的方法是在ABE发酵的指数期或发酵后期向培养基中外源添加丁酸,以维持足够的丁酸和丁醇水平,保证合成丁酸丁酯的化学平衡持续向合成方向进行。另一个问题就是溶剂梭状不能分泌脂肪酶,必须通过添加外源脂肪酶以驱动酯化反应的进行。由于脂肪酶优先在油水界面催化酯化反应,因此必须连续从反应混合物中除去丁酸丁酯,以推动平衡达到合成。为了促进酯化过程,可以在发酵过程中加入无毒的萃取剂,如十六烷,以此提高丁酸丁酯的分配系数。
基于上述想法,Berg等[69]设计了通过耦合溶剂梭菌ABE发酵、脂肪酶催化酯化和原位萃取、以葡萄糖为底物一锅法生产短链酯的原理验证实验。在丙酮丁醇梭菌发酵产ABE的过程中,通过外源添加丁酸、脂肪酶和萃取剂十六烷,可实现将发酵产物丁醇衍生合成丁酸丁酯。最终结果表明:在进行梭菌发酵时产生的丁醇直接酯化为丁酸丁酯,并且通过萃取剂被萃取到上层。十六烷是一种对细胞无毒,并且对丁酸丁酯具有高分配系数的萃取剂,因此即使在发酵液pH值较低和丁醇浓度相对较低的情况下,丁酸丁酯在十六烷中的高分配系数也会将酯化反应拉向产物一侧。最终,该体系可在十六烷相中合成5 g/L的丁酸丁酯,这也是首次报道的基于溶剂梭菌ABE发酵合成丁酸丁酯的研究。虽然丁酸丁酯的产量低于包括反应和分配平衡数学模型的预期数值[70-72],但是一锅法生产短链脂肪酸酯普遍适用于通过原位酯化来克服发酵过程中对酸或醇的产物抑制。并且,其原理可以扩展到更广泛的酯的合成,尤其是一些长链脂肪酸酯。
尽管Berg等[69]通过一锅法增加了丁酸丁酯的浓度,但是,发酵后必须从十六烷中提取丁酸丁酯,而且5 g/L仍不能实现大规模生产。因此,迫切需要能够有效地将有机酸和醇转化为目标酯的新策略和新型生物催化剂。最近,Xin等[73]筛选到一株拥有天然脂肪酶活性的溶剂梭菌菌株BOH3,且溶剂梭菌BOH3可通过ABE发酵合成高浓度的丁醇,并共产核黄素。研究发现,通过外源添加植物油,如橄榄油等可以诱导溶剂梭菌BOH3胞内脂肪酶的表达。因此,在向发酵培养基中外源添加20%的橄榄油的情况下,该菌株可利用木糖直接合成约1.2 g/L的丁酸丁酯,消除了外源脂肪酶的添加。为进一步提高丁酸丁酯的产量,作者优化了萃取剂类型和发酵工艺,最终选择可在培养基中形成乳浊液的Bio-OSR。Bio-OSR对细胞的生物没有毒性,且乳浊液的形成进一步增加了油水的接触面积,增强了脂肪酶的活性。最终,通过优化溶剂梭菌BOH3发酵过程中丁酸和脂肪酶的添加量,通过分批补料发酵(持续补充7.9 g/L的丁酸),在萃取剂柴油中丁酸丁酯的含量提高到22.4 g/L,这是利用溶剂梭菌ABE发酵法合成丁酸丁酯含量的最高报道。溶剂型梭状芽孢杆菌在进行ABE发酵过程中,菌株就会形成芽孢,导致发酵结束,这大大限制了发酵时间,并影响最终丁酸丁酯的合成[69]。将来,若能利用无芽孢形成能力的溶剂梭菌进行ABE发酵,并耦合原位萃取和补料发酵工艺,就可延长发酵时间,进一步提高丁酸丁酯的产量。
2.2.2 基于产丁酸梭菌丁酸发酵合成丁酸丁酯
Spo0A是一种主调节因子,控制溶剂梭菌(如拜氏梭菌)的代谢转移,调节范围涉及芽孢形成革兰氏阳性菌如芽孢杆菌和梭菌的孢子形成、菌落形态、运动和趋化性等。因此,破坏可能导致Spo0A潜在引起细胞生理和代谢模式的重大改变。Spo0A还通过控制溶剂生产所必需的代谢酶表达,参与从产酸期到产溶剂期的代谢转变。如拜氏梭菌中spo0A基因的破坏,会导致在pH控制下生物反应器中细胞的生长情况改变,造成糖吸收和酸积累[56]。基于spo0A突变体有产生丁醇和丁酸的独特能力,其被认为是有希望生产丁酸丁酯的宿主。然而,在发酵过程中的“酸崩溃”会导致糖的不完全利用和细胞代谢的抑制;为了研究spo0A基因破坏在拜氏梭菌中的特定作用,Seo等[56]构建了一个拜氏梭菌spo0A突变体,涉及262 bp基因组DNA片段的缺失,包括启动子区spo0AORF的初始部分,使用基于CRISPR/Cas9的基因组工程。将pH值控制在6.5的分批发酵中,spo0A突变体从60 g/L葡萄糖中积累的丁酸和丁醇分别高达8.96 g/L和3.32 g/L,表现出丁酸和丁醇在高浓度下均会积累spo0A突变体的独特表型。在脂肪酶的存在下,ABE发酵过程中丁酸和丁醇的缩合可形成β-淀粉。在以十六烷为原料的小规模批量提取发酵的初步试验中,在添加脂肪酶CalB的提取剂中,由于丁酸盐的积累,使spo0A突变体遭受酸破坏,因此仅产生98 mg/L丁酸丁酯。为了减轻丁酸的毒性,在双相培养基中添加了10 g/L的CaCO3和5 g/L丁醇。然后在十六烷层中丁酸丁酯的产量增加到2.73 g/L。当进行连续搅拌以增强丁酸丁酯的酯化和萃取时,在十六烷层中获得3.32 g/L的丁酸丁酯。在这项研究中,Seo等[56]成功地证明通过同时进行ABE发酵、浓缩和萃取,拜氏梭菌spo0A突变体可用于丁酸丁酯的生产,但是该收率低于用产生高丁醇的梭状芽孢杆菌获得的浓度。

表2 生物发酵法合成丁酸丁酯的比较
酪丁酸梭状芽孢杆菌(ATCC25755)是一种天然的丁酸盐高产菌,可以产生丁酸,乙酸的产量低到忽略不计,因此具有极高的丁酸丁酯的选择性(91%)。此外,它比其他梭菌具有更高的丁酸耐受性。Zhang等[68]利用该菌进行研究,发现在发酵过程中外源补充脂肪酶和丁醇,并且通过原位酯化可实现丁酸丁酯的高效生产。通过优化提取剂类型,脂肪酶负载量、搅拌、pH和丁醇补充策略后,最终从50 g/L的葡萄糖发酵产生了 34.7 g/L丁酸丁酯。消除副产品和生产高含量丁酸丁酯是有助于提高其丁酸丁酯的生产效率。在该研究中,其获得的丁酸丁酯产量是目前间歇发酵过程中最高的。这个结果证明从低价值碳源生产到可再生丁酸丁酯的绝佳生物学平台的可能性。
2.2.3 基于微生物共培养策略合成短链脂肪酸酯
溶剂梭菌 ABE发酵产生的酯通常集中在丁酸丁酯上,而丙酮通常是主要副产物(占产品的30%)。丙酮不能作为酯化反应的反应物,并且由于其对发动机橡胶部件的腐蚀性和较差的燃油性能,常被视为不良的燃油产品[76]。由于次级醇脱氢酶(secondary alcohol dehydrogenase)的参与,一些梭菌可以产生异丙醇而不是丙酮,相关发酵过程也称为异丙醇-丁醇-乙醇(isopropanol-butanol-ethanol, IBE)发酵。与丙酮相比,异丙醇理论上可以转化为丁酸异丙酯等酯类。拜氏梭菌BGS1是IBE发酵最优的菌株之一,其以葡萄糖为底物时可以生产丁醇(约10.2 g/L)和异丙醇(约3.4 g/L)[77]。因此,拜氏梭菌BGS1可以在南极假丝酵母脂肪酶B的催化下生产酯。当在120 h的培养物中加入50 g/L丁酸钠时(pH 3),可以得到11.0 g/L丁酸丁酯和1.3 g/L丁酸异丙酯。
由于ABE发酵过程不能产生足够的丁酸,需要外源添加丁酸盐,可以构建共培养体系引入另一种菌株来过量生产丁酸。酪丁酸梭菌ATCC 25755可以生产大量的丁酸,因此当两个菌株共培养时,可以得到比拜氏梭菌BGS1单一培养更高的酯浓度。当酪丁酸梭菌ATCC 25755与拜氏梭菌BGS1共培养时,可以最终产生0.2 g/L丁酸异丙酯和5.1 g/L丁酸丁酯。这是关于从IBE发酵和两个梭菌共培养生产丁酸异丙酯的首次报道,其强调脂肪酶和共培养策略在酯生产中的潜在用途[78]。
3 结论
已经有大量研究使用酵母、溶剂梭菌以及工程改造的大肠杆菌等生产短链脂肪酸酯。在这些过程中,醇酰基转移酶和脂肪酶分别催化醇与酰基CoA、醇和酸酯化,产生短链脂肪酸酯。许多研究表明在梭状芽胞杆菌中,丁醇、酰基CoA、丁酸和乙酸等作为代谢物形成,因此这些菌株是生产丁酯的希望宿主,如丁酸丁酯和乙酸丁酯。另一方面,由于野生型大肠杆菌不产生醇和酰基CoA,因此需要在工程菌株中构建合成模块以形成短链脂肪酸酯生产的前体。
工程和/或外部补充的醇酰基转移酶和脂肪酶在这些一锅法中可以正常发挥作用,但迄今获得的酯产量不足以使这些策略取代目前的催化和酶法。为克服这一障碍,有必要通过进化酶工程来提高醇酰基转移酶对醇和酰基CoA的亲和力。对涉及脂肪酶的过程,系统代谢工程可用于优化梭菌的代谢途径,例如,可以适当的前体比例调控生产醇和酸,进一步提高短链脂肪酸酯的产量。利用微生物共培养可以消除底物的添加,通过调节接种时间和比例等,可以实现从头合成丁酸丁酯(图4)。此外,针对廉价碳源、固定化脂肪酶、细胞表面展示技术等方面开展研究,进一步降低短链脂肪酸酯生物合成成本。

图4 共培养酪丁酸梭菌和丙酮丁醇梭菌合成丁酸丁酯Figure 4 Synthesis of butyl butyrateusingco-cultivation of C.tyrobutyricum and C.acetobutylicum

