分枝结构特异性内切酶-1(FEN1)突变体N266D表达纯化及功能分析
邱秀芹,史崔颖,孙洪芳,王晓晓,杜佳慧,郭志刚,刘松柏
(1. 苏州卫生职业技术学院 苏州市检验医学生物技术重点实验室,苏州 215009;2. 南京师范大学 生命科学学院 江苏省分子与医学生物技术重点实验室,南京 210023)
人源分枝结构特异性内切酶-1(Flapendonuclease1,FEN1)是RAD2核酸酶家族中的一员,具有分枝结构核酸内切酶(Flap endonuclease, FEN)、5′核酸外切酶(Exonuclease, EXO)及缺口依赖核酸内切酶(Gap dependent nuclease, GEN)3种活性,DNA复制时在后随链冈崎片段成熟过程中具有不可或缺的重要功能[1-3]。在酵母菌中,敲除FEN1(Rad27)会导致菌体对DNA损伤因子(如紫外线和MMS)高度敏感[4],而FEN1纯合敲除小鼠胚胎致死[5]。另外,将FEN1蛋白的GEN和EXO活性缺失突变体敲入小鼠基因中,导致肺癌发生比率大大增加[6]。
本课题组通过对白血病人基因组的测序,发现了FEN1基因的一种N266D杂合突变体。生物信息学分子结构分析发现,这种突变改变了FEN1蛋白的整体结构,影响了FEN1与DNA底物的亲和性,并可能对其活性产生影响[7]。
本研究构建FEN1突变体N266D的表达载体,表达纯化N266D蛋白。通过研究N266D的核酸酶活性变化情况及对细胞增殖产生的影响,从而探讨FEN1突变体N266D在疾病发生进展中的潜在功能,为进一步阐述FEN1突变与肿瘤发生、治疗之间的关系提供了坚实的理论基础。
1 材料与方法
1.1 供试材料
细胞株:人胚肾上皮细胞系293T细胞,本实验构建的FEN1-WT在PET28载体及M12载体的两个质粒。
1.2 主要试剂和仪器设备
DMEM培养基购自Gbio;胎牛血清购自SERANA,胰酶均购自Hy-Clone公司;Lipofectamine 2000购自Invitrogen;LB培养基购自索莱宝;质粒提取试剂盒购自天根;蛋白纯化试剂盒购自碧云天;引物及活性检测底物oligo由金斯瑞公司合成;细胞超声破碎仪购自珀西瓦尔;His-tag抗体购自金斯瑞公司;山羊抗小鼠抗体(HRP)购自碧云天生物公司;xCELLigence无标记细胞功能分析仪系统购自艾森生物公司。
1.3 方法
1.3.1FEN1-N266D表达重组质粒构建及蛋白表达纯化
设计合成扩增FEN1-N266D序列的上游引物:5′-GTGCGGCGACTTGACCCCGACAAGTACCCTGTGCCAGA-3′和下游引物:5′-TCTGGCACAGGGTACTTGTCGGGGTCAAGTCGCCGCAC-3′,以实验室构建的野生型FEN1-WT质粒(PET28载体)为模板,98 ℃ 预变性2 min;98 ℃ 变性10 s,56 ℃ 退火20 s,72 ℃ 延伸12 s,25个循环;72 ℃再延伸10 min。经剪接、连接、转化TOP10菌、筛选、鉴定、扩增,获得FEN1-N266D表达重组质粒。
将FEN1-WT、FEN1-N266D表达重组质粒分别转化BL21大肠杆菌,挑取单克隆菌落分别至含30 μg/mL卡那霉素的3 mL LB培养液,37 ℃、160 r/min摇床培养8 h,将菌液分别转置含30 μg/mL卡那霉素的300 mL LB,37 ℃、160 r/min,继续培养2 h;当菌液OD600≈0.5时,加入3 mL IPTG(终浓度1 mmol/L),25 ℃、160 r/min继续培养10 h;5 000 r/min、10 min离心收集菌体,重悬后超声破碎细胞、离心后取上清液及沉淀,SDS-PAGE电泳分析。因为FEN1-WT及FEN1-N266D蛋白的N端均含有His标签,因此根据蛋白纯化试剂盒说明将上清液与镍柱结合及咪唑洗脱(1 mol/L)操作步骤,分别纯化FEN1-WT和FEN1-N266D蛋白,并通过Western Blot 得到确认,具体步骤参考文献[7]。
1.3.2 FEN1的3种酶活性检测
TAMRA标记的DNA底物制备。根据FEN1具有的FEN、GEN和EXO 3种酶活性,参照已发表文献中的方法设计10个DNA寡核苷酸链[8],见表1。分别将单链 DNA各自按照比例在退火缓冲液(20 mmol/L Tris,pH 7.5,50 mmol/L NaCl,1 mmol/L MgCl2)中混合均匀,95 ℃水浴1 min,72 ℃水浴10 min,然后关掉热源开关,自然冷却至室温,由此得到3种完整的 DNA双链底物。
核酸酶活性检测。核酸酶活性检测参考本课题组已发表的文章[9]。一定量的FEN1蛋白在反应缓冲液(100 mmol/L HEPES-KOH pH 7.5,55 mmol/L KCl,5 mmol/L MgCl2,1 mmol/L DTT,0.1 mmol/L EDTA,2 mmol/L ATP,0.5 mmol/L-βNAD,20 μmol/L dNTP,5 mmol/L Phosphocreatine,200 U/mL Phosphocreatine kinase)中与 500 fmol的DNA底物在10 μL进行反应。反应温度为 37 ℃,时间30 min。反应结束后加20 μL 2×终止缓冲液终止反应,100 ℃水浴10 min。取反应后的样品5 μL加到制备好的非变性12%丙烯酰胺胶以12 W功率分离60 min。电泳结束通过荧光成像仪进行观察(Odyssey Fc成像仪,Gene公司),实验进行了3次重复。
1.3.3 RTCA检测细胞增殖
FEN1-WT和FEN1-N266D表达重组质粒(M12载体)分别转染293T细胞,6 h后更换新鲜培养基。继续培养48 h后收集转染细胞并计数,将细胞浓度调至5×104个/mL,取出 E-Plate 96板,在孔中加入100 μL 混合均匀的293T细胞悬液,密度为每孔中细胞数目为 5 000细胞,每个样品组3个复孔,室温放置30 min后,E-Plate 96 板放到培养箱中的 RTCA Station 上连续培养96 h检测细胞增殖曲线,实验进行了3次重复。
2 结果及分析
2.1 白血病患者中发现FEN1-N266D杂合突变体
分离白血病患者骨髓标本中单个核细胞,提取患者基因组DNA,同时利用患者正常皮肤组织提取基因组DNA,分别设计引物对FEN1编码区进行PCR扩增、Sanger法测序,发现了一例患者中存在c.A796G:p.N266D杂合突变体(图1)。

c.A796G:p.N266D(正向引物测序)。图1 FEN1基因点突变Figure 1 FEN1 site mutation
2.2 N266D突变体蛋白结构分析
基于人源FEN1蛋白在NCBI网站上的晶体结构(PDB:3Q8K),将266位天冬酰胺(N)替换为天冬氨酸(D)并利用生物信息学软件PyMol对突变体蛋白结构进行比较分析。结合Tsutakawa等对FEN1晶体结构的解析、研究结果,发现N266位点位于环状灵活移动区域(R262-W274)的顶端,负责与DNA底物结合;N266D突变导致氨基酸带负电荷,并与紧邻的K267相互吸引,对DNA底物可能造成排斥现象(图2)。因此,推测N266D突变可能会影响FEN1的活性及功能[7]。

图2 FEN1-N266D结构图Figure 2 FEN1-N266D protein structure
2.3 FEN1-N266D表达重组质粒构建及蛋白表达纯化
以FEN1-WT原核表达载体为模板,应用设计的点突变引物,构建FEN1-N266D表达重组质粒。将FEN1-WT和FEN1-N266D质粒分别转化至大肠杆菌BL21菌株,IPTG 诱导表达,收集菌体,提取、纯化FEN1-WT、FEN1-N266D蛋白,通过SDS-PAGE电泳检测蛋白,发现成功表达FEN1-WT和FEN1-N266D蛋白(图3)。
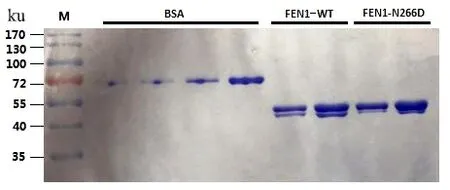
图3 纯化的FEN1-WT和FEN1-N266D蛋白Figure 3 Purified FEN1-WT and FFN1-N266D proteins
2.4 核酸酶活性检测
采用荧光素TAMRA标记的DNA底物检测FEN1-WT、FEN1-N266D蛋白的分枝结构核酸内切酶(FEN)、5′核酸外切酶(EXO)、缺口依赖核酸内切酶(GEN) 3种酶活性。结果显示,与FEN1-WT野生型蛋白相比,FEN1-N266D突变体蛋白的活性未发现有明显的变化(图4),说明N266D突变体结构变化未对其核酸酶活性造成明显影响。

(a)FEN底物及活性检测结果;(b)GEN底物及活性检测结果;(c)EXO底物及活性检测结果。图4 FEN1-WT和FEN1-N266D蛋白的3种酶活性比较Figure 4 Comparison of three nuclease activities between FEN1-WT and FEN1-N266D
2.5 FEN1-N266D突变体对细胞增殖的影响
FEN1-WT和FEN1-N266D表达重组质粒(M12载体)分别转染293T细胞,然后利用RTCA方法检测96 h内细胞增殖的曲线(图5),与转染FEN1-WT野生型质粒相比,转染FEN1-N266D表达重组质粒的细胞增殖能力受到明显抑制。由于体外核酸酶活性检测结果显示突变体没有发生明显的活性变化,因此推测N266D突变体引起细胞增殖能力受损的原因可能与活性外其他因素(如与其他蛋白质相互作用、翻译后修饰等)有关,也可能因为细胞内突变体核酸酶活性在复杂环境影响下受到影响并进一步对细胞的正常代谢活动产生了影响,具体分子机制有待进一步研究分析。

图5 RTCA法检测转染FEN1-WT和FEN1-N266D表达重组质粒的293T细胞增殖情况Figure 5 RTCA method to determine 293T cell proliferation capacities transfected with FEN1-WT and FEN1-N266D plasmids
3 讨论与结论
FEN1作为DNA复制及DNA修复过程中不可或缺的参与者,在维护基因组稳定和完整性方面具有不可替代的作用[10-12]。一旦FEN1在细胞内发生异常表达或突变,细胞将处于危险状态。本研究对白血病患者中发现的FEN1-N266D杂合突变体进行了蛋白结构、核酸酶活性的分析检测,并研究了N266D突变体对细胞增殖能力的影响,完成了对N266D突变体的多方面特征鉴定。
多项研究显示,肿瘤细胞癌变过程中涉及很多蛋白的异常表达。FEN1作为DNA复制过程中的关键蛋白,在很多肿瘤细胞中都表达升高。例如,利用肿瘤特征检测试验比较正常组织和肿瘤组织,Singh等[13]发现FEN1在乳腺癌、子宫癌、肾癌、卵巢癌以及结肠癌组织中的mRNA含量升高,而且进一步研究发现结肠癌组织中mRNA含量升高的原因在于FEN1启动子区域甲基化丢失。利用全基因特征分析检测发现,FEN1在胰腺癌中表达水平也有上调,因此是肿瘤检测的潜在标志物及药物靶点[13]。另外,在肿瘤细胞中,由于DNA的快速合成以及细胞的快速生长,DNA持续暴露在损伤压力的环境中,DNA修复基因的缺失往往会使肿瘤细胞更加脆弱,更容易凋亡。有证据表明,FEN1表达量低的乳腺癌细胞更加容易发生凋亡,FEN1表达缺陷的胶质瘤细胞系也对甲基化试剂更加敏感[14-15]。尽管FEN1在肿瘤细胞中的表达水平常常出现异常,但FEN1基因体细胞突变或遗传突变事件在人体细胞中却很少发生。本课题组在具有乳腺癌家族病史的病人中发现了FEN1基因的一种突变体E359K,通过进一步的活性研究,发现突变体E359K虽然仍保留FEN活性,但是GEN活性基本丧失;另外发现含有E359K突变体的小鼠胚胎成纤维细胞(mouse embryonic fibroblast, MEF)对DNA损伤因子更加敏感,DNA修复所需时间更长[16],这为研究FEN1突变体对细胞正常功能的影响作用奠定了基础。
本研究在白血病患者样本中发现的N266D突变体,从蛋白结构上看影响了FEN1与DNA底物的亲和性,但从活性检测结果来看并未对活性产生明显的影响;在293T细胞中过表达N266D蛋白后发现突变体抑制了细胞的正常增殖能力,推测N266D主要通过活性外其他因素(如与其他蛋白质相互作用、翻译后修饰等)对细胞的正常代谢活动产生了影响,这为后续进一步研究N266D乃至其他FEN1突变在正常细胞或肿瘤细胞中的功能及相应分子机制奠定了基础。

