急性缺血性脑卒中患者血清SDF-1、UCH-L1水平变化及其与病情程度和预后的关系
高靖,王秀艳,杨红梅,王玉珍,张会芬
1开滦总医院全科医学科,河北唐山063000;2开滦总医院检验科
急性缺血性脑卒中(AIS)是各种原因导致脑动脉供血严重障碍甚至中断,继而引起脑组织缺血、缺氧性坏死,从而出现相应神经功能缺失的一组急性脑血管病[1]。虽然近些年超早期溶栓治疗取得了明显进展,但由于受治疗时间窗限制,大多数AIS患者神经元坏死不可避免,神经血管网络不能重建。因此,及时评估AIS病情程度对治疗方案选择和预后判断具有重要意义。有研究认为,炎症反应在AIS的发生、发展中扮演重要角色[1]。基质细胞衍生因子1(SDF-1)是一类具有趋化活性的细胞因子,能够参与或调控多种生物学过程,如炎症反应、神经发育、血管生成等[2]。有研究报道,颅脑损伤患者血清SDF-1水平显著升高[3]。泛素羧基末端水解酶1(UCH-L1)是泛素—蛋白酶体系统中的一种重要去泛素化酶,在神经系统中广泛分布,能够参与脑损伤后神经再生修复[4]。有研究报道,颅脑损伤患者血清UCH-L1水平明显升高,并且其水平变化与病情程度密切相关[5]。但目前SDF-1、UCH-L1在AIS发生、发展中的作用尚不清楚。2019年1月—2020年12月,本研究观察了AIS患者血清SDF-1、UCH-L1水平变化,并探讨其水平与病情程度和预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择同期开滦总医院收治的AIS患者118例(观察组)。AIS临床诊断依据《中国急性缺血性脑卒中诊治指南(2014)》[6]。纳入标准:①符合AIS诊断标准;②初次发病;③发病至入院时间<24 h;④临床资料完整。排除标准:①存在感觉、认知功能障碍者;②既往有脑卒中史者;③合并恶性肿瘤者;④伴有血液、免疫等系统疾病者;⑤合并重要脏器严重功能障碍者。其中,男66例、女52例,年龄(64.54±4.85)岁。同期选择在开滦总医院体检健康的志愿者100例(对照组),男56例、女44例,年龄(65.21±4.63)岁。两组性别、年龄具有可比性。本研究经开滦总医院医学伦理委员会批准(审批文号:G201812-016),患者或其家属知情同意。
1.2 血清SDF-1、UCH-L1检测 AIS患者入院4 h内,对照组体检当日,采集清晨空腹肘静脉血5 mL,3 500 r/min离心10 min、离心半径13 cm,留取上层血清,-80℃冰箱保存待检。采用酶联免疫吸附法检测血清SDF-1、UCH-L1。
1.3 资料收集与分析 收集AIS患者基本临床资料、入院4 h内病情程度相关资料及出院3个月预后情况。其中,基本临床资料包括性别、年龄、高血压史;病情程度相关资料包括梗死面积、美国国立卫生研究院卒中量表(NIHSS)评分[7]、格拉斯哥昏迷量表(GCS)评 分[8];预 后 评 估 采 用 改 良Rankin量 表(mRS)评分[9],以mRS评分≤2分为预后良好、mRS评分>2分为预后不良。分析血清SDF-1、UCH-L1水平与AIS患者临床特征和短期预后的关系。
1.4 统计学方法 采用SPSS23.0统计软件。计量资料经K-S检验符合正态分布,以±s表示,结果比较采用独立样本t检验。计数资料比较采用χ2检验。相关性分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清SDF-1、UCH-L1水平比较 观察组血清SDF-1、UCH-L1水平分别为(144.02±14.90)、(0.48±0.12)μg/L,对 照 组 分 别 为(100.10±15.50)、(0.14±0.02)μg/L。观察组血清SDF-1、UCH-L1水平均高于对照组(t分别为21.291、28.932,P均<0.05)。
2.2 血清SDF-1、UCH-L1水平与AIS患者临床特征和短期预后的关系 血清SDF-1、UCH-L1水平与AIS患者临床特征的关系见表1。AIS患者梗死面积为(4.65±0.53)cm2,NIHSS评分为(17.25±4.74)分,GCS评分为(8.14±2.47)分,mRS评分为(3.24±1.01)分。Pearson相关分析显示,AIS患者血清SDF-1水平与梗死面积、NIHSS评分、GCS评分、mRS评分均呈正相关关系(r分别为0.386、0.429、0.443、0.422,P均<0.05),血清UCH-L1水平与梗死面积、NIHSS评分、GCS评分、mRS评分亦呈正相关关系(r分别为0.392、0.453、0.467、0.443,P均<0.05)。
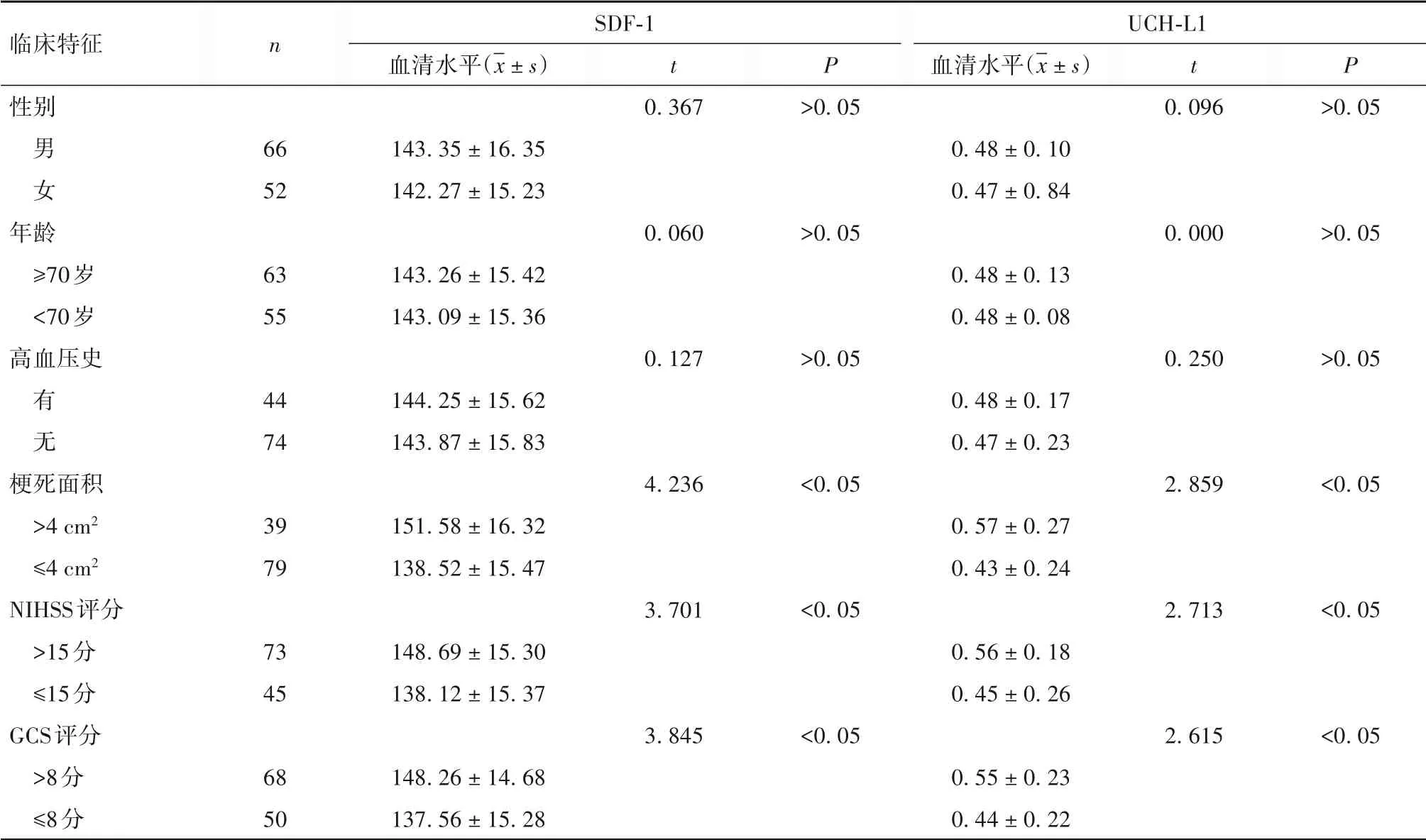
表1 血清SDF-1、UCH-L1水平与AIS患者临床特征的关系(μg/L)
2.3 AIS患者预后良好者与预后不良者血清SDF-1、UCH-L1水平比较 AIS患者出院3个月,预后良好88例、预后不良30例。AIS患者预后良好者与预后不良者血清SDF-1水平分别为(139.12±13.01)、(158.37±10.07)μg/L,血清UCH-L1水平分别为(0.45±0.11)、(0.58±0.10)μg/L。AIS患者预后良好者血清SDF-1、UCH-L1水平均低于预后不良者(t分别为7.377、5.805,P均<0.05)。
3 讨论
有研究认为,炎症反应在AIS的发生、发展中扮演重要角色[1]。SDF-1又称趋化因子CXCL12,是一种由骨髓间充质干细胞衍生的炎症性趋化因子,可表达于骨髓来源的间充质干细胞、小胶质细胞、星形胶质细胞、神经元及各种祖细胞表面,能够特异性结合受体CXCR4,形成SDF-1/CXCR4生物学轴,继而参与炎症反应、骨髓间充质干细胞动员/归巢和血管生成等多种生物学过程[2]。有研究报道,脑组织缺血可诱导CXCL12表达,与其受体CXCR4结合后能够促使缺血部位炎症因子表达,加重组织损伤[10]。ZHANG等[11]研究发现,脑卒中患者缺血半暗带区域CXCL12表达明显升高,但随着病情好转,CXCL12表达逐渐降低。本研究结果发现,观察组血清SDF-1水平明显高于对照组,表明SDF-1可能参与AIS的发生、发展。本研究还发现,AIS患者血清SDF-1水平与梗死面积、NIHSS评分、GCS评分密切相关,而与性别、年龄、高血压史无关;进一步研究发现,AIS患者血清SDF-1水平与梗死面积、NIHSS评分、GCS评分、mRS评分均呈正相关关系。提示血清SDF-1水平与AIS病情程度和患者预后密切相关,与ZHANG等[11]报道一致。我们推测,AIS患者血清SDF-1水平升高能够加重组织炎症损伤,从而导致病情加重。骨髓间充质干细胞是一类具有自我更新、高度增殖和多向分化潜能的细胞,能够促进脑卒中患者血管再生和神经功能改善[12]。有研究发现,CXCR4拮抗剂能够干扰骨髓间充质干细胞迁移,致使新生神经元无法迁移至缺血区,而增加缺血区SDF-1表达能够募集CXCR4和骨髓间充质干细胞至缺血区[13]。由此认为,AIS患者血清SDF-1水平升高可能是一种机体代偿性反应,通过结合CXCR4修复缺血组织。但既往亦有研究报道,SDF-1/CXCR4生物学轴能够加重组织损伤[14]。因此,SDF-1在AIS发生、发展中的具体作用仍有待于进一步研究证实。
UCH-L1是一种高度富集于中枢神经系统的神经元胞质去泛素化酶,与突触可塑性和稳态以及脑损伤后自我修复有关。UCH-L1在神经元中大量存在并被特异性释放,被认为是一种神经元组织学标志物[4]。有研究报道,UCH-L1可通过干预神经母细胞发育、分化,调控胚脑组织神经产生过程,与神经功能缺损密切相关[15]。RAMEZANI等[16]研究报道,创伤性颅脑损伤患者血清UCH-L1水平明显升高,并且其水平越高,患者病情越重。本研究结果发现,AIS组血清UCH-L1水平明显高于对照组,表明UCH-L1可能参与AIS的发生、发展。本研究还发现,AIS患者血清UCH-L1水平与梗死面积、NIHSS评分、GCS评分密切相关,而与性别、年龄、高血压史无关;进一步研究发现,AIS患者血清UCH-L1水平与梗死面积、NIHSS评分、GCS评分、mRS评分均呈正相关关系。提示血清UCH-L1水平与AIS病情程度和患者预后密切相关。NF-κB是调控炎症信号的重要转录因子。有研究报道,UCH-L1可通过内源性抑制剂NF-κB抑制蛋白α去泛素化激活NF-κB信号通路[17]。由此推测,UCH-L1可能通过增强炎症反应参与AIS的发生、发展。但UCH-L1在AIS发生、发展中的具体作用机制仍需进一步研究。
综上所述,AIS患者血清SDF-1、UCH-L1水平与病情程度呈正相关关系,二者水平越高,AIS病情越重,预后越差。

