妊娠期糖尿病与胎儿胸腺发育的相关性研究
温慧芳,邱佩嫦,马明霞,梁永晴
(1广州医科大学附属第六医院<清远市人民医院>妇产科B超室 广东 清远 511500)
(2广州医科大学附属第六医院<清远市人民医院>生殖中心 广东 清远 511500)
(3广州医科大学附属第六医院<清远市人民医院>病案统计室 广东 清远 511500)
胸腺发生于胚胎第9周,在第20周左右发育成熟,已具备正常胸腺结构,是人体出现最早的免疫器官[1]。胸腺来源于中胚层和外胚层,成形始于第三鳃裂,胚胎后期及初生时,人胸腺约重10~15 g。胸腺位于胸骨后方胸腔前纵隔,形态欠规则,其主要功能是产生T淋巴细胞和产生、分泌胸腺素及激素类物质,是免疫系统的中枢,是重要的内分泌器官[2]。
既往研究表明,胎儿胸腺发育不良或缺如与多种疾病有关,例如22q11.2微缺失综合征、绒毛膜羊膜炎、妊娠期高血压等[3-5]。在生长受限的胎儿、唐氏综合征胎儿和胎膜早破的情况下,胎儿胸腺也较小[6-7]。有学者研究表明通过胸腺-胸廓比(thymic-thoracic ratio, T-T)评价胎儿胸腺大小较测量胸腺周长、体积等操作方法简便、可行,且该值与孕周无相关性[8-9]。产前诊断胸腺发育不良有助于诊断相关疾病和评价胎儿出生后的免疫状态。
妊娠期糖代谢紊乱是孕期常见的疾病,母体高血糖增加了不良妊娠结局的风险,例如巨大胎儿、剖宫产、新生儿低血糖和早产,死胎率也较高。妊娠期糖尿病诊断指南推荐口服葡萄糖耐量试验(oral glucose tolerance test, OGTT),75 g OGTT诊断标准:空腹及服糖后1~2 h的血糖值分别为5.1 mmol/L、10.0 mmol/L、8.5 mmol/L,任何一点血糖值达到或超过上述标准即诊断为妊娠期糖尿病[10]。随着产前检查的普及,以及我国二胎开放,高龄孕妇增多等因素,越来越多的孕妇被诊断出妊娠期糖尿病。
有外国学者研究称,与非糖尿病组相比,糖尿病孕妇胎儿的胸腺体积较小[11]。在我国尚未有妊娠期糖尿病与胎儿胸腺发育相关性的报道,本研究的目的是比较妊娠期糖尿病孕妇与血糖正常组孕妇的胎儿胸腺发育情况,以胸腺-胸廓比(T-T值)及胸腺-头围比(T-H值)做比较,探索妊娠期糖尿病与胎儿胸腺发育的相关性,为评价胎儿胸腺的发育情况提供资料,给临床预测胎儿的免疫力及发生不良预后的风险性提供依据。
1 资料与方法
1.1 一般资料
选取2020年3月—10月在我院进行产前超声检查的孕妇共328名,入组标准:月经周期规则,孕前健康状态良好;孕期无合并其他疾病;孕龄20~39周,胎儿大小与孕周相符;单胎妊娠;行胎儿Ⅲ级产前超声筛查无结构异常;高龄孕妇或唐氏高风险者行胎儿染色体核型分析未发现异常;胎盘、脐带、羊水无异常;配合行OGTT检查。排除标准:孕妇患有除妊娠期糖尿病以外的妊娠并发症;胎儿有结构、软指标异常或染色体异常;胎儿附属物异常;资料缺失或失访者。收集入组孕妇的基线资料,包括年龄、测量时孕周、体质指数(body mass index, BMI)、孕产次数等。根据OGTT结果,将研究对象中妊娠期糖尿病者纳为研究组(91名),血糖正常者为对照组(237名)。入组孕妇年龄18~47岁,平均(29.3±4.7)岁,孕20.6~38.6周,平均(28.0±4.3)周。两组孕妇年龄、测量时孕周、BMI及孕产次数均无统计学差异(P>0.05)。本次研究目的、内容及流程已经上交伦理委员会进行审核,并获得了研究批准(伦理审批号:IRB-2020-011)。所有参与者均自愿签署知情同意书。
1.2 方法
采用GE Voluson E8及GE-730pro彩色多普勒超声诊断仪,选择经腹凸阵探头,频率为2.5 MHz~5.0 MHz。入选孕妇均行胎儿Ⅲ级产前超声筛查,排除胎儿结构畸形及附属物异常等,均由同一个研究者完成数据测量,于三血管-气管(3VT)切面详细观察胎儿胸腺大小、形状特征,胸腺位于前上纵隔内,前缘紧贴胸骨,后缘临近主动脉,表现为一不规则“四边形”低回声实质性结构,测量胸腺的前后径即胸骨后缘至主动脉前缘的距离为T1,胸廓内前后径即胸骨后缘至椎体前缘的距离为T2,二者之比即为胸腺-胸廓比(T-T值),另外,计算胸腺前后径(T1)与胎儿头围(HC)之比作为胸腺头比(T-H值)。T1、T2测量如图1。
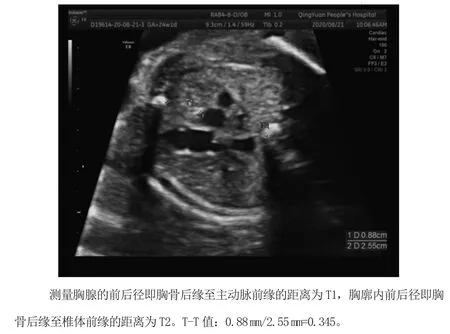
图1 T1、T2的测量
1.3 统计学方法
用SPSS 21.0统计学软件进行数据收集及分析,计量资料采用()进行统计描述,用两样本t检验比较有糖尿病组和无糖尿病组间T-T值和T-H值是否有差异,绘制散点图,观察T-T值与孕周的相关性以及T-H值与孕周的相关性,并进行Spearman秩相关分析。检验水准为P<0.05为差异有统计学意义。
2 结果
2.1 研究组与对照组T-T值、T-H值比较
妊娠期糖尿病孕妇胎儿T-T值小于血糖正常孕妇(t=14.00,P<0.001)。研究组胎儿T-T值为(0.325±0.017),对照组为(0.357±0.021)。
妊娠期糖尿病孕妇胎儿T-H值小于血糖正常孕妇(t=8.50,P<0.001)。研究组胎儿T-H值为(0.038±0.002),对照组为(0.040±0.002)。见表1。
表1 研究组与对照组间T-T值、T-H值比较()
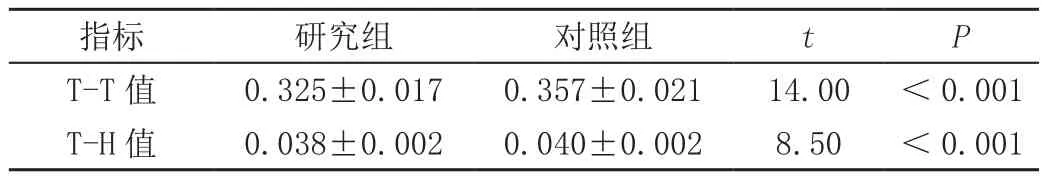
表1 研究组与对照组间T-T值、T-H值比较()
指标 研究组 对照组 t P T-T值 0.325±0.017 0.357±0.021 14.00 <0.001 T-H值 0.038±0.002 0.040±0.002 8.50 <0.001
2.2 T-T值与孕周的相关性
胎儿T-T值随孕周变化的散点图见图2;我们发现,T-T值在孕20~39周时较恒定,与孕周无明显相关性(rs=-0.079,P=0.152)。
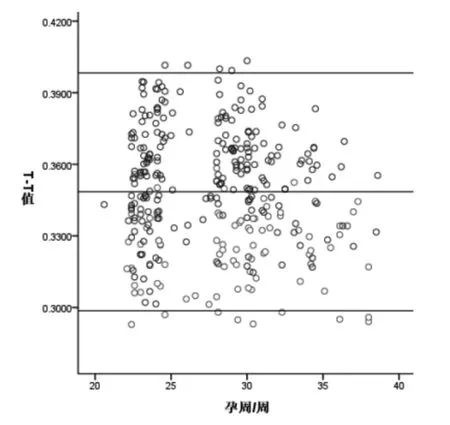
图2 孕18~39周对照组及研究组胎儿T-T值随孕周变化的散点图
2.3 T-H值与孕周的相关性
T-H值随孕周变化的散点图见图3。结果显示,T-H值随着孕周增长而增大,与孕周呈正相关(rs=0.162,P=0.003)。
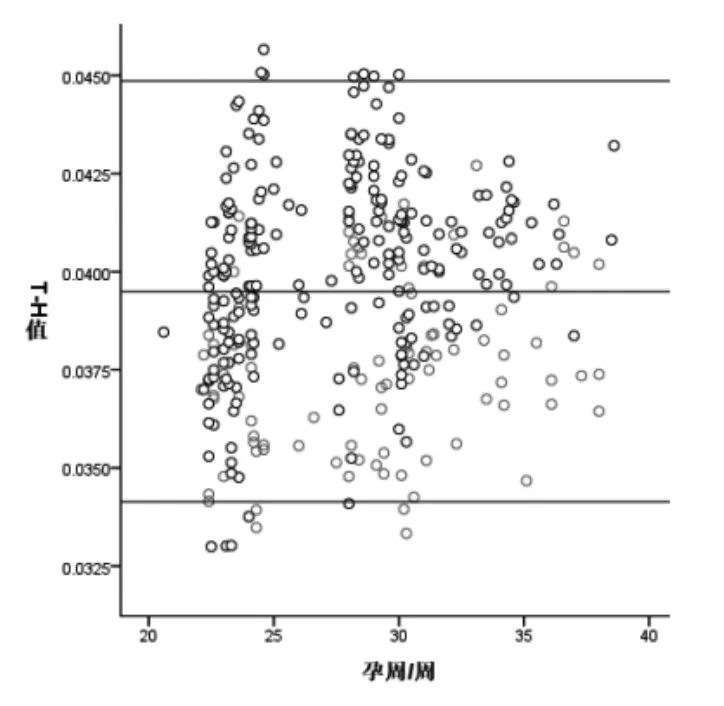
图3 孕18~39周对照组及研究组胎儿T-H值随孕周变化的散点图
2.4 孕妇BMI对胎儿T-T值、T-H值的影响
BMI对胎儿T-T值无线性影响(P=0.521),而对胎儿T-H值有线性影响(P=0.039)。
3 讨论
胸腺作为免疫器官,其发育情况直接关系到胎儿免疫力的高低及其预后。随着我国生活条件和医疗水平的快速提高,优生优育成为社会及每个家庭的基本需求,产前检查得到普及,对产前诊断能力的要求与日俱增。近年来我国二孩政策全面放开,高龄及高危孕妇数量猛增,妊娠期糖尿病的孕妇数量居高不下,加上产前OGTT的规范普及,妊娠期糖尿病检出率明显上升,其胎儿的胸腺发育情况是我们及孕妇所关心的问题之一。在本研究中,测量胸腺的前后径和胸廓内前后径,以建立T-T值,此外,我们探讨了一个常用且简单的数据:头围,定义T-H值,揭示了T-H值也是鉴别两个研究组之间差异的一个有用的参数。
据研究结果,我们发现,妊娠期糖尿病孕妇的胎儿胸腺比未合并妊娠期糖尿病孕妇的胎儿胸腺较小。其原因可能是复杂的,Pearse等人[12]研究发现,应激相关的早期胸腺组织病理学改变始于皮质淋巴细胞的凋亡和巨噬细胞的清除,随后皮质细胞减少,特征是皮质变薄、消失,正常皮质髓质界限模糊,这在胸腺组织学上被描述为“星空”模式[13]。孕妇的葡萄糖代谢疾病可能是胎儿应激因素。葡萄糖过量引起的氧需求增加与氧转移能力有限“糖尿病胎盘”的结合导致胎儿应激的不良循环。此次研究发现,T-T值与孕周无明显相关性,而T-H值则与孕周呈正相关,原因可能是胎儿的生长发育有阶段性,脑部在早中孕期发育迅猛,头围增长迅速,而在晚孕期发育较早中孕期速度减缓,头围增长速度减慢,而胎儿胸围及腹围却在晚孕期发育呈加速状态,胸腔前后径发育加快,胸腺前后径也会随之增长加速,从而导致胸腺与头围比值在发育过程中与孕周呈正相关。这与德国学者Ria Dörneman等人的研究孕周对TH比无影响结论[14]稍有差别,其原因可能是人群差异或研究方法的区别。
此外,我们还发现T-T值不受孕妇BMI的影响,T-T值显示出比BMI和T-H值更明显的预后影响。胎儿T-T值越低,孕妇患妊娠期糖尿病的概率越大,表明胎儿胸腺大小与母体血糖代谢有关。胸腺和糖尿病之间的病理生理相互作用尚未得到充分研究,糖尿病是结果还是原因还需进一步研究探讨。妊娠期糖尿病的早期诊断对优化母儿预后具有重要意义。妊娠期糖尿病的诊断标准OGTT常规是在妊娠24~28周进行,如果出现高危因素,OGTT应该更早。基于我们的研究,T-T值或T-H值的测量可以检测出葡萄糖代谢紊乱风险增加的孕妇,可疑胸腺比率或许可作为提前行OGTT的指标。另外,T-T值、T-H值还可以作为妊娠晚期糖尿病检测的附加评估指标。胎儿胸腺测量将有助于糖尿病孕妇的管理以及预测胎儿出生后的健康状态。
本研究的数据均来源于同一个研究者的测量数据,每组数据测量三次取其平均值,在一定程度下减少测量误差。严格制定研究对象的入组标准以及排除标准,对孕妇的基线资料进行对比,两组孕妇除OGTT结果不同外,在年龄、测量时孕周、BMI,孕产次等基线资料有一致性,无统计学差异,排除了其他因素引起的胸腺比率差异。下一步考虑进一步扩大研究样本量,收集胎儿出生时及产后健康状况,以期能获得更加确切的研究结论及胸腺比率大小对母婴预后的影响。
综上所述,通过测量胎儿胸腺-胸廓比和胸腺-头围比,可较简单方便地评价胎儿胸腺发育情况,值得推广应用。本研究表明,与血糖正常孕妇相比,妊娠期糖尿病孕妇的胎儿胸腺较小,即胎儿胸腺发育与妊娠期糖尿病具相关性。

