卵巢恶性畸胎瘤的超声诊断价值
郑园园,潘姣娥,王军梅
(浙江大学医学院附属妇产科医院超声科 浙江 杭州 310006)
卵巢恶性畸胎瘤主要包括未成熟畸胎瘤和成熟畸胎瘤恶变,前者约占卵巢畸胎瘤的1%~3%,后者约占卵巢畸胎瘤的2%~4%[1]。由于良、恶性畸胎瘤的生物学特征、治疗方案及预后等存在较大差异,故术前准确诊断尤为重要。本研究回顾性分析22例卵巢恶性畸胎瘤的超声特征,以提高术前诊断准确率。
1 资料与方法
1.1 一般资料
收集2016年5月—2020年12月于浙江大学医学院附属妇产科医院住院并经手术病理确诊的22例卵巢恶性畸胎瘤的病例资料,均有完整的超声图像及报告。患者年龄15~52岁,中位年龄27岁;其中育龄期(20~40岁)患者20例(20/22,90.9%),>40岁患者2例(2/22,9.1%),均为绝经后妇女。22例患者多因下腹痛和(或)腹胀、发现盆腔占位而就诊,2例绝经后阴道流血,2例合并妊娠。其中,病理诊断为未成熟畸胎瘤19例(19/22,86.4%),患者年龄15~34岁,中位年龄27岁,多为育龄期妇女;病理诊断为成熟畸胎瘤恶变3例(3/22,13.6%),其中育龄期妇女1例,绝经后妇女2例。19例未成熟畸胎瘤患者中,甲胎蛋白(AFP)升高8例(8/19,42.1%),糖链抗原125(CA125)升高8例(8/19,42.1%),糖链抗原199(CA199)升高2例(2/19,10.5%);3例成熟畸胎瘤恶变患者中,AFP均正常,CA199升高1例。
1.2 仪器与方法
1.2.1 仪器 采用GE Voluson E8、E10及SAMSUNG XW80A型彩色多普勒超声诊断仪,腹部探头频率1 MHz~4 MHz,腔内探头频率5 MHz~10 MHz。
1.2.2 检查方法 22例患者术前均行盆腔超声检查,其中经腹部检查8例,经阴道检查14例。患者取仰卧位或截石位,连续多切面扫查并记录子宫及双侧卵巢形态及大小,观察肿块的大小、形态、分隔、内部回声、血流情况、包膜、边界及毗邻关系等。按照Yamaoka等[2]评估方法,将22例患者的声像图分为实性为主型(实性部分体积>2/3)、囊性为主型(囊性部分体积>2/3)和囊实混合型(囊性部分体积介于前两者之间)。按照Kurjak等[3]评估附件区肿块的血流分级方法,将彩色多普勒血流分为3级:0级,肿块内部及周边均无明显血流信号;Ⅰ级,实性部分可见点状、短线状血流信号或囊内分隔上、囊壁上可见血流信号;Ⅱ级,实性部分可见树枝状、网状血流信号,伴或不伴囊内分隔上、囊壁上可见血流信号。
2 结果
22例卵巢恶性畸胎瘤术前声像图均表现为囊实性包块,包块直径4~23 cm不等,≥10 cm者12例(12/22,54.5%),形态均不规则,其中囊性为主型7例(7/22,31.8%)、囊实混合型11例(11/22,50%)、实性为主型4例(4/22,18.2%)。囊性部分多房分隔,隔膜厚薄不均,内液欠清或稍稠,或呈云雾状回声,或可见短线状回声,或可见细小光点漂浮;实性部分回声杂乱,内部回声强弱不均,或呈强光团,部分内可见暗区,部分后方回声明显衰减。彩色多普勒血流分级:0级2例(2/22,9.1%)、Ⅰ级12例(12/22,54.5%)、Ⅱ级8例(8/22,36.4%)。详见表1。
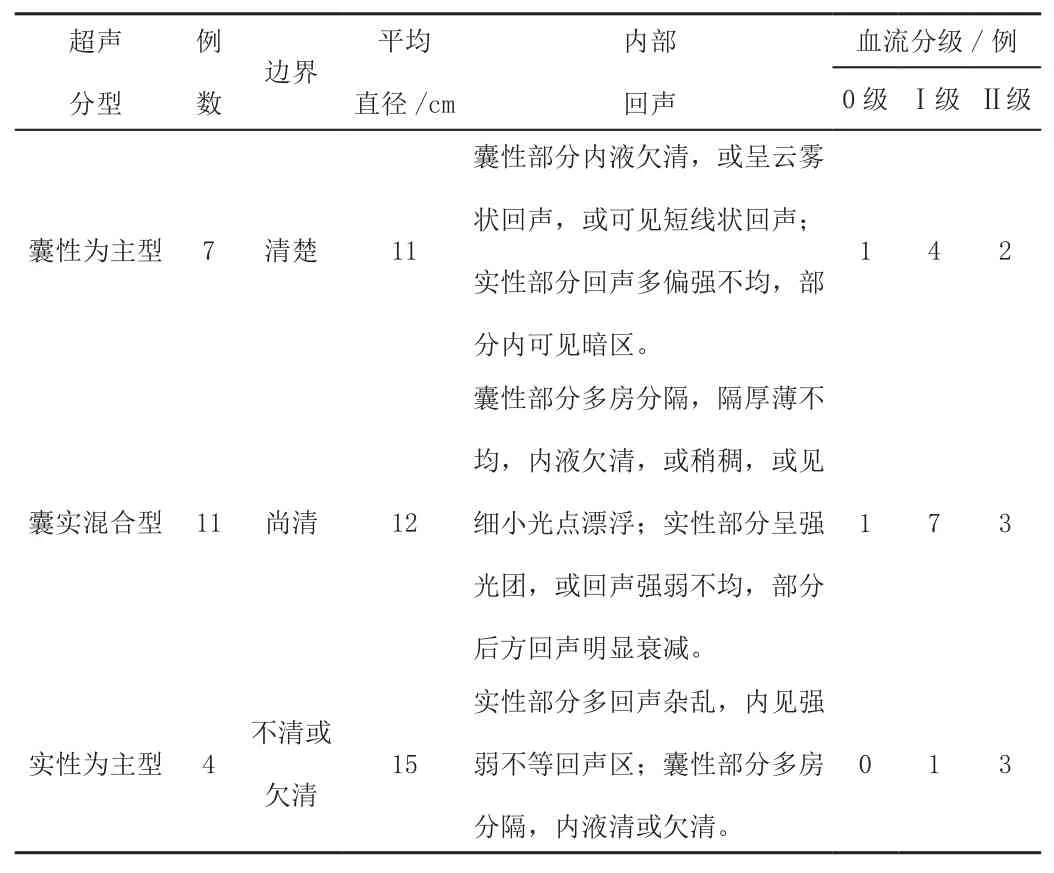
表1 22例卵巢恶性畸胎瘤的超声表现
术前超声诊断为恶性畸胎瘤及恶性卵巢肿瘤15例(15/22,68.2%),其他诊断7例(7/22,31.8%),其中误诊为成熟畸胎瘤4例,囊腺瘤2例,黄体破裂1例。
3 讨论
恶性畸胎瘤表现为未成熟的不易定型和分辨的组织,分为未成熟畸胎瘤及成熟畸胎瘤恶变。未成熟畸胎瘤部分或全部由分化程度不同的未成熟胚胎组织(多为原始神经组织)构成,其恶性程度由未成熟部分所占比例、分化程度以及神经上皮含量而定。好发于儿童及年轻妇女,本研究中19例未成熟畸胎瘤患者,年龄15~34岁,中位年龄27岁,多为育龄期妇女,和文献大致相符。成熟畸胎瘤恶变可以为瘤内的任何一种或多种组织成分,从而形成各种类型的恶性肿瘤,其中以鳞癌变最常见[4],多发生于围绝经期或绝经后妇女。Rathore R等[5]研究发现肿瘤恶性状态与患者年龄有关,随着年龄的增长,肿瘤恶性的可能性更高。本研究3例畸胎瘤恶变患者中2例为绝经后妇女。杨洋等[6]研究认为应将绝经期前后妇女的卵巢畸胎瘤视为一种潜在恶性肿瘤,一旦发现即便是良性也应及早手术,以免发生恶变。
未成熟畸胎瘤患者的肿瘤标记物,尤其是AFP、CA125、CA199均有不同程度的升高[7]。AFP是由不成熟肝细胞及胚胎的卵黄囊产生的一种蛋白质,在卵巢未成熟畸胎瘤中,有时混有少量的内胚窦成分,使患者血清AFP升高。陈晨等[8]研究发现卵巢未成熟畸胎瘤患者中AFP阳性率为35.7%,卵巢成熟畸胎瘤患者中未见有阳性者,两者血清AFP平均水平比较有统计学差异,其诊断卵巢未成熟畸胎瘤的特异度可达100%。本研究未成熟畸胎瘤患者中AFP阳性率为42.1%(8/19),其中1例合并卵黄囊瘤,AFP高达5 130 µg/L,与既往报道数据相近[9]。CA125是胚胎发育中体腔上皮细胞表达的一种糖链抗原,出生后消失,但在卵巢癌细胞内又重新表达,并且在未成熟畸胎瘤诊断中具有较高的灵敏性[10]。本研究未成熟畸胎瘤患者中CA125阳性率为42.1%(8/19),与陈晨等[8]报道相符。因此,术前超声检查,结合这些检测指标可减少未成熟畸胎瘤误诊为成熟畸胎瘤的比例。
随着妇科超声技术的发展,超声在妇科肿瘤的诊断方面具有很高的应用价值。Deodhar等[11]分析28例未成熟畸胎瘤直径为5~28 cm,Dos Santos等[12]分析17例成熟畸胎瘤恶变平均直径为14.2 cm,本研究中22例卵巢恶性畸胎瘤均表现为囊实性包块,包块直径4~23 cm不等,≥10 cm者12例(12/22,54.5%) ,形态均不规则,囊性为主型7例(7/22,31.8%),囊实混合型11例(11/22,50%),实性为主型4例(4/22,18.2%)。囊性部分多房分隔,隔膜厚薄不均,内液欠清或稍稠,或呈云雾状回声,或可见短线状回声,或可见细小光点漂浮;实性部分回声杂乱,内部回声强弱不均,或呈强光团,部分内可见暗区,部分后方回声明显衰减。彩色多普勒血流分级表现为0级2例(2/22,9.1%)、Ⅰ级12例(12/22,54.5%)、Ⅱ级8例(8/22,36.4%)。其瘤体往往兼有畸胎瘤及恶性肿瘤的特征[13]。因此,对于附件区囊实性肿块,直径较大(≥10 cm),增长较快疑似卵巢畸胎瘤的患者应提高警惕[14]。
本研究中3例未成熟畸胎瘤术前超声诊断为成熟畸胎瘤,分析原因:其内合并成熟畸胎瘤成分较多,往往表现为成熟畸胎瘤的声像图特征,且彩色多普勒血流为0级或Ⅰ级,故而忽视了未成熟畸胎瘤的诊断。2例未成熟畸胎瘤术前超声诊断为囊腺瘤,声像图表现以囊性为主,均多房分隔,内液欠清,囊内见絮状不均回声呈乳头样或菜花样自囊壁突起,彩色多普勒血流为Ⅰ级,肿块后方回声明显增强,缺乏畸胎瘤的典型特征而被误诊为囊腺瘤。1例未成熟畸胎瘤因自发性或创伤性破裂失去原有形态,表现为一侧附件区不均质回声包块,彩色多普勒血流为0级,表面见部分卵巢组织回声,盆、腹腔积液,超声医生经验不足而误诊为黄体破裂。1例畸胎瘤恶变误诊为成熟畸胎瘤,声像图以囊性为主,仅表现为囊性畸胎瘤的超声特征,手术病理证实恶变的区域仅为增厚的囊壁,因此,术前超声诊断较为困难。
综上所述,卵巢恶性畸胎瘤的超声表现复杂多样,早期不易明确诊断,但仍有一定的特征性,其声像图表现多为一侧附件区囊实性肿块,体积相对较大,内除有强光团外,多有实性不均回声区与厚薄不均分隔,彩色多普勒超声往往可以在实性区及分隔上探及血流信号。同时结合患者的年龄及血清肿瘤标记物等综合考虑,为临床的早期诊治提供依据。

