非病毒载体在遗传性视网膜变性基因治疗中的应用
卫星 综述 睢瑞芳 审校
中国医学科学院 北京协和医学院 北京协和医院眼科,北京 100730
遗传性视网膜变性(inherited retinal degeneration,IRD)是一大类致盲眼病,发病机制复杂多样。IRD通常会导致严重的视功能损害,具有高度的遗传异质性,目前尚缺少明确有效的治疗方法。随着基因治疗药物和技术的不断发展,IRD的基因治疗显示出广阔的应用前景。基因治疗药物,如野生型基因或DNA片段等通过基因增强策略应用于功能丧失性突变,小干扰RNA和微小RNA等通过基因沉默策略应用于功能获得性突变[1-3]。近年来,基因编辑技术成簇规律间隔短回文重复序列(CRISPR)相关核酸酶系统技术的出现为精准修复致病基因提供了可能[4-5]。然而,一方面,基因药物多呈电负性,自身相对分子质量较大,并且易被核酸酶降解,导致基因药物体内稳定性差,难以递送至靶细胞;另一方面,眼部具有多重保护性屏障,基因药物难以通过传统的局部点眼或全身给药的方式突破屏障实现高效转染,因此要实现IRD的有效治疗需要借助适宜的载体递送。目前,IRD基因治疗的载体递送系统可分为病毒载体递送系统和非病毒载体递送系统。病毒载体因其转染效率较高,在动物模型和临床试验中广泛应用,但在眼科临床应用上仍具有免疫原性强、细胞毒性大等潜在风险[6]。此外,病毒载体包装容量较小、成本高、制备难等问题也亟待解决。非病毒载体在成本、制备难易度、包装容量及安全性上均显示出其优势,越来越多地被应用于IRD基因治疗研究中。本文就非病毒载体系统在转染效率、靶向性和安全性等方面的进展及其在IRD基因治疗中的应用进行综述。
1 IRD基因治疗的非病毒载体
非病毒载体的种类颇多,主要包括阳离子脂质体、阳离子聚合物、树枝状大分子、壳聚糖纳米粒子等。对于IRD基因治疗,理想的非病毒载体递送系统应具有以下重要的性质:(1)携带性能 可携带目的基因,具有较大的载体容量;(2)安全性 对机体无致病性或免疫原性,具有良好的生物降解性;(3)稳定性 载体系统本身应稳定并且能够保护携带的基因免受核酸酶等的破坏;(4)靶向性 可准确地将目的基因递送至靶细胞;(5)转染效率 可协助基因药物实现高效转染。非病毒载体易于化学修饰及合成的特点为其不断优化提供了良好的条件。近年来,研究发现可利用多肽、脂质、多糖等物质将体积较大的DNA压缩和包裹成体积较小的聚合/DNA复合物纳米粒子,这种纳米复合体在IRD的应用上取得了较大的进展,成为新型非病毒载体的研究热点之一。
1.1 多肽复合物载体
多肽在DNA压缩、细胞靶向、细胞膜穿透、内涵体逃逸以及核定位等方面的优异性质使其在非病毒载体递送体系中具有很大的开发潜力。其中,聚赖氨酸是一种天然的阳离子多肽,具有良好的生物可降解性及生物相容性。早期实验显示,聚赖氨酸与DNA形成的纳米复合物可实现有效转染[7],而聚赖氨酸经过化学修饰、特定氨基酸成分改变等优化后在安全性和转染效率上有所提升,具体如下:(1)聚乙二醇(polyethylene glycol,PEG)化学修饰,CK30PEG纳米粒子是PEG取代赖氨酸30聚体肽和目标pDNA压缩后形成的DNA复合物,可有效转染感光细胞和视网膜色素上皮细胞[8-11]。此外,其安全性在基因治疗上也显示出巨大的价值。Ding等[12]研究表明,CK30PEG纳米粒子单次视网膜下注射后不会诱导炎症浸润或细胞因子水平的显著升高,而考虑到纳米粒子所介导的基因表达难以长时间维持,重复注射对于维持疗效在所难免。Han等[13]对重复注射的安全性进行了深入探讨,在BALB/c鼠视网膜下首次注射CK30PEG纳米粒子1个月后进行了第2次注射,结果显示2次注射均仅在注射后6 h产生短暂的眼内炎症反应,而后未检测到包括炎症在内的不良反应。(2)通过调整聚赖氨酸中赖氨酸的反离子即可对聚赖氨酸复合物进行优化。例如,将醋酸盐替换成三氟醋酸盐可将纳米粒子塑形为棒状、球状,提高在眼部的转染效率[9]。同样,体外实验中显示,在聚赖氨酸中加入组氨酸可将转染效率提高20倍。这是由于组氨酸中的氨基氮能够捕获质子,导致内小体渗透压升高后破裂,从而将内吞的药物/载体释放到细胞质,此时组氨酸就像一个可以捕获质子的海绵一样,因此这一现象也被称为质子海绵效应,能够有效地阻碍基因药物在细胞内的降解[14-16](图1)。(3)聚赖氨酸可在与DNA复合前被构建为分支状树状大分子,增加其缓冲能力,从而提高基因递送效率[17]。同时,该粒子可被完全地生物降解,因此相比其他树状大分子毒性骤降。
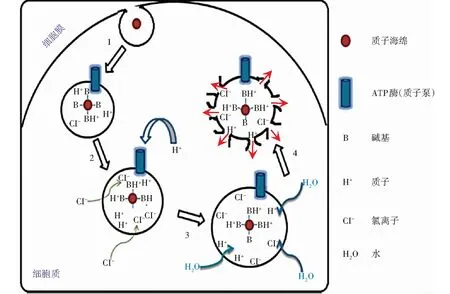
图1 质子海绵效应示意图[16]1:“质子海绵”经细胞内吞形成内小体 2:质子通过ATP酶内流,同时Cl-进入内小体 3:内小体离子浓度升高,吸水膨胀 4:内小体破裂,释放内容物
1.2 脂质复合物载体
脂质复合物载体是聚合物与脂质成分共同制备的纳米复合物,可将核酸药物包载其中[18]。脂质复合物因其稳定性及较高的细胞摄取率成为非病毒载体应用于IRD动物模型中的实例。该聚合作用由脂质带正电荷的阳离子基团和DNA带负电荷的碱基对相互作用所介导,从而形成直径约50 nm、带少量正电荷的纳米复合物[19]。磷脂中,例如1,2-二油酸甘油-3-磷脂酰乙醇胺(DOPE)、(2,3-二油酰基-丙基)-三甲胺(DOTAP)、1,2-二硬脂酰甘油磷酰乙醇胺(DSPE)被广泛应用于脂质复合物中,表现出无毒、转染效率高等优势[20]。目前,相关脂质复合物已在X连锁遗传青年型视网膜劈裂症(X-linked juvenile retinoschisis,XLRS)和Leber先天性黑矇(Leber congenital amaurosis,LCA)的动物模型中显示出有效性[21-23]。视网膜结构由不同的细胞组成,不适当的传递可能会有异位表达的潜在风险,而脂质纳米复合物的缺点即在于缺乏精准的靶向性。在之后的研究中,Wang等[24]解决了脂质纳米复合物的这一不足,利用细胞特异性启动子使其靶向于视网膜不同类型的细胞,如视网膜色素上皮细胞、视锥细胞、视杆细胞和神经节细胞。
1.3 多糖复合物
多糖复合物因其无免疫原性、可生物降解、生产成本低、易于化学修饰的特性在非病毒递送体系中具有重要的研究价值。作为载体,透明质酸和壳聚糖的混合物应用较多。透明质酸整体带负电荷,对DNA的压缩造成影响,而壳聚糖作为阳离子多糖与透明质酸的复合物可以形成直径100~200 nm的小颗粒,保护DNA不被降解并实现有效转染。载体制备过程中,通过改变壳聚糖与透明质酸的比例可以很容易地控制颗粒的大小和表面电荷,对转染效率和持久性进行优化。此外,壳聚糖也可以单独作为载体压缩包裹DNA,并携带质粒DNA,通过视网膜下注射转染至视网膜色素上皮细胞和感光细胞[25-26]。Puras等[25]研究表明,基于NOVA FECTO25寡壳聚糖多聚体可转染至大鼠视网膜的不同细胞。采用视网膜下注射转染的主要是视网膜色素上皮细胞和感光细胞,玻璃体腔内注射可转染至视网膜内层。
2 非病毒载体在IRD中的应用
近年来,非病毒载体系统在转染效率、靶向性和安全性等方面不断进展。尽管其在IRD上的应用尚未进入临床试验阶段,但其有效性已在动物模型上得到验证。对于视网膜色素变性(retinitis pigmentosa,RP)、Stargardt病(Stargardt disease,STGD)、XLRS、LCA等IRD疾病的基因治疗,非病毒载体提供了较为安全、有效的研究思路,例如,多肽复合物CK30PEG已应用于RP、STGD的治疗研究中,多功能pH敏感型氨基脂质ECO已应用于STGD、LCA的研究中[10,21-22,27-32](表1)。目前,研究通过改变粒子表面结构和组成、优化载体设计等方式完善非病毒载体,以期突破转染效率低这一临床应用的技术瓶颈。
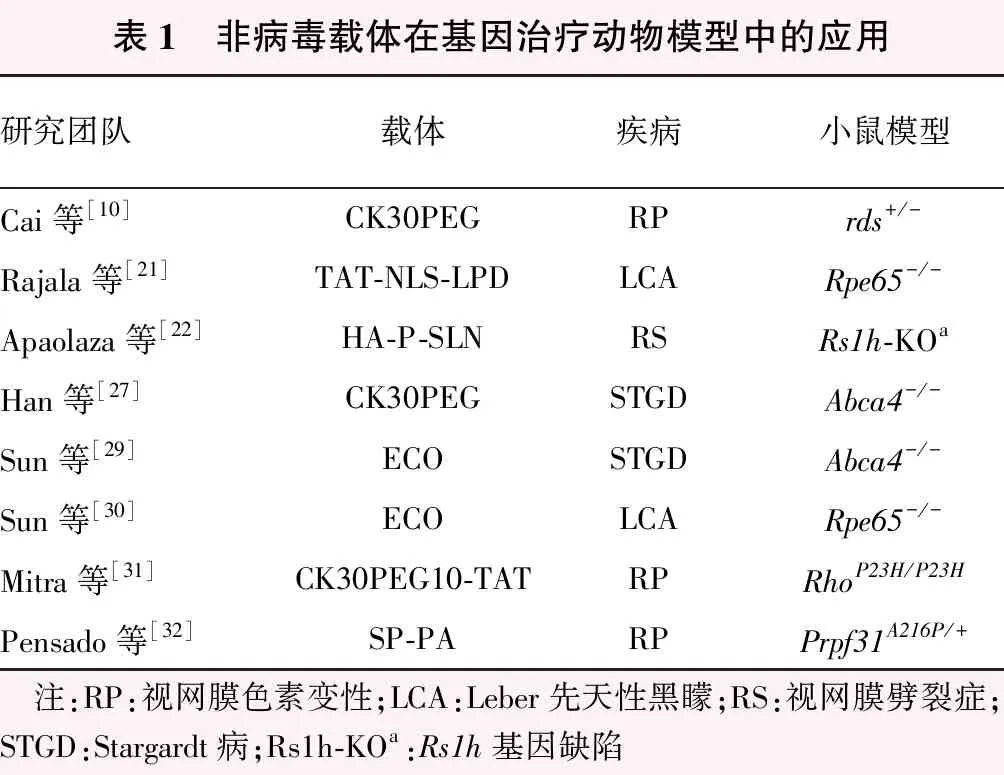
表1 非病毒载体在基因治疗动物模型中的应用研究团队载体疾病小鼠模型Cai等[10]CK30PEGRPrds+/-Rajala等[21]TAT-NLS-LPDLCARpe65-/-Apaolaza等[22]HA-P-SLNRSRs1h-KOaHan等[27]CK30PEGSTGDAbca4-/-Sun等[29]ECOSTGDAbca4-/-Sun等[30]ECOLCARpe65-/-Mitra等[31]CK30PEG10-TATRPRhoP23H/P23HPensado等[32]SP-PARPPrpf31A216P/+ 注:RP:视网膜色素变性;LCA:Leber先天性黑矇;RS:视网膜劈裂症;STGD:Stargardt病;Rs1h-KOa:Rs1h基因缺陷
2.1 非病毒载体在RP中的应用
RP是常见的遗传性致盲眼病,以进行性视网膜光感受器细胞凋亡和色素上皮变性为主要特征,患病率为1/7 000~1/3 000[33]。RP的致病基因多种、遗传方式多样,目前已发现130种与RP相关的致病基因,遗传方式主要包括常染色体显性遗传、常染色体隐性遗传及X染色体连锁遗传等[34]。早期研究表明,CK30PEG在眼内注射的载体容量可达14 kb,在BALB/c野生鼠视网膜下注射后仅产生短暂炎症反应[13],较大的载体容量和安全性提示了其广阔的应用空间。Cai等[10]将包含了视蛋白启动子和Rds基因的CK30PEG纳米粒子注射至rds+/-小鼠模型视网膜下,在注射后2~7 d检测到Rds mRNA的表达量达峰值,并可持续维持至注射后120 d,表明CK30PEG纳米粒子可以安全、有效地在感光细胞中表达并延缓疾病进展。其中,在改善功能和结构方面,研究显示注射后视杆细胞功能部分改善,而视锥细胞功能甚至恢复到了野生型水平。同时,电子显微镜下观察结果显示,视网膜光感受器外节和外核层增厚。在安全性方面,CK30PEG纳米粒子注射后并未诱发免疫反应和炎症反应。之后,Mitra等[31]利用细胞穿透肽TAT、CK30PEG10二嵌段共聚体压缩DNA构建了CK30PEG10-TAT纳米复合体并将其注射至纯合RhoP23H/P23H基因敲入模型鼠的视网膜下,该研究在纳米复合物构建时采用密码子优化的Rho以实现基因替换,同时结合RNA干扰技术实现基因沉默抑制突变基因的表达,结果表明Rho蛋白在外核层表达显著,并可部分改善视功能。此外,脂质纳米复合物在RP基因治疗的应用上也有所进展。Pensado等[32]采用多聚左旋精氨酸山梨糖醇酯和PRPF31构建了SP-PA-PRPF31纳米粒子,该纳米粒子在Prpf31A216P/+模型鼠视网膜下注射后可实现基因的有效转染,模型鼠的视网膜厚度和视力均得到显著改善。
2.2 非病毒载体在STGD中的应用
STGD是青少年常见的黄斑营养不良,患病率为1/10 000~1/8 000,大多数患者的致病基因为ABCA4基因,呈常染色体隐性遗传[35]。ABCA4基因编码ABCA4蛋白,为ATP结合盒式转运蛋白家族中的一员。该蛋白在感光细胞外节表达,具有清除视循环中间代谢废物的功能。ABCA4基因变异将导致视网膜毒性产物聚集,从而发生视网膜色素上皮细胞和感光细胞凋亡,进而影响视网膜功能[36]。对于STGD,基于病毒载体基因治疗的前期探索收效甚微。ABCA4长达6.8 kb,而AAV载体的荷载量低于5 kb。McClements等[37]将ABCA4分为2个片段并采用双重AAV载体递送以期突破单一AAV的有限荷载量,结果表明尽管双重AAV载体策略可以介导Abca4-/-小鼠中全长ABCA4蛋白在感光细胞外节的表达,但载体转染效率不佳且会产生截短蛋白表达。而病毒载体中的慢病毒虽具有可递送ABCA4的有效荷载量,但仍存在不可控的基因组整合、潜在致癌风险等安全性问题[38-39]。因此,荷载量大且相对安全的非病毒载体或将成为STGD基因治疗的突破口。考虑到非病毒载体CK30PEG具有较大的载体容量,Han等[27]将其应用于STGDAbca4-/-小鼠模型。该研究团队构建了携带ABCA4cDNA的CK30PEG纳米载体,发现ABCA4可在视网膜下注射后持续表达8个月,该治疗策略可改善暗适应及减少脂褐素颗粒。但就目前的阳性结果来看,CK30PEG纳米载体注射后Abca4-/-模型小鼠的蛋白表达水平仍无法与野生型持平,并会随着时间逐渐下降,在注射后2个月为野生型的25%,注射后8个月降至11%。2020年,Sun等[29]提出多功能pH敏感型氨基脂质1-氨乙基-二[N-(油酰半胱氨酰-1-氨乙基)-丙酰基]-亚胺((1-aminoethyl)iminobis[N-(oleoylcysteinyl-1-amino-ethyl)propionamide],ECO)可作为安全、有效的载体,研究利用ECO和ABCA4质粒构建了自组装粒子ECO/pRHO-ABCA4。在Abca4-/-模型鼠视网膜下注射后,该纳米粒子成功介导了基因转染,并通过在质粒中克隆视紫红质特异性启动子实现了ABCA4在感光细胞外节的特异性表达,这种特异且高水平的表达可维持至少8个月,平均减少35%视网膜毒性产物维生素A二聚体A2E的积累,并延缓STGD的进展。同时,ECO纳米粒子在视网膜下注射后显示出良好的安全性,为STGD及其他IRD的基因治疗提供了新的思路。
2.3 非病毒载体在XLRS中的应用
XLRS是由RS1基因变异引起的遗传性退行性眼病,在男性中的患病率为1/25 000~1/5 000[40]。RS1编码RS1蛋白,该蛋白主要介导细胞间相互作用与细胞间的黏附,RS1基因变异将导致视网膜内层劈裂[41]。大部分患者10岁以内发病,视力受损明显,且多数患者成年后出现视网膜萎缩,导致视功能进一步恶化[42-43]。近年来,应用于XLRS基因治疗的纳米复合物在不断研发优化中,Delgado等[23]开发了一种由右旋糖苷-硫酸鱼精蛋白-pDNA(pCMS-EGFP或pCEP4-RS1)组成并将其吸附在固体脂质纳米粒上的纳米复合物。该研究在大鼠模型中采用了视网膜下注射、玻璃体腔内注射和局部点眼3种不同的纳米粒子递送方式,结果表明纳米材料玻璃体腔内注射后基因仅在神经节细胞层表达,局部点眼后仅在角膜表达,而视网膜下注射后可转染至视网膜色素上皮细胞和感光细胞。随后,Apaolaza等[22]将上述研究纳米复合物中的右旋糖苷替换为透明质酸构建出新的载体,即透明质酸-硫酸鱼精蛋白-pDNA-脂质纳米粒子HA-P-SLN,并与上述纳米复合物载体分别注射至Rs1h缺陷模型小鼠中,结果显示2种载体均能转染至视网膜。研究采用了视网膜下注射和玻璃体腔内注射2种载体递送方式,结果发现当采用视网膜下注射时感光细胞中检测到的RS1表达水平较高,并可在神经节细胞层和内核层维持表达至注射后2个月。此外,2种载体均能部分改善视网膜结构和功能,包括减少感光细胞的丢失及改善视网膜的组织结构。
2.4 非病毒载体在LCA中的应用
LCA是一种严重的遗传性致盲视网膜疾病,多数患者呈常染色体隐性遗传,患病率为1/80 000[44]。LCA发病年龄早,大部分患儿于出生后1年内即出现眼球震颤及视力下降。尽管以AAV为载体的基因药物Luxturna®已经上市并为LCA的基因治疗带来了实质性的突破,但其治疗费用高达85万美元[45]。因此,成本较低且更为安全的非病毒载体也在不断研究中。Rajala等[21]采用脂质体-鱼精蛋白-质粒复合物结合核定位信号NLS、细胞穿透肽TAT构建了脂质体纳米粒子TAT-NLS-LPD,并将其应用于RPE65相关致盲小鼠模型中,结果表明单次视网膜下注射后基因表达可至少维持3个月,并且未检测到注射后免疫反应及炎症反应,该治疗策略可改善视功能并延缓疾病致盲进展。此外,多功能pH敏感型氨基脂质ECO除在上述STGD有应用外,在LCA 2型的基因治疗上也颇具潜能。Sun等[30]将ECO与质粒DNA缩合构建了ECO纳米粒子,在Rpe65-/-小鼠视网膜下注射后观察到视锥细胞的显著改善,该治疗作用可维持至少120 d。同时,在野生BALB/c小鼠上的安全性研究显示,该纳米粒子经视网膜下注射后未产生不可逆性损伤,为LCA 2型的治疗提供了安全、有效的策略。
3 基因治疗递送途径
目前IRD基因治疗递送途径主要为眼内注射,根据注射的位置分为视网膜下注射和玻璃体腔内注射等。视网膜下注射是将药物注射到感光细胞层和色素上皮层间,注射后会产生150 μm的间隙。由于视网膜下注射可以将基因药物直接递送至靶组织,所以视网膜下注射成为目前IRD基因治疗的主要递送途径。尽管视网膜下注射突破了眼复杂的解剖屏障和生理屏障,但其潜在的并发症仍不容忽视。相比之下,玻璃体腔内注射更为简单、安全,但劣势也较为明显,即转染效率相对较低。
3.1 视网膜下注射
视网膜下注射因其转染效率高这一巨大优势成为目前将基因药物递送至视网膜感光细胞和视网膜色素上皮层最有效的方法。事实上,无论采用病毒载体还是非病毒载体,视网膜下注射均成为IRD基因治疗研究中递送途径的重要选择。但其在临床转化应用中仍存在一定的不足:(1)视网膜下注射可出现不同程度的并发症,如注射后视网膜脱离。由于治疗性注射液可使感光细胞层与色素上皮层分离[46-47],而感光细胞需要色素上皮层的营养供给和结构支持,同时维持结构的完整性对于视紫红质光化学循环中感光色素的再生也至关重要,所以注射后的视网膜脱离可导致感光细胞和视功能受损[48]。此外,视网膜下注射还可造成眼内炎、玻璃体积血,并增加白内障的患病风险[49-51]。(2)视网膜下注射对注射技术及注射设备具有较高要求,费用高,并且患者注射后恢复期长。(3)转染范围局限在注射后视网膜下液泡出现的区域,限制了其在全视网膜疾病治疗上的有效应用。尽管存在上述不足,采用视网膜下注射的IRD临床试验表明,在大多数患者中注射所带来的视功能改善的利远大于其不良反应的弊[52-53],视网膜下注射仍然是IRD基因治疗中应用最广泛的递送途径。
3.2 玻璃体腔内注射
玻璃体是透明的凝胶体,主要由胶原结构和透明质酸组成,其中胶原纤维和带负电荷的双螺旋透明质酸分子相互作用形成3D网状结构[54-55]。基于玻璃体的3D网状结构及负电荷组分,可对非病毒材料进行一定的化学修饰,或采用纳米材料避免粒径过大以及正负电荷相互作用对非病毒载体的扩散造成影响。玻璃体腔内注射的优势在于:(1)不会造成视网膜下液泡和视网膜脱离,患者在治疗室即可接受注射。(2)可将转染范围扩大至整个视网膜,使治疗效果得到显著改善。(3)增加治疗的安全性和患者的舒适性,并在降低成本上具有优势。因此,安全、有效的玻璃体腔内注射可为许多致盲视网膜疾病的基因治疗带来革命性的改变[1,56-57]。
非病毒载体递送系统具有易于制备、载体容量大、免疫反应低、有效荷载大以及化学修饰灵活等优势,在IRD的基因治疗上具有广阔的应用前景。近年来,非病毒载体在转染效率、靶向性和安全性等方面不断改进,并在动物实验中取得了显著的效果。视网膜下注射是将基因药物递送至视网膜感光细胞和色素上皮层最有效的方法,而玻璃体腔内注射的优势在于损伤较小,并可达成更加广泛、均匀的转染。然而这些方法均需要反复进行眼内注射并有不同程度的并发症,所以对于载体的设计优化、递送方式的探索仍需不断进行,开发更为安全、有效并且持续表达的方法。尽管IRD的基因治疗仍存在很多难以解决的问题和挑战,如治疗时机的选择、基因载体的安全性和转染效率等问题还需要研究者不懈的努力和探索,但值得肯定的是,随着基因载体研究的不断深入,无论是病毒载体还是非病毒载体都向着理想载体的目标不断改进。
利益冲突所有作者均声明不存在利益冲突

