环状RNA在眼科疾病中的作用
杨光 综述 张丹 马晓芃 审校
上海市针灸经络研究所 200030
环状RNA(circular RNA,circRNA)是一类具有封闭结构的环状分子,由前体mRNA反向剪接形成,不具有5’端帽子结构和3’端多聚腺苷酸尾巴[1]。随着RNA测序技术的进步及生物信息学的发展,大规模转录组研究发现circRNA在人体中广泛存在,是人基因转录组的重要组成部分[2]。成熟的circRNA存在于细胞核、细胞质及各种体液中,不易被核酸外切酶水解,高度保守且稳定,具有组织和发育阶段特异性[2]。研究证实circRNA参与肿瘤、自身免疫性疾病、心血管疾病、神经系统疾病等多种疾病的发生和发展,是辅助疾病诊断、研究发病机制和开展靶向治疗的新型生物标志物[3]。近年来,眼病的表观遗传学研究表明,circRNA是眼生理、病理机制基因调控网络中的重要组成部分[4]。本文对不同眼病中circRNA的表达特点及其介导的基因调控网络进行总结,分析circRNA作为眼病生物标志物和治疗靶点的潜在能力,为未来眼科疾病的研究提供新的思路。
1 CircRNA概述
1.1 CircRNA的来源、合成和分类
大多数circRNA由基因编码表达,是基因转录的主要产物,由前体mRNA反向剪接形成,即下游的剪接供体位点与上游的剪接受体位点以共价方式反向连接,分为外显子circRNA(exonic circRNA,ecircRNA)、内含子circRNA(circular intronic RNA,ciRNA)和外显子-内含子circRNA(exon-intron circRNA,EIciRNA)(图1),其环化机制包括套索驱动、内含子配对驱动、RNA结合蛋白(RNA binding protein,RBP)驱动和内含子环化机制[5]。CircRNA的合成受侧翼序列碱基互补配对与剪接因子的调控。同一基因位置可产生多个不同的circRNA转录本,这有赖于其侧翼中Alu重复序列的反向配对及竞争性互补配对[6-7]。

图1 CircRNA的合成及基本生物学功能通过不同的环化机制,前体mRNA可形成3种circRNA,即外显子circRNA、外显子-内含子circRNA和内含子circRNA。CircRNA的主要功能包括:(1)充当miRNA“海绵”参与转录后调控;(2)与蛋白结合形成RNA-蛋白复合物进行转录调控;(3)以非帽依赖性方式参与蛋白翻译;(4)与RNA聚合酶Ⅱ作用顺式调节宿主基因表达 circRNA:环状RNA;miRNA:微小RNA
1.2 CircRNA的基本生物学功能
如图1所示,circRNA与微小RNA(microRNA,miRNA)、蛋白质、RNA间存在相互作用,在转录或转录后水平调控基因表达、参与蛋白翻译,其作用机制主要表现在以下4个方面。
1.2.1充当miRNA“海绵” 研究表明,ecircRNA主要位于细胞质中,具有多种miRNA结合位点,通过miRNA“海绵”作用参与转录后调控,如ciRS-7和circBIRC6都具有miRNA海绵特性,可与特定miRNA靶向结合影响基因表达[8-10]。研究发现,circRNA-miRNA轴参与疾病的发生和发展,是重要的基因调控网络[11]。但也有研究认为,miRNA“海绵”并不是circRNA的普遍功能,其竞争性结合作用弱于线性mRNA[12]。
1.2.2与蛋白结合形成RNA-蛋白复合物 研究发现,circRNA能与Argonaute蛋白(argonaute proteins,AGO)、盲肌蛋白等多种RBP结合形成RNA-蛋白复合物,进行转录调控,调节细胞生命活动[13-15]。同一种circRNA能与不同RBP结合发挥不同的调节作用,如circFoxo3既能与细胞周期蛋白依赖性激酶2、细胞周期蛋白依赖性激酶抑制剂1结合形成三元复合物,阻碍细胞周期进展[14],又能与抗衰老蛋白分化抑制蛋白、抗应激蛋白黏着斑激酶(focal adhesion kinase,FAK)等结合加快细胞衰老[15]。
1.2.3与RNA相互作用顺式调节宿主基因表达 Li等[16]研究发现,ciRNA和EIciRNA主要位于细胞核中,可通过RNA-RNA相互作用调节宿主基因的表达,如Ci-ankrd52在转录位点与RNA聚合酶Ⅱ(RNA polymerase Ⅱ,RNA Pol Ⅱ)结合后可增加宿主基因转录伸长率[17]。作为EIciRNA,circEIF3J和circPAIP2可与小核糖核蛋白体U1-snRNP的互补碱基配对形成EIciRNA-U1 snRNP复合体,该复合体在宿主基因启动子区域与RNA Pol Ⅱ转录起始复合物结合后可促进基因转录[16]。EIciRNA与宿主基因间可能存在一种正反馈回路。
1.2.4以非帽依赖性方式参与蛋白翻译 尽管circRNA缺少5’端帽子结构,翻译蛋白的能力极低,但研究发现circRNA具有内部核糖体进入位点及N6-甲基腺苷(N6-methyladenosine,m6A)修饰;circRNA对照序列中的m6A修饰比线性mRNA更多,修饰后的circRNA可通过募集翻译起始因子启动蛋白翻译[18-20]。
2 CircRNA在眼病中的研究
2.1 视网膜疾病
2.1.1糖尿病视网膜病变 糖尿病视网膜病变(diabetic retinopathy,DR)是以血管渗漏、炎症和新生血管形成等血管功能障碍为病理特点的糖尿病并发症之一,发病机制主要与血管内皮细胞损伤、炎性因子产生、血管内皮生长因子(vascular endothelial growth factor,VEGF)异常表达有关[21]。
Gu等[22]通过对比筛选DR患者、不患有DR的2型糖尿病患者和正常人血清样本中的circRNA,确定circ_063981、circ_404457、circ_100750、circ_406918、circ_104387、circ_103410和circ_100192在DR患者血清中的表达特异性升高,其中circ_063981和circ_404457的表达差异最显著。研究表明,circ_100750和circ_406918的宿主基因与胰岛β细胞损伤和疾病易感性相关[22-23]。根据结合位点序列分析,circ_104387、circ_103410、circ_100192分别具有miR-29a、miR-126、miR-146结合位点。这些miRNA与DR的发病机制有关。过表达的miR-29a可激活神经源位点缺口同源蛋白2信号通路,抑制高糖诱导的人视网膜微脉管上皮-间质转化(epithelial-mesenchymal transition,EMT)[24-25];miR-126可抑制靶基因IRS-1表达,从而下调VEGF、磷脂酰肌醇3-激酶、蛋白激酶B(protein kinase B,AKT)等通路蛋白表达水平,抑制细胞的侵袭和存活[26-28];miR-146能负调控NF-κB信号通路,下调半胱天冬酶募集结构域蛋白10,抑制DR相关炎症,缓解视网膜微血管和神经元的功能损伤[29-30]。
此外,circ_0005015和circHIPK3(即circ_0000284)在DR中的表达也特异性升高[31-32]。研究发现,circ_0005015能靶向结合miR-519d-3p,从而上调基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、信号传导及转录激活因子3(signal transduction and activators of transcription-3,STAT3)和X连锁凋亡抑制蛋白(X chromosome linked inhibitor of apoptosis protein,XIAP)的表达,促进视网膜血管内皮细胞的增生、迁移、管腔形成和芽生,形成新生血管[31]。Shan等[32]的研究结果表明,circHIPK3的“海绵”作用可抑制miR-30a-3p活性,上调VEGF-C、卷曲蛋白4(frizzled related protein 4,FZD4)、WNT2蛋白的表达,加重DR病理损伤。以上研究结果提示,多种circRNA都可能通过miRNA的“海绵”作用促进DR的发生和发展。
2.1.2增生性玻璃体视网膜病变 增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是视网膜脱离术后或眼球穿通伤主要的并发症之一,视网膜前膜(epiretinal membrane,ERM)的产生是该病引起视力下降的主要原因[33]。
Yao等[34]在PVR患者ERM组织中检测到circ_0043144是表达上调最显著的特征性circRNA,且与PVR严重程度呈正相关,其表达与致病基因PDGFA、PDGFC、KNG1的表达具有一致性,提示circ_0043144可能是PVR潜在的生物标志物。ERM主要由视网膜色素上皮(retinal pigment epithelial,RPE)细胞构成,RPE细胞的移行、增生可导致ERM形成,促进PVR的发生和发展[35]。过表达的circ_0043144能显著增强ARPE-19细胞的增生和迁移,同时促进分泌趋化因子CCL2、趋化因子CXCL8、白细胞介素-6(interleukin 6,IL-6)和VEGF-A,沉默circ_0043144则可抑制该细胞的功能,说明circ_0043144可能通过促进RPE细胞增生和迁移致PVR发病[34]。这为研究PVR的发病机制、疾病诊断和靶向治疗提供了新的方向。
2.1.3高同型半胱氨酸血症视网膜病变 高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)是由于胱硫醚-β-合成酵素(cystathionine-β-synthase,CBS)缺乏引起的同型半胱氨酸(homocysteine,Hcy)代谢障碍性疾病。Hcy的堆积抑制了谷胱甘肽合成,可引起视网膜微血管功能异常,与RPE细胞、视网膜神经节细胞(retinal ganglion cells,RGCs)损伤也密切相关[36-37]。
研究者在CBS基因敲除小鼠眼球组织中发现了74种特异性表达的circRNA,其中大部分为ecircRNA[38]。下调的circRNA中,circ_21649来源于代谢型谷氨酸受体1(metabolic glutamate receptor 1,mGluR1)基因。mGluR1的过度激活可产生谷氨酸神经毒性,损伤RGCs[37]。研究者推测,代谢失衡的Hcy可引起DNA甲基化异常,从而影响circRNA合成,异常表达的circRNA可能发挥miRNA“海绵”作用改变疾病基因表型,引起氧化还原反应失衡、炎症、谷氨酸神经毒性等一系列病理改变[38]。此外,在高Hcy环境中,ARPE-19细胞的circRNA也出现异常表达[39]。然而,circRNA介导的基因调控网络在HHcy视网膜病变的具体机制仍不明确,需要进一步研究。
2.2 眼肿瘤
2.2.1视网膜母细胞瘤 视网膜母细胞瘤(retinoblastoma,RB)是婴幼儿常见的眼内恶性肿瘤,主要由Rb抑癌基因失活导致。
研究表明,miRNA在人RB组织中存在差异表达[40],circRNA作为miRNA的上游调控因子可能参与RB的发生和发展。既往研究结果显示,circ_0001649是由抑癌基因SHPRH编码的肿瘤相关circRNA,在多种肿瘤疾病中呈低表达[41-42]。Xing等[43]在RB组织和细胞中均发现circ_0001649的表达降低,低表达的circ_0001649与较大的肿瘤、较严重的眼内RB分级和较低的5年存活率显著相关,结果显示circ_0001649可能通过AKT/mTOR信号通路抑制肿瘤细胞增生、促进细胞凋亡,过表达的circ_0001649可有效抑制移植瘤的生长。
Lyu等[44]研究发现,circ_0093996/miR-183/细胞程序性死亡蛋白4(programmed cell death 4 protein,PDCD4)轴可能也是RB发病机制中基因调控网络的一部分,circ_0093996由抑癌基因TET1编码,在RB组织中表达降低,下调的circ_0093996可能通过释放miR-183,抑制PDCD4表达,从而促进Rb抑癌基因磷酸化失活,形成肿瘤。因此,circRNA可能是RB的预后生物标志物和潜在的治疗靶点。
2.2.2结膜黑色素瘤 结膜黑色素瘤(conjunctival melanoma,CM)是一种罕见的眼部恶性肿瘤,发病机制仍不明确,但多项研究在其基因组学和转录组学取得了一定进展,研究发现抑癌基因、肿瘤转移相关基因、miRNA等参与调控CM的发生和发展[45-47]。
研究表明,circMTUS1,即circ_0083444,由抑癌基因MTUS1外显子2和外显子3环化形成,在CM组织中高度表达且高度稳定[48]。沉默circMTUS1可有效抑制CM细胞增生,减缓肿瘤的生长和转移。基因本体论(Gene Ontology,GO)分析显示,circMTUS1促进CM发病的作用主要与蛋白磷酸化有关。研究表明,circMTUS1可能以AGO2依赖方式结合miR-622、miR-1208,并通过调控受体酪氨酸激酶(receptor tyrosine kinase,RTK)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、WNT等多种肿瘤相关信号通路调控CM的发病,可作为CM的一种新型生物标志物[48]。
2.3 青光眼
青光眼是以RGCs凋亡为主要病理表现的视网膜神经退行性疾病[49]。研究发现,过表达的circZRANB1可引起反应性胶质细胞增生,促进RGCs凋亡,使神经节细胞层变薄[50]。反应性胶质细胞增生通常与Müller细胞过度增生有关,而circZRANB1可直接促进Müller细胞的增生,并增强Müller细胞对RGCs的促凋亡作用[50]。因此认为circZRANB1与青光眼视神经退行性病变有关。进一步研究发现,在氧化应激或谷氨酸神经毒性作用下,Müller细胞中的circZRANB1可通过吸附miR-217上调Runt相关转录因子2(Runt related transcription factor 2,RUNX2)的表达,从而促进Müller细胞增生,沉默circZRANB1则可抑制胶质细胞活化。另外,circZNF609也具有miR-615-5p“海绵”作用,可上调镍纹蛋白(meteorin,METRN)的表达,激活反应性胶质细胞,促进RGCs凋亡的发生[51]。
2.4 晶状体疾病
年龄相关性白内障(age-related cataract,ARC)致盲率高,以氧化应激诱导的不溶性晶状体蛋白累积、晶状体上皮细胞(lens epithelial cells,HLECs)凋亡和细胞变异增加为主要病理特点,其发病机制与表观遗传学相关[52]。
Liu等[53]研究发现,circHIPK3在不同亚型ARC患者晶状体中的表达均显著下调;氧化应激可促进HLECs凋亡,而下调的circHIPK3加快了细胞凋亡和EMT,同时抑制细胞活性和增生,造成HLECs功能异常。此外,circHIPK3的下调可释放miR-193a-3p,抑制靶基因的表达,使晶状体透明度及屈光率降低。故研究者认为circHIPK3/miR-193a-3p/αA-晶状体蛋白(crystallin Alpha A,CRYαA)轴可能是ARC发病机制的基因调控网络。
2.5 结膜疾病
翼状胬肉是结膜向角膜表面过度生长所形成的纤维血管样组织,可引起角膜散光导致视力下降,病理机制主要为纤维原细胞的异常增生、细胞外基质蛋白沉积、血管形成、炎症和细胞凋亡[54]。
Li等[55]通过对比人翼状胬肉组织和正常结膜组织circRNA的表达异同,筛选出大量异常表达的circRNA。GO分析显示,这些circRNA的宿主基因主要在细胞质中表达,参与调控细胞外基质形成、细胞黏附、转录调控、蛋白磷酸化等生物过程,最集中的分子功能为结合蛋白;京都基因和基因组百科全书信号通路分析显示FAK信号通路是宿主基因调控最多的信号通路。其中,circ_0085020,即circLAPTM4B,在翼状胬肉中表达特异性升高,沉默circ_0085020不仅能抑制纤维原细胞及上皮细胞的存活、增生和迁移,还能增强紫外线介导的纤维原细胞凋亡,是翼状胬肉重要的潜在生物标志物,其调控作用可能与miRNA“海绵”有关[55]。
CircRNA广泛存在于视网膜、房水、玻璃体及眼部病变组织中,在不同眼病中呈现差异表达(表1)。特异性表达的circRNA可通过miRNA“海绵”作用影响靶基因的表达,调控纤维原细胞、角膜上皮细胞、RPE细胞、Müller细胞、视网膜血管内皮细胞、RGCs及HLECs多种眼部细胞的增生、迁移和凋亡,导致新生血管形成、血管渗漏、炎症、视网膜神经退行性病变、晶状体混浊、肿瘤生长等病理改变,从而参与DR、PVR、HHcy视网膜病变、青光眼、ARC、RB、CM和翼状胬肉的发生和发展。CircRNA调控网络具有多靶点、多途径的特点。
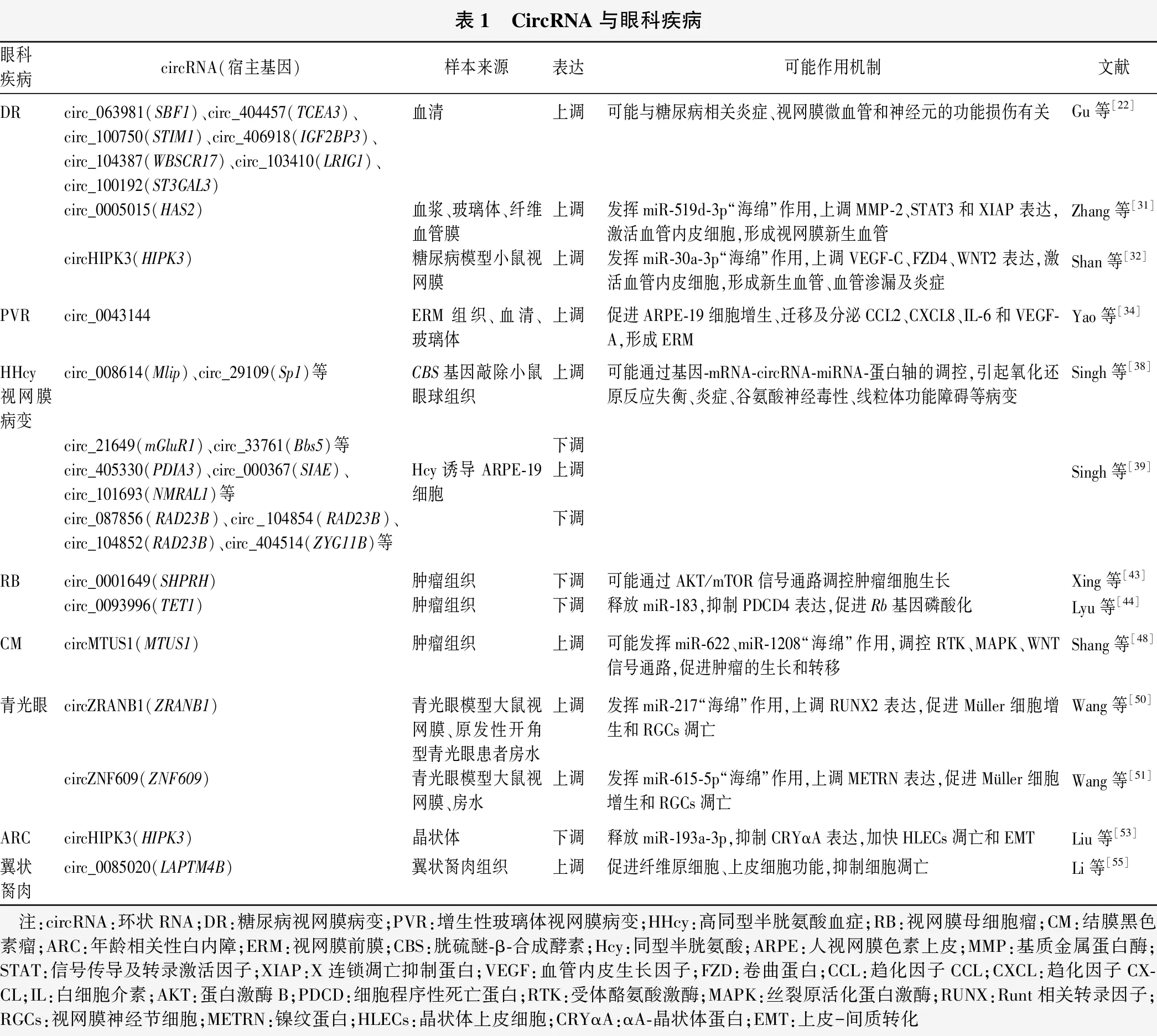
表1 CircRNA与眼科疾病眼科疾病circRNA(宿主基因)样本来源表达可能作用机制文献DRcirc_063981(SBF1)、circ_404457(TCEA3)、circ_100750(STIM1)、circ_406918(IGF2BP3)、circ_104387(WBSCR17)、circ_103410(LRIG1)、circ_100192(ST3GAL3)circ_0005015(HAS2)circHIPK3(HIPK3)血清血浆、玻璃体、纤维血管膜糖尿病模型小鼠视网膜上调上调上调可能与糖尿病相关炎症、视网膜微血管和神经元的功能损伤有关发挥miR-519d-3p“海绵”作用,上调MMP-2、STAT3和XIAP表达,激活血管内皮细胞,形成视网膜新生血管发挥miR-30a-3p“海绵”作用,上调VEGF-C、FZD4、WNT2表达,激活血管内皮细胞,形成新生血管、血管渗漏及炎症Gu等[22]Zhang等[31]Shan等[32]PVRcirc_0043144ERM组织、血清、玻璃体上调促进ARPE-19细胞增生、迁移及分泌CCL2、CXCL8、IL-6和VEGF-A,形成ERMYao等[34]HHcy视网膜病变circ_008614(Mlip)、circ_29109(Sp1)等circ_21649(mGluR1)、circ_33761(Bbs5)等circ_405330(PDIA3)、circ_000367(SIAE)、circ_101693(NMRAL1)等circ_087856(RAD23B)、circ_104854(RAD23B)、circ_104852(RAD23B)、circ_404514(ZYG11B)等CBS基因敲除小鼠眼球组织Hcy诱导ARPE-19细胞上调下调上调下调可能通过基因-mRNA-circRNA-miRNA-蛋白轴的调控,引起氧化还原反应失衡、炎症、谷氨酸神经毒性、线粒体功能障碍等病变Singh等[38]Singh等[39]RBcirc_0001649(SHPRH)circ_0093996(TET1)肿瘤组织肿瘤组织下调下调可能通过AKT/mTOR信号通路调控肿瘤细胞生长释放miR-183,抑制PDCD4表达,促进Rb基因磷酸化Xing等[43]Lyu等[44]CMcircMTUS1(MTUS1)肿瘤组织上调可能发挥miR-622、miR-1208“海绵”作用,调控RTK、MAPK、WNT信号通路,促进肿瘤的生长和转移Shang等[48]青光眼circZRANB1(ZRANB1)circZNF609(ZNF609)青光眼模型大鼠视网膜、原发性开角型青光眼患者房水青光眼模型大鼠视网膜、房水上调上调发挥miR-217“海绵”作用,上调RUNX2表达,促进Müller细胞增生和RGCs凋亡发挥miR-615-5p“海绵”作用,上调METRN表达,促进Müller细胞增生和RGCs凋亡Wang等[50]Wang等[51]ARCcircHIPK3(HIPK3)晶状体下调释放miR-193a-3p,抑制CRYαA表达,加快HLECs凋亡和EMTLiu等[53]翼状胬肉circ_0085020(LAPTM4B)翼状胬肉组织上调促进纤维原细胞、上皮细胞功能,抑制细胞凋亡Li等[55] 注:circRNA:环状RNA;DR:糖尿病视网膜病变;PVR:增生性玻璃体视网膜病变;HHcy:高同型半胱氨酸血症;RB:视网膜母细胞瘤;CM:结膜黑色素瘤;ARC:年龄相关性白内障;ERM:视网膜前膜;CBS:胱硫醚-β-合成酵素;Hcy:同型半胱氨酸;ARPE:人视网膜色素上皮;MMP:基质金属蛋白酶;STAT:信号传导及转录激活因子;XIAP:X连锁凋亡抑制蛋白;VEGF:血管内皮生长因子;FZD:卷曲蛋白;CCL:趋化因子CCL;CXCL:趋化因子CX-CL;IL:白细胞介素;AKT:蛋白激酶B;PDCD:细胞程序性死亡蛋白;RTK:受体酪氨酸激酶;MAPK:丝裂原活化蛋白激酶;RUNX:Runt相关转录因子;RGCs:视网膜神经节细胞;METRN:镍纹蛋白;HLECs:晶状体上皮细胞;CRYαA:αA-晶状体蛋白;EMT:上皮-间质转化
目前,circRNA在眼病中的研究较为局限,以视网膜病变为主,这些眼病的发病机制尚不明确且治疗方法有限。研究表明,circRNA不仅与眼病的严重程度、预后相关,也是其发病机制相应基因调控网络的重要组成部分,在眼生理、病理过程中具有重要地位,是眼科疾病重要的生物标志物,深入研究circRNA在眼科疾病中的作用及机制有助于发现疾病的潜在治疗靶点。
利益冲突所有作者均声明不存在利益冲突

