沉默TRIM31基因表达通过调控Wnt/β-catenin信号通路抑制膀胱癌细胞的迁移与侵袭①
徐兵 李勇 刘明 刘永辉(南华大学附属第三医院泌尿外科,衡阳421900)
膀胱癌是一种泌尿系统肿瘤,位居全球男性最常见癌症的第7位,四分之三的病例发生于男性,但近年来,其在女性中的发病率和死亡率也呈明显上升趋势[1-2]。膀胱癌具有易转移、易复发特点,转移性膀胱癌一直以来都是临床上难以解决的问题,死亡率较高[3]。上皮-间质转化(epithelial mesenchy‑mal transition,EMT)是肿瘤细胞侵袭和转移的关键性过程,在膀胱癌进展中发挥重要作用[4]。因此,调控EMT,抑制膀胱癌细胞的侵袭与转移,将为膀胱癌的治疗提供更多可能。三结构域蛋白31(tripar‑tite motif containing 31,TRIM31)是含trip基因序列蛋白家族的一员,具有E3泛素连接酶活性,广泛参与机体生物学和病理过程。TRIM31在多种癌症中表达上调,且过度表达可促进肿瘤细胞的恶性行为,增强肿瘤的侵袭能力[5-6]。蔡坤等[7]发现,沉默胰腺癌细胞中TRIM31的表达可抑制肿瘤细胞的迁移和侵袭。有研究显示,TRIM31是正常人与膀胱癌患者间的差异表达基因之一,在膀胱癌中呈高表达[8]。但关于TRIM31在膀胱癌中的作用,对膀胱癌细胞迁移、侵袭及EMT的影响却鲜有报道,故本研究通过体外实验,观察沉默TRIM31基因表达对膀胱癌细胞迁移和侵袭的影响,并初步阐明其作用机制,以期为临床靶向治疗膀胱癌提供更多理论基础。
1 材料与方法
1.1 材料人膀胱癌细胞系5637和T24均购自中国科学院细胞库;DMEM培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;Lipofectamine®NAiMAX、TRIzol购自美国Invitrogen公司;反转录试剂盒购自大连TaKaRa公司;SYBR Green PCR试剂盒购自美国KAPA Biosystems公司;Matri‑gel胶购自美国BD公司;小鼠抗人TRIM31多克隆抗体、兔抗人β-连环蛋白(β-catenin)多克隆抗体、兔抗人基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)多克隆抗体、兔抗人MMP-9多克隆抗体、兔抗人波形蛋白(Vimentin)多克隆抗体、兔抗人上皮钙依赖黏附蛋白(E-cadherin)单克隆抗体、兔抗人Snail1多克隆抗体、兔抗人GAPDH多克隆抗体、山羊抗兔IgG抗体和山羊抗小鼠IgG抗体均购自英国Abcam公司;化学发光试剂、PVDF膜购自美国Milli‑pore公司;TRIM31 siRNA和阴性对照片段(NC)由北京华大基因设计合成;倒置荧光显微镜购自德国徕卡公司;荧光定量PCR仪、电泳仪、凝胶成像系统均购自美国Bio-Rad公司;Transwell培养小室购自美国Corning公司。
1.2 方法
1.2.1 细胞培养及转染从液氮罐中取出人膀胱癌5637和T24细胞,37℃水浴融化冻存液,1 000 r/min离心3 min,弃上清,加入1 ml DMEM重悬细胞沉淀。转移至培养瓶中,再加入4 ml含10%胎牛血清的新鲜DMEM,于37℃、5%CO2培养箱中传代培养。取对数生长期的5637和T24细胞,以2×105个/孔分别接种于6孔板,待细胞融合度达到80%时,将细胞分为对照组、siRNA-NC组和siRNATRIM31组,采用Lipofectamine®RNAiMAX转染试剂将TRIM31 siRNA和NC分别转染至细胞,转染48 h后收集细胞沉淀检测TRIM31 mRNA和蛋白表达水平,以验证转染效果。
1.2.2 qRT-PCR检测细胞中TRIM31 mRNA表达水平取各组细胞沉淀,TRIzol法提取细胞总RNA,反转录试剂盒合成cDNA,以cDNA为模板,利用SYBR Green PCR试剂盒进行PCR扩增检测。反应条件:94℃2 min;98℃变性10 s,54℃退火15 s,68℃延伸1 min,35个循环;72℃7 min。以下为引物序列,TRIM31 F:5'-GTCTTGTGCAGAAGTGAAGAGTT-3',R:5'-TCACAAAACCAAGCCCGGAT-3';GAPDH F:5'-AGAGCTACGAGCTGCCTGAC-3',R:5'-AGTAC-TTGCGCTCAGGAGGA-3'。以GAPDH为内参,采用2-∆∆Ct方法计算TRIM31 mRNA相对表达量。
1.2.3 Transwell检测细胞迁移与侵袭消化转染后的细胞,用不含血清的DMEM饥饿处理12 h。制作单细胞悬液,稀释至浓度为1×105个/ml,接种于Transwell小室,每小室含0.5 ml细胞悬液,下层24孔板中加入0.75 ml含10%胎牛血清的培养液,继续培养24 h。加入1 ml 4%甲醛固定10 min,再加入1 ml 0.5%结晶紫溶液染色30 min。PBS洗涤3次,室温晾干,擦去Transwell小室中没有迁移的细胞,于显微镜下随机取5个视野观察细胞迁移情况并计数。侵袭实验时,需在Transwell小室上室底部铺设Matrigel胶,其他步骤与迁移实验一致。
1.2.4 免疫荧光染色观察β-catenin蛋白核转位水平用胰酶消化各组细胞,制成单细胞悬液,以2×105个/孔接种于6孔板(孔内加入玻片),置于培养箱中培养24 h。弃培养液,加入4%多聚甲醛固定20 min,PBS清洗后,加入0.5%Triton X-100通透20 min,加入5%封闭液封闭1 h。PBS清洗,加入兔抗β-catenin抗体稀释液(1∶500),37℃孵育1 h。PBS洗涤3次,加入经荧光标记的二抗稀释液,37℃孵 育30 min,PBS洗涤3次,滴加DAPI避光孵 育10 min,PBS洗涤3次,再滴加抗荧光淬灭封片液,取一块干净的载玻片,吸取多余的液体,细胞面朝下贴于载玻片上,显微镜观察染色情况。
1.2.5 Western blot检测细胞中蛋白表达水平取各组细胞沉淀,采用RIPA裂解液提取细胞蛋白,经BCA法测蛋白浓度后,取20µg蛋白上样,进行SDS-PAGE电泳分离。湿转法将蛋白转印至PVDF膜,37℃封闭1 h。加入一抗稀释液TRIM31(1∶1 000)、β-catenin(1∶1 000)、MMP-2(1∶2 000)、MMP-9(1∶1 000)、Vimentin(1∶2 000)、E-cadherin(1∶1 000)、Snail1(1∶500)和GAPDH(1∶1 000),4℃孵育过夜。PBS清洗3次,加入二抗稀释液[经HRP标记的IgG(1∶10 000)],室温孵育1 h,PBS清洗3次。加入化学发光试剂,于凝胶成像系统中曝光显影,分析各蛋白条带灰度值,计算蛋白质相对表达量。
2 结果
2.1 siRNA沉默膀胱癌细胞中TRIM31基因表达
qRT-PCR(图1A)和Western blot(图1B)检测结果显示,与对照组相比,siRNA-NC组T24细胞和5637细胞中的TRIM31mRNA及蛋白表达水平差异无统计学意义(P>0.05);与siRNA-NC组相比,siRNATRIM31组T24细胞和5637细胞中的TRIM31mRNA及蛋白表达水平均降低(P<0.01),证实本研究成功获得TRIM31基因沉默的膀胱癌细胞株。
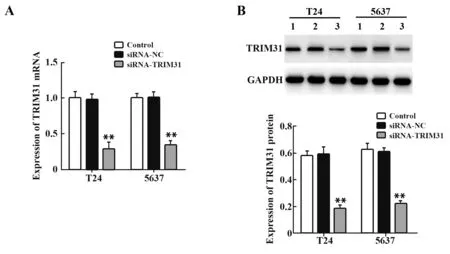
图1 TRIM31基因沉默对T24和5637细胞中TRIM31 mRNA和蛋白表达的影响Fig.1 Effect of silencing TRIM31 gene on mRNA and pro⁃tein expressions of TRIM31 in T24 and 5637 cells
2.2 沉默TRIM31基因对膀胱癌细胞迁移与侵袭的影响Transwell检测结果显示,与Control组相比,siRNA-NC组T24和5637细胞迁移和侵袭细胞数差异无统计学意义(P>0.05);与siRNA-NC组相比,siRNA-TRIM31组T24和5637细胞迁移和侵袭细胞数减少(P<0.01,图2、3)。Western blot结果显示,与Control组相比,siRNA-NC组T24和5637细胞中MMP-2和MMP-9蛋白表达差异无统计学意义(P>0.05);与siRNA-NC组相比,siRNA-TRIM31组T24和5637细胞中MMP-2和MMP-9蛋白表达水平明显降低(P<0.01,图4)。
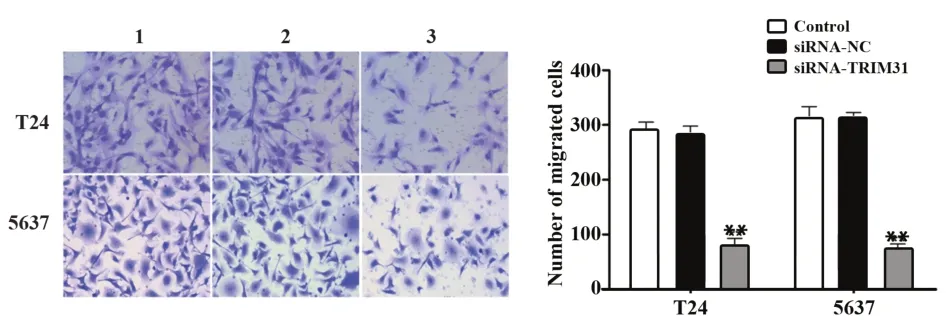
图2 TRIM31基因沉默对T24和5637细胞的迁移的影响(×200)Fig.2 Effect of silencing TRIM31 gene on migration of T24 and 5637 cells(×200)
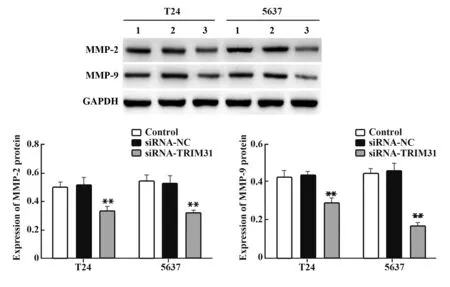
图4 TRIM31基因沉默对T24和5637细胞中MMP-2和MMP-9蛋白表达的影响Fig.4 Effect of silencing TRIM31 gene on protein expres⁃sions of MMP-2 and MMP-9 in T24 and 5637 cells
2.3 沉默TRIM31基因对膀胱癌细胞β-catenin蛋白核转位的影响免疫荧光染色结果显示,对照组和siRNA-NC组T24和5637细胞中β-catenin蛋白荧光在细胞核中高密度聚集,在细胞质中也有大量表达;而siRNA-TRIM31组T24和5637细胞中β-catenin蛋白荧光在细胞核和细胞质中均较弱(图5)。
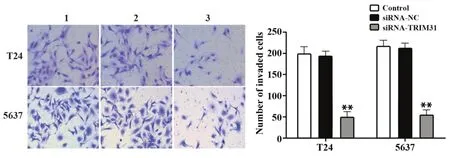
图3 TRIM31基因沉默对T24和5637细胞的侵袭的影响(×200)Fig.3 Effect of silencing TRIM31 gene on invasion of T24 and 5637 cells(×200)
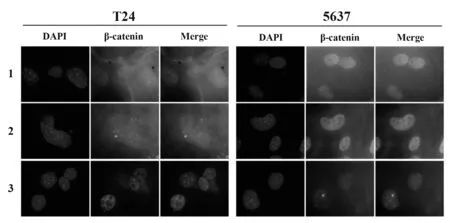
图5 免疫荧光染色观察T24和5637细胞中β-catenin蛋白定位(×400)Fig.5 Location of β-catenin protein in T24 and 5637 cells was observed by immunofluorescence(×400)
2.4 沉默TRIM31基因对膀胱癌细胞EMT相关蛋白及Wnt/β-catenin信号通路蛋白表达的影响与对照组相比,siRNA-NC组T24和5637细胞中βcatenin、Snail1、Vimentin和E-cadherin蛋白表达差异无统计学意义(P>0.05);与siRNA-NC组相比,siR‑NA-TRIM31组T24和5637细胞中β-catenin、Snail1和Vimentin蛋白表达水平降低(P<0.01),而E-cad‑herin蛋白表达水平升高(P<0.01,图6)。
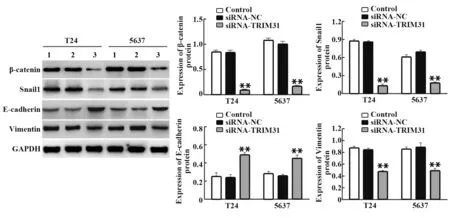
图6 Western blot检 测T24和5637细 胞 中β-catenin、Snail1、Vimentin和E-cadherin蛋白表达水平Fig.6 Expressions of β-catenin,Snail1,Vimentin and Ecadherin in T24 and 5637 cells were detected by Western blot
3 讨论
EMT发生在多种生理和病理条件下,由一组保守的诱导信号、转录调节因子和下游效应器驱动而成[9]。良性肿瘤向侵袭性增强表型进展的过程很大程度依赖于EMT的激活,调控EMT过程对肿瘤的治疗及控制转移具有重要作用[9-10]。膀胱癌是男性最常见的癌症之一,抑制膀胱癌细胞的迁移、侵袭和EMT成为治疗膀胱癌的新策略之一[11]。EMT相关标记蛋白包括E-cadherin、Vimentin和Snail1等[12]。研究发现,上调上皮质性标志物(E-cadherin),下调间质性标志物(Vimentin)可抑制肿瘤细胞的侵袭能力[13]。在肿瘤的发生发展过程中,多种信号通路可通过诱导EMT转录因子(如Snail1)的表达而触发EMT,最终促进肿瘤的侵袭、转移和耐药,当Snail1表达被抑制后则无法执行下游的信号传导,从而调控EMT过程[14]。SALEHI等[15]认为Snail1在膀胱癌的发生、发展中起重要作用,可作为浸润性膀胱癌靶向治疗的潜在靶点,当沉默膀胱癌细胞中Snail1表达时,Vimentin、MMPs均表达下调,E-cadherin表达上调,细胞迁移能力减弱。本实验中Transwell检测结果显示,当下调膀胱癌T24和5637细胞中TRIM31表达时,发生迁移与侵袭的T24细胞和5637细胞数量均明显少于对照组和空载组,说明沉默TRIM31表达可抑制膀胱癌细胞的迁移与侵袭能力。进一步检测EMT相关蛋白表达水平,结果显示,与对照组或空载组相比,TRIM31干扰组T24细胞和5637细胞中Vimentin与Snail1蛋白表达水平明显降低,E-cadherin表达水平明显升高,提示沉默膀胱癌细胞中TRIM31表达,可抑制肿瘤细胞EMT过程,从而影响膀胱癌细胞的迁移与侵袭能力。
Wnt/β-catenin信号通路可作为诱发EMT的因素之一,是EMT过程中重要的信号通路之一,抑制Wnt/β-catenin信号通路的活性可逆转肿瘤细胞的EMT,进而降低肿瘤的侵袭性[16-17]。β-catenin是介导细胞膜到细胞核间信号传导的中心分子,当βcatenin从细胞质转移到细胞核时,激活下游靶基因(Snail1、MMP-2、MMP-9等)。ZHANG等[18]研究结果显示,沉默膀胱癌细胞中β-catenin的表达,可通过Wnt/β-catenin信号通路逆转EMT,进而抑制膀胱癌细胞的转移与侵袭。SHI等[19]研究也发现抑制Wnt/β-catenin信号通路后,MMP-2和MMP-9表达降低,影响EMT的发生。有研究发现,敲除TRIM31基因可抑制急性髓系白血病细胞Wnt/β-catenin信号通路的激活,从而调控细胞的增殖、凋亡和耐药性[20]。本实验结果与上述研究发现基本一致,TRIM31基因在膀胱癌细胞中亦可调控Wnt/β-catenin信号通路的激活,当沉默T24细胞和5637细胞中TRIM31基因的表达,β-catenin表达减少,下游靶基因Snail1、MMP-2和MMP-9的表达也明显减少。本研究结果提示,抑制膀胱癌细胞中TRIM31基因的表达可抑制Wnt/β-catenin信号通路以及下游靶基因的表达水平,进而调控膀胱癌细胞EMT。
综上所述,沉默TRIM31可抑制膀胱癌细胞的迁移与侵袭,其作用机制可能与调控Wnt/β-catenin信号通路抑制膀胱癌细胞的EMT过程有关,推测TRIM31可能是膀胱癌治疗的潜在靶点。本研究结果为膀胱癌靶向治疗奠定了一定的实验基础,后续还将进一步从体内实验进行验证。

