CD30L 基因表达对脂多糖刺激后小鼠腹腔CD11b+细胞表型变化影响的研究①
张芷宁 王 笑 王晓楠 张晓清 孙 逊 (中国医科大学免疫学教研室,沈阳110000)
CD30 和 CD30 配 体(CD30 ligand,CD30L,CD153),分别属于肿瘤坏死因子超家族受体8(tu‑mor necrosis factor receptor superfamily 8,TNFRSF8)和肿瘤坏死因子超家族8(tumor necrosis factor su‑perfamily 8,TNFSF8)成员[1]。CD30 是Ⅰ型膜相关糖蛋白,最初发现于霍奇金淋巴瘤(Hodgkin's lym‑phoma,HL)和镜影细胞(Reed-Sternberg 细胞,R-S细胞),作为HL 中霍奇金氏细胞和R-S 细胞的标志物,主要表达在活化的效应性或记忆性T细胞,活化的 B 细胞和淋巴源性肿瘤细胞表面[2-3]。CD30L 是Ⅱ型膜相关糖蛋白,表达在巨噬细胞、树突状细胞、活化的 CD4+T 细胞、活化的 CD8+T 细胞、γδT 细胞、CD4+CD3−CD11c−辅助细胞表面[4-5]。CD30 和 CD30L在血液系统恶性肿瘤以及慢性炎性疾病,例如红斑狼疮、哮喘、类风湿性关节炎(rheumatoid arthritis,RA)和特应性皮炎(atopic dermatitis,AD)中表达上调[6]。CD30L/CD30 在免疫系统的各个方面均具有重要的调节功能,在人T 细胞白血病中,CD30 呈现高表达并活化核因子κB(nuclear factor kappa-B,NF-κB),促进肿瘤进展[7];在RA中CD30L/CD30发挥动态调节作用,驱动着复杂的促炎和抗炎机制[8];在过敏性鼻炎(allergic rhinitis,AR)中,CD30L 通过放大Th2 细胞应答效应,在过敏性鼻炎的发展中发挥重要作用[9]。故CD30L/CD30 可能在炎性疾病治疗中起到关键性作用。然而其影响炎性疾病的机制是否与固有免疫系统有关尚未明确。
高等脊椎动物的免疫系统,主要由固有免疫系统和适应性免疫系统构成,当机体受到损伤时,自身保护性免疫机制激活,出现炎症反应。巨噬细胞属于固有免疫系统的细胞,小鼠体内巨噬细胞的典型标志分子包括CD11b、F4/80 等,当出现环境刺激(如微生物产物、受损细胞)时,血液循环的单核细胞在趋化因子CCL2 的作用下,进入组织并且分化成巨噬细胞,位于炎症的浸润部位,可以吞噬有害微生物,清除凋亡细胞并促进创伤后的组织修复[10-11]。成熟的巨噬细胞可以进一步极化为经典活化型或替代活化型巨噬细胞[12]。LPS 是革兰氏阴性细菌外膜中的大分子,作为病原体相关模式分子(pathogen-associated molecular patterns,PAMP),可以与巨噬细胞表面Toll 样受体4(Toll-like receptor 4,TLR4)结合,活化巨噬细胞,使其抗原提呈和吞噬微生物的能力提高,并且促进促炎性细胞因子及毒性介质的分泌[13]。
本研究通过建立TGM 诱导的小鼠腹腔无菌炎症模型,分离腹腔CD11b+细胞,利用LPS 刺激,研究在炎症条件下CD30L 对CD11b+细胞表型变化的影响。结果显示,Cd30l基因的缺失使小鼠腹腔CD11b+细胞的活化性表型表达下降,抑制性表型表达上升,因此CD30L 可能对CD11b+细胞表型的变化产生影响。
1 材料与方法
1.1 材料
1.1.1 试剂和材料 RPMI1640 培养基购自美国Hyclone 公司;胎牛血清(FBS)购自Biological Indus‑tries 公司;脂多糖(LPS)、巯基乙酸培养基、红细胞裂解液购自Sigma 公司;流式抗体APCCy7 antimouse CD11b、FITC anti-mouse F4/80、BV605 antimouse CD86、PE anti-mouse CD30L、V500 anti-mouse I-A/E、CD16/32 购自 Biolegend 公司。
1.1.2 实验动物 8 周龄的SPF 级C57BL/6 雌性小鼠购自北京维通利华公司,小鼠饲养于SPF 屏障设施内。
1.2 方法
1.2.1 小鼠腹腔无菌炎症模型的建立 小鼠腹腔注射无菌PBS 和TGM,高压蒸汽灭菌锅高压灭菌PBS及TGM 121℃,15 min。使用5 ml注射器连续向小鼠腹腔注射无菌PBS或TGM 3 d,1 ml/(只·d)。
1.2.2 小鼠腹腔CD11b+细胞的分离培养 将小鼠颈椎脱臼处死,无菌条件下灌洗并收集腹腔细胞,常规裂解红细胞,接种于含有10% FBS 的RPMI 1640培养基中,置于37℃、5%CO2培养箱中培养2 h,去除未贴壁细胞。
1.2.3 流式细胞术检测注射TGM 前后WT 小鼠腹腔CD11b+细胞表型变化 制备单细胞悬液,调整浓度至1×106个/ml,100 µl抗体体系重悬细胞,按试剂盒说明书加入anti-CD16/32,避光冰上孵育15 min,加入F4/80、CD11b、CD86、CD30L、I-A/E 抗体,避光冰上孵育30 min。流式缓冲液洗涤细胞悬液,300µl流式缓冲液重悬细胞,上机检测。
1.2.4 体外LPS 刺激小鼠腹腔CD11b+细胞 调整细胞浓度为5×105个/ml 并分别接种于含有10%FBS 及 10、100、1 000 ng/ml LPS 的 RPMI1640 培养基中,分别培养8 h、16 h、24 h后收集细胞。
1.2.5 流式细胞术检测LPS 刺激WT 小鼠CD11b+细胞不同时间及浓度其表型的变化 制备单细胞悬液,调整浓度至1×106个/ml,100 µl抗体体系重悬细胞,按试剂盒说明书加入CD16/32,避光冰上孵育15 min,加入F4/80、CD11b、CD86、CD30L、I-A/E抗体,避光冰上孵育30 min。流式缓冲液洗涤细胞悬液,300µl流式缓冲液重悬细胞,上机检测。
1.2.6 流式细胞术检测LPS 刺激WT 和CD30LKO小鼠腹腔CD11b+细胞不同时间其表型变化 制备单细胞悬液,调整浓度至1×106个/ml,100 µl PBS重悬细胞,按试剂盒说明书加入CD16/32,避光冰上孵 育 15 min,加 入 F4/80、CD11b、CD86、I-A/E、CD206 抗体,避光冰上孵育30 min。流式缓冲液洗涤细胞悬液,300 µl 流式缓冲液重悬细胞,上机检测。
1.3 统计学处理 采用GraphPad Prism 7.0 软件,在满足方差齐性的条件下,两组间采用独立样本t检验(Student'sttest)进行比较,计量数据以表示,以P<0.05为差异有统计学意义。
2 结果
2.1 注射TGM 前后,WT小鼠腹腔巨噬细胞数量及表型变化 提取小鼠腹腔CD11b+细胞,流式细胞术检测PBS 注射组(对照组)和TGM 注射组CD11b+细胞数量变化及其表面 F4/80、CD86、I-A/E、CD30L表达情况。结果如图1所示,与对照组相比,TGM注射组细胞总数明显增高,CD11b+细胞数量增多。CD11b+细胞中CD86、F4/80表达无明显变化,I-A/E、CD30L 表达下降。结果表明,向小鼠腹腔注射TGM可募集大量CD11b+细胞,且抑制CD11b+细胞上I-A/E及CD30L表达。
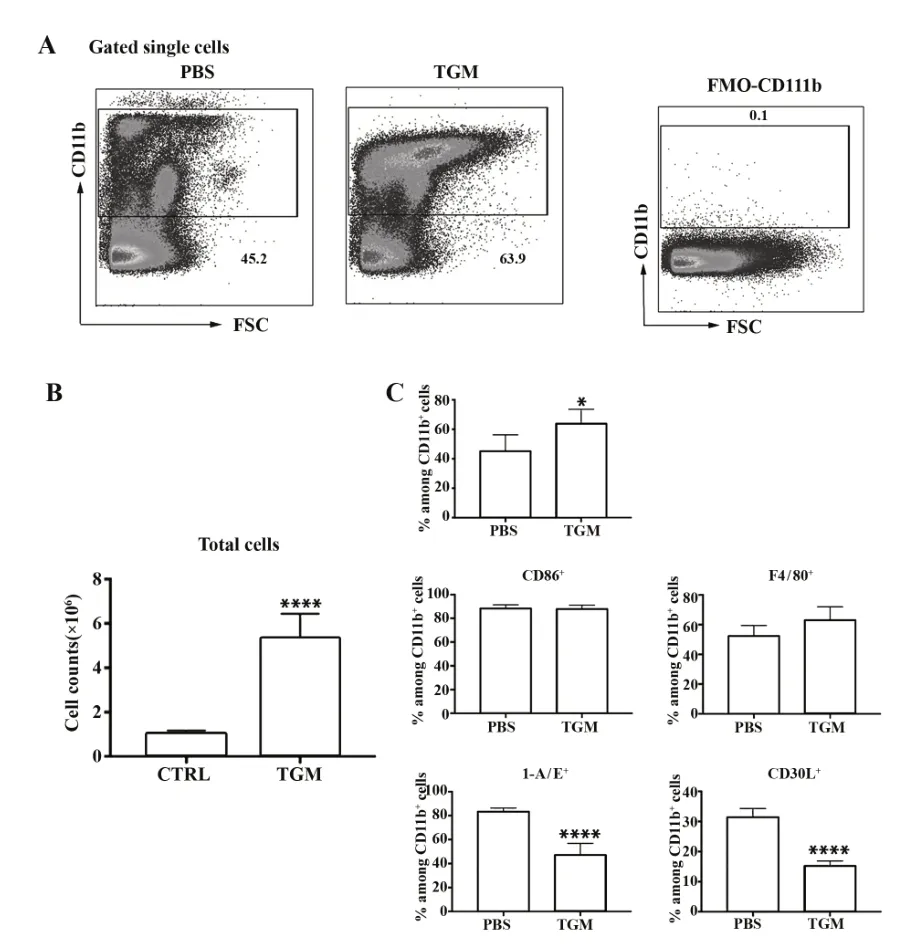
图1 向小鼠腹腔注射TGM 前后,CD11b+细胞数量及表型的变化Fig.1 Changes in number of CD11b+cells in mice after in⁃traperitoneal injection of TGM
2.2 不同条件下LPS 刺激小鼠腹腔CD11b+细胞表型变化结果分析 使用10、100、1 000 ng/ml LPS 分别刺激培养TGM 处理的WT 小鼠腹腔CD11b+细胞8 h、16 h、24 h,并用流式细胞术检测表型分子表达情况。结果如图2 所示,随着LPS 刺激CD11b+细胞时间的增加,CD11b+细胞数量逐渐增加,CD11b+细胞表面活化表型F4/80、CD86、I-A/E 表达逐渐增高,尤其在100 ng/ml 条件下上升最为明显。使用流式细胞术检测不同时间点CD11b+细胞上CD30L的表达,结果显示,与对照组(0 h)相比,LPS 刺激组CD30L的表达随着刺激时间的增加而增高。
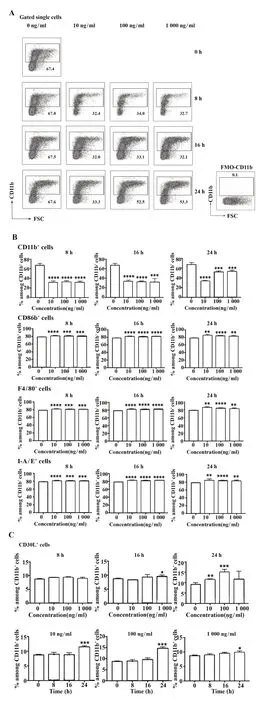
图2 不同条件的LPS刺激下,CD11b+细胞表面分子的表达变化Fig.2 Changes in expression of CD11b+cells surface mole⁃cules under different LPS conditions
2.3Cd30l基因缺失对LPS 刺激小鼠腹腔CD11b+细胞表型变化的影响 加入浓度为100 ng/ml 的LPS 刺激小鼠腹腔 CD11b+细胞 8 h、16 h 以及 24 h,并通过流式细胞术检测细胞表型的变化。流式结果表明,随着刺激时间的增加,与WT 小鼠相比,Cd30l基因敲除组小鼠CD11b+细胞百分比上升,CD11b+细胞中 CD86、I-A/E 表达逐渐降低,CD206表达逐渐增高(如图3)。
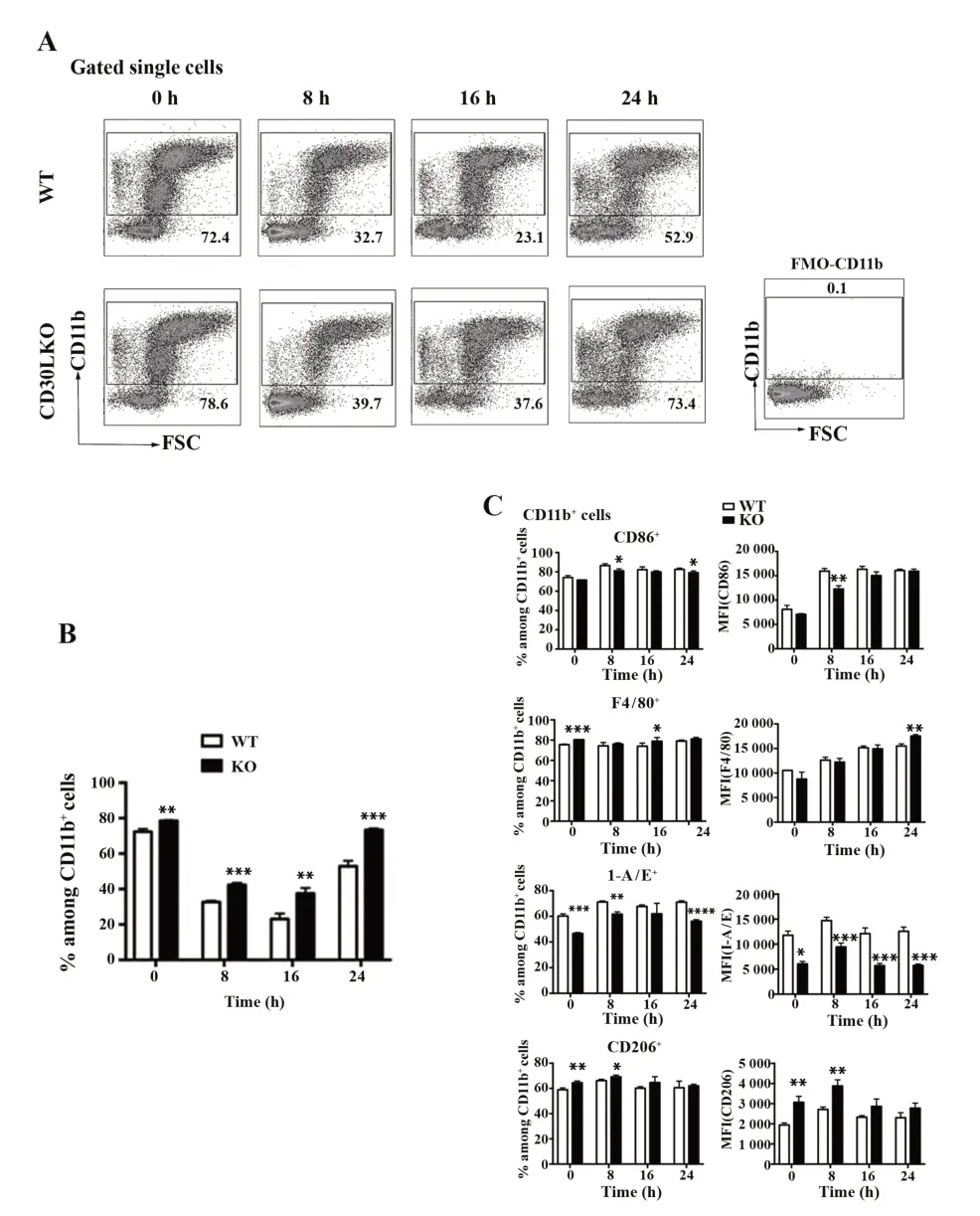
图3 CD30L对CD11b+细胞上活化与抑制表型的影响Fig.3 Effects of CD30L molecules on expression of acti⁃vated and inhibited phenotypes in CD11b+cells
3 讨论
小鼠腹腔巨噬细胞是目前为止研究最深入的组织巨噬细胞群之一,它在清除凋亡细胞和调节炎症反应中扮演重要角色[14-16]。在炎症及肿瘤发生发展过程中,CD30 与其配体CD30L 结合后可进一步激活下游的转录因子,从而介导细胞增殖或凋亡。而LPS可激活巨噬细胞,引起细胞因子合成和释放,进而导致炎症的发生。CD11b 是白细胞黏附因子β 2 整合素的α 亚单位,它作为整合素家族成员之一,是巨噬细胞表面的经典标志物。表皮生长因子样激素受体 1(EMR1),又称 F4/80,作为 EGF TM7 蛋白家族的一员,它是小鼠巨噬细胞成熟的标志物[17]。有学者指出,腹腔巨噬细胞表达出不同水平的F4/80,主要是因为它们分化和激活的状态不同[18]。抗原提呈细胞(antigen presenting cell,APC)包括巨噬细胞、B 淋巴细胞、树突状细胞等[19]。主要组织相容性Ⅱ类分子(MHC Ⅱ)主要表达于APCs,参与T 细胞的激活和分化,调控适应性免疫应答。CD86 可以与 T 细胞表面 CD28 结合,作为 T 细胞活化 的 第 二 信 号[20]。 甘 露 糖 受 体 Mrc1,也 称 为CD206,它表达在大多数巨噬细胞和树突细胞亚群的表面,是M2 表型小鼠巨噬细胞的标志物,参与抗原呈递、内吞和吞噬、信号转导、固有免疫及适应性免疫应答反应[21-22]。
有研究将基因敲除小鼠用于鉴定参与巨噬细胞分化过程中的转录因子,指出PU. 1和C/ EBPα是巨噬细胞前体生成所必需的分子[23]。而本研究利用CD30L 基因敲除小鼠对LPS 刺激CD11b+细胞过程中的变化进行了研究。本研究向小鼠腹腔注射TGM 后,募集到大量CD11b+细胞,成功建立无菌炎症模型。随后,本课题组分离培养了原代CD11b+细胞,证明CD30L 表达在CD11b+细胞上,并且发现在LPS诱导激活后,巨噬细胞表面F4/80表达上调,提示CD11b+细胞吞噬能力增强;其表面CD30L 表达上调,提示CD30L 参与了LPS 刺激巨噬细胞活化的过程,并且可能对其活化产生了作用。随后,本研究进行了浓度梯度实验观察在LPS 刺激下CD11b+细胞表面表型的变化,发现其在100 ng/ml 时的变化最为明显。进而选择100 ng/ml 作为刺激条件,利用Cd30l基因敲除小鼠进一步展开研究。结果发现,Cd30l基因敲除后,在LPS体外刺激条件下,巨噬细胞表面抑炎性表型CD206 表达增加,促炎性表型CD86、I-A/E 表达降低,提示其在LPS刺激下可能向着抑炎性表型活化,因此,推测CD30L 可能参与调控小鼠腹腔巨噬细胞的活化。
以往有学者对CD30L/CD30信号通路进行了研究。在OVA 诱导的过敏性鼻炎模型中,CD30L 起到抑炎作用[9];在小鼠脑胶质瘤模型中,在肿瘤条件下,与WT 小鼠相比,CD30LKO 组小鼠肿瘤相关巨噬细胞比例明显增高,CD206 表达增高,I-A/E 表达下降[24],与本研究结果一致。
综上所述,Cd30l基因的缺失能促进小鼠腹腔CD11b+细胞抑制性表型CD206 的表达上调,抑制活化性表型CD86 的表达,而在炎症条件下这种影响的具体信号通路还有待进一步研究。

