TWIST1基因通过调节mTOR信号通路对口腔鳞癌Tca8113细胞增殖凋亡的影响
程 珏 辛鹏飞 程 琳 庄润涛 刘志荣 (北京交通大学社区卫生服务中心,北京100044)
口腔颌面鳞状细胞癌(oral cavity squamous cell carcinoma,OSCC),被简称口腔鳞癌,多发生于40~60 岁中老年人群,是一种最为常见的口腔恶性肿瘤,占口腔癌的90%[1-2]。世界范围内口腔癌发病率相对较高的地域包括巴西、巴基斯坦和法国等。虽然医学技术不断提高,但统计数据显示,头颈部鳞状细胞癌患者五年生存率在过去的几十年里并没有得到明显改善[3]。因此,研究口腔癌的治疗方法对于口腔鳞癌的临床治疗具有重要意义。
人TWIST相关蛋白(twist-related protein,TWIST)最早发现于果蝇中,主要包括TWIST1 和TWIST2两种不同蛋白结构[4]。在不同物种之间,TWIST1 是高度保守的,研究发现TWIST1 异常表达,与肺癌、胃癌、三阴性乳腺癌、直肠腺癌等发生有密切关系,有文献证实TWIST1 可能调节下游因子的转录,或者调节蛋白的修饰,从而调节肿瘤细胞的侵袭、增殖和凋亡等生物学过程,但是TWIST1 如何影响口腔颌面鳞状细胞癌细胞的生物学过程以及具体机制尚不明确。
大量文献证实,细胞自噬在维持细胞存活、分化和稳态中发挥了关键作用,最近研究发现自噬与多种肿瘤细胞的侵袭、恶性转化均密切相关[5-6]。参与自噬过程中的两个重要调控因子分别为Beclin1和LC3。自噬相关基因Beclin1 是自噬启动的关键基因,也是自噬通路的关键调节器[7]。同样,在自噬过程中还有一个重要的调控因子,即微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3),它也是哺乳动物中了解最为透彻的一种蛋白[8]。文献证实 Beclin1 和 LC3 的表达异常与肿瘤的发生、发展密切相关,若能有效调控自噬反应,则是治疗肿瘤的一种新途径。
雷帕霉素靶蛋白(mammalian target of rapamy‑cin,mTOR)信号通路是研究最多的一种致癌途径,该信号通路的异常激活与许多癌症的发生有关[9]。目前研究显示,mTOR 信号通路的过度激活与肺癌、膀胱癌、食道癌等的发生相关,但是关于TWIST1 是否可以通过mTOR 信号通路对口腔鳞癌细胞增殖、凋亡发挥调控作用的研究少有报道[10-11]。因此,本研究探讨TWIST1对口腔鳞癌Tca8113细胞增殖、凋亡的影响以及其可能的调控机制,为口腔鳞癌的发病和治疗提供新依据。
1 材料与方法
1.1 材料
1.1.1 试剂 DMEM 培养基、胎牛血清、双抗购自美国HyClone 公司;CCK-8 试剂购自大连美仑生物技术有限公司;Lipofectamine 3000 转染试剂、培养板、培养瓶购自美国Thermo 公司;TWIST1 shRNA、阴性对照序列购自汉恒生物科技(上海)有限公司;Edu、TUNEL 染色试剂盒购自江苏凯基生物技术股份有限公司;Beclin1 和LC3 ELISA 试剂盒购自上海邦奕商贸有限公司;SYBR Primer Ex Taq 荧光定量PCR 试剂盒购自美国 TaKaRa 公司;TWIST1、U6 引物购自南京金斯瑞生物科技有限公司;p-mTOR(#2971)、p-P70S6K(#9204)、GAPDH(#5174)和兔抗二抗(#14708)购自美国CST公司。
1.1.2 仪器 超纯水系统购自美国Millipore公司;酶标仪购自美国Bio-Tek 公司;CO2培养箱、低温冰箱购自美国Thermo 公司;荧光定量PCR 仪、电泳仪购自美国Bio-Rad 公司;电子天平购自北京海天友诚科技有限公司;高温灭菌锅购自上海吉盛医学科技有限公司。
1.1.3 细胞 人口腔鳞癌细胞系(Tca8113)购自中国科学院典型培养物保藏委员会细胞库,完全培养基为1%双抗、10%胎牛血清的DMEM培养基。
1.2 方法
1.2.1 Tca8113 细胞的培养及转染 Tca8113 细胞培养在完全培养基内,2~3 d 后传代培养,用于后续实验。以 1×106个/ml 密度接种于 6 孔板内,利用Lipofectamine 3000 转染试剂将sh-TWIST1 和阴性对照序列转染至Tca8113 细胞,以只加入Lipo‑fectamine 3000 转染试剂的Tca8113 细胞作为对照组。
1.2.2 QRT-PCR 法检测Tca8113 细胞中TWIST1 mRNA 水平 收集3组Tca8113细胞,向含有细胞沉淀的EP 管内加入Trizol,将细胞裂解。根据第一链反转录试剂盒说明书,将RNA 反转录为cDNA,向管内加入上、下游引物,以 U6 作为内标,用 2−ΔΔCt计算TWIST1 mRNA相对表达水平。
1.2.3 CCK-8 法测定Tca8113 细胞存活率 以5×103个/孔密度接种于 96 板,在 3 组细胞培养 24 h、48 h 后,重复3 孔,每孔加入10 µl CCK-8 试剂,孵育4 h后,在490 nm 波长下检测细胞的吸光度(A)。细胞活力百分比(%)=(A样品−A空白)/(A标准品−A空白)×100%。
1.2.4 Edu 法测定Tca8113 细胞增殖能力 使用4%多聚甲醛固定各组细胞,加入0.3%Triton X-100溶液透化15 min,加入100 µl× Click-iT EdU 染色液至每个孔,简短摇晃培养板以确保反应物可以均匀覆盖细胞,避光孵育30 min,除去洗涤液,在显微镜下观察绿色荧光细胞数目。
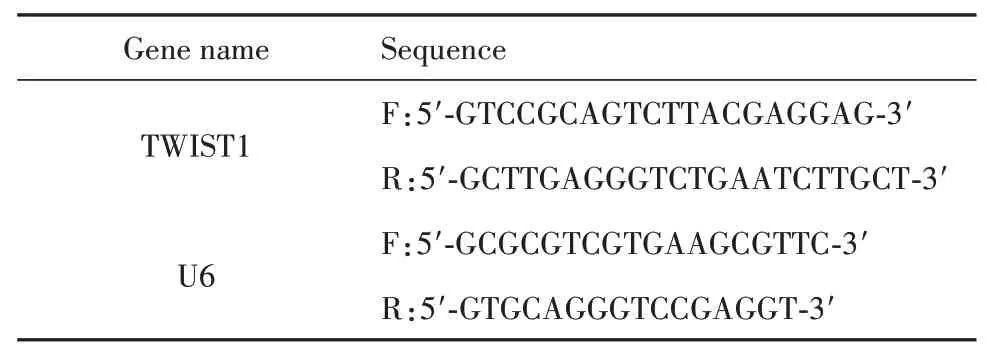
表1 TWIST1和U6引物序列信息Tab.1 TWIST1 and U6 primer sequence information
1.2.5 TUNEL 染色法检测Tca8113 细胞凋亡情况 将细胞涂片浸入4%多聚甲醛固定液的染缸中,室温固定 20 min,用 PBS 清洗 3 次,每次 5 min。每孔内滴加100µl Proteinase K工作液,反应15 min,再滴加 100 µl DNaseⅠ Buffer,处理 30 min,滴加50 µl TdT 反应液,避光孵育60 min,再加入DAPI 染色液复染细胞核,室温避光10 min。在荧光显微镜下检测细胞凋亡情况。
1.2.6 Western blot法检测Tca8113细胞中Beclin1、LC3、p-mTOR和p-P70S6K蛋白表达水平 收集3组细胞,加入蛋白裂解液将细胞冰上裂解,收集蛋白上清液。加入5 倍SDS 上样缓冲液,煮沸10 min。电泳后用转膜仪将蛋白转移至PVDF 膜,5%BSA 液封闭 1.5 h,洗膜,加入 Beclin1、LC3、p-mTOR 和 p-P70S6K一抗,4℃孵育过夜,加入二抗,孵育1 h。向PVDF膜滴加发光液,分析条带光密度。
1.3 统计学分析 采用SPSS17.0软件进行数据分析,计量资料多组间比较采用单因素方差分析,两样本均数采用t检验,计量资料以表示,并用Prism 6.0 软件作图,P<0.05 为差异具有统计学意义。
2 结果
2.1 TWIST1 在 sh-TWIST1 组表达 下 降 qRT-PCR和Western blot 的结果如图1A、B 所示,与空白对照组和阴性对照组相比,TWIST1 mRNA 和蛋白在sh-TWIST1 组Tca8113 细胞中的表达水平下降(P<0.05),而空白对照组与阴性对照组无差异。
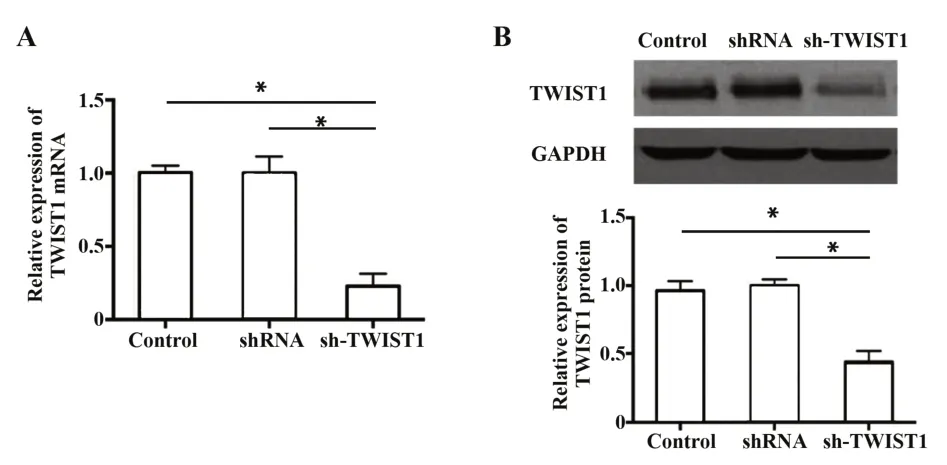
图1 TWIST1 mRNA的表达水平Fig.1 Expression of TWIST1 mRNA
2.2 TWIST1 沉默后提高Tca8113 细胞的活力 CCK-8 法检测了 TWIST1 对 Tca8113 细胞活力的影响,结果显示,与空白对照组和阴性对照组相比,24 h、48 h 后 sh-TWIST1 组的 Tca8113 细胞活力均明显升高(P<0.05),且空白对照组与阴性组无差异(图2)。
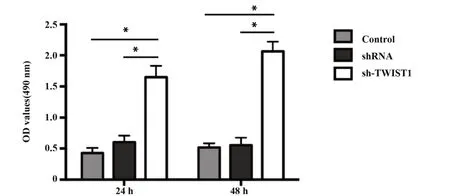
图2 Tca8113细胞活力的比较Fig.2 Comparison of cell viability in Tca8113 cells
2.3 TWIST1 沉默后提高Tca8113 细胞的增殖能力 Edu 染色结果如图3A 所示,发现与空白对照组和阴性序列对照组相比,sh-TWIST1组的Tca8113细胞增殖能力明显提高(P<0.05),且空白对照组与阴性对照组无差异(图3B)。
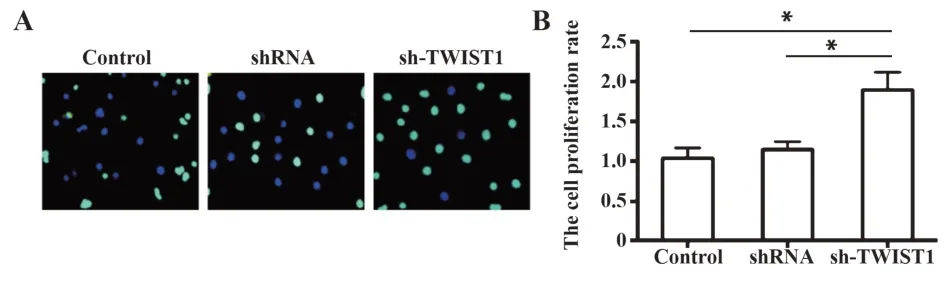
图3 Tca8113细胞增殖能力的比较(×20)Fig.3 Comparison of cell proliferation ability of Tca8113 cells(×20)
2.4 TWIST1 沉默后抑制Tca8113 细胞的凋亡 TUNEL 染色结果如图4A 所示,与空白对照组和阴性对照组相比,sh-TWIST1组的Tca8113细胞凋亡数目明显降低(P<0.05),且空白对照组与阴性对照组无差异(图4B)。
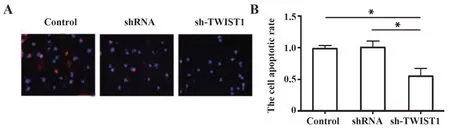
图4 TUNEL法检测细胞凋亡情况(×20)Fig.4 Apoptotic rate was detected by TUNEL staining(×20)
2.5 TWIST1 沉默后 Tca8113 细胞中 Beclin1 和 LC3水平变化情况 Western blot 结果如图5A、B 所示,与空白对照组和阴性对照组相比,sh-TWIST1 组的Tca8113 细胞中 Beclin1 水平下降(P<0.05),LC3 水平明显提高(P<0.05),且空白对照组与阴性对照组无差异。
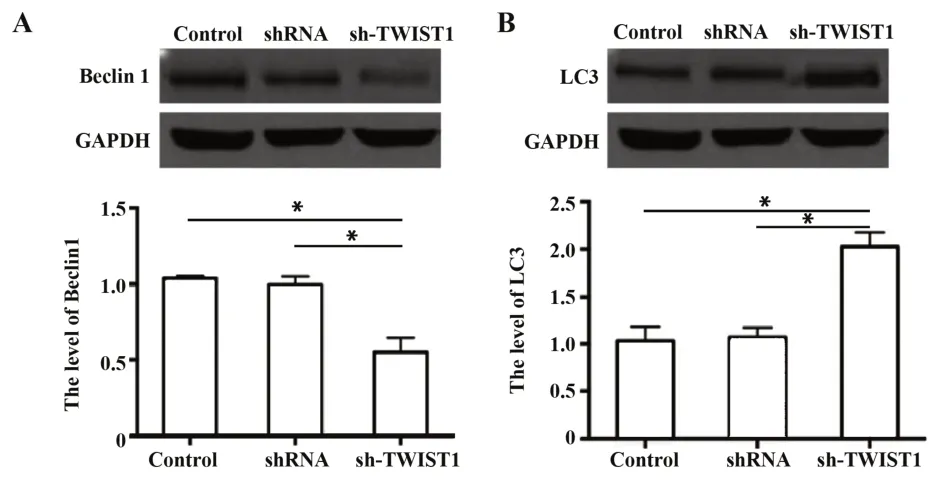
图5 Beclin1和LC3表达水平Fig.5 Expression levels of Beclin1 and LC3
2.6 TWIST1 沉默后促进Tca8113 细胞中p-mTOR和p-P70S6K 蛋白的表达 Western blot 结果如图6A所示,与空白对照组和阴性对照组相比,sh-TWIST1组的 Tca8113 细胞中 p-mTOR 和 p-P70S6K 蛋白水平升高(P<0.05),给予 mTOR 信 号通路 激 动剂(MHY1485、MCE、HY-B0795)后,Tca8113 细胞中p-mTOR 和p-P70S6K 蛋白水平升高更为显著(P<0.05),且空白对照组与阴性对照组无差异(图6B)。
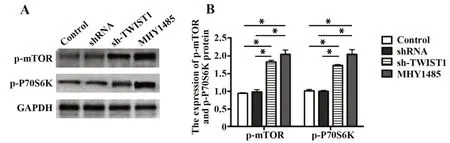
图6 p-mTOR和p-P70S6K蛋白表达情况Fig.6 Expressions of p-mTOR and p-P70S6K proteins
3 讨论
鳞状细胞癌多发生在鳞状上皮覆盖的部位,如皮肤、口腔和食管等。口腔鳞癌占口腔颌面部恶性肿瘤90%以上,世界卫生组织预计在未来十几年口腔鳞癌的发病率会持续上升,已然成为世界公共卫生问题[12]。尽管手术方式在临床上已经取得了一定进展,但对于晚期失去手术机会的口腔鳞癌患者来说,目前尚无安全有效的治疗药物[13]。所以,为了提高口腔鳞癌的治疗效果,大量研究应该关注新药的开发和新机制的发现,以便于发现和寻找更有潜在治疗价值的方案或者手段。
研究发现人TWIST1 在口腔鳞癌的发生中发挥重要作用,它位于7p21.2,随着对其生物学功能的深入研究,TWIST1 是近些年来备受关注的原癌基因之一[14]。DUAN 等[15]发现低氧状态下可以促进口腔鳞癌细胞的侵袭和迁移,其机制可能与调控Bcl-2/TWIST1信号通路有关。另外,KONG 等[16]发现调节TWIST1 和ZEB2 复合物对口腔鳞癌细胞的存活具有重要作用。但是TWIST1 对口腔鳞癌细胞增殖、凋亡的调控作用却尚不明确。所以,本研究首先利用Lipofectamine 3000转染试剂将sh-TWIST1和阴性对照序列转染至Tca8113 细胞,然后利用QRTPCR 法检测 48 h 后 TWIST1 mRNA 的表达情况,结果如图1 所示,sh-TWIST1 组细胞中TWIST1 mRNA表达水平明显下降。接下来通过CCK-8和Edu染色法检测TWIST 基因对口腔鳞癌细胞增殖和活力的影响,发现与空白对照组和阴性对照组相比,sh-TWIST1 组细胞的活力和增殖能力明显提高。随后,利用TUNEL 染色方法检测了TWIST1 基因对Tca8113 细胞凋亡的影响,结果如图4 所示,sh-TWIST1 组细胞凋亡数目明显下降,说明TWIST1 沉默后,显著抑制了Tca8113细胞的凋亡。
已有大量文献表明细胞的自噬反应在增殖、凋亡和分化等生物过程中发挥了关键的调控作用,自噬是一种细胞降解受损细胞器和异常胞内蛋白的生理过程,也是一种高度保守的细胞行为,即细胞质蛋白通过自噬作用被包裹进入囊泡中,与溶酶体形成自噬溶酶体[17]。自噬相关基因对生物体的存在十分重要,自噬相关基因的缺失不仅会导致细胞的快速死亡,研究还发现自噬功能缺失的小鼠会出现神经、肝脏的损伤。其中Beclin1 和LC3 是两个重要的调控因子,研究显示Beclin1 位于人染色体17q21 上,可以形成复合体调节自噬活性;而LC3 与磷脂酰乙醇胺结合形成复合物,且其含量与自噬的发生呈现正相关[18-19]。本研究利用ELISA 试剂盒检测了TWIST1 基因对Beclin1 和LC3 表达的影响,结果如图5所示,发现TWIST1沉默后,Tca8113细胞中Beclin1 水平降低,LC3 水平升高,说明此时伴有异常激活的自噬反应发生。为了探究TWIST1 基因的调控机制,本研究锁定了mTOR 信号通路。人mTOR 位于1p36.2,编码蛋白由2 549 个氨基酸组成 ,mTOR 包 括 mTORC1 和 mTORC2 两 种 蛋 白 。mTOR 可刺激下游靶点核糖体40S小亚基S6蛋白激酶(p-P70S6K),p-P70S6K 含有一个高度保守的氨基端,它本身不具有生物功能活性,但被mTOR磷酸化激活后进而磷酸化S6 蛋白,导致P-P70S6K 蛋白结构发生变化,促进蛋白质的合成[20]。因此,本研究利用 Western blot 法检测了 p-mTOR 和 p-P70S6K 蛋白表达水平,结果显示当TWIST1 沉默后,p-mTOR和p-P70S6K 的表达水平均显著提高,说明mTOR 信号通路被激活。
综上所述,本研究发现当TWIST1 基因沉默后,可促进口腔鳞癌Tca8113 细胞的存活和增殖,并抑制其凋亡,说明TWIST1基因可能是通过激活mTOR信号通路调节自噬反应而发挥作用。今后,本课题组可能通过构建TWIST1 过表达质粒,进一步探究TWIST1对口腔鳞癌细胞增殖凋亡的调控机制。

