Clec9A介导的体内坏死细胞清除机制研究进展①
晏 黎 黄 伟 全紫瑶 崔天盆 (湖北中医药大学附属武汉市中西医结合医院检验科,武汉430022)
恶性肿瘤由于生长迅速,肿瘤中央部位血液供应相对不足,易导致肿瘤细胞发生坏死。同时,细胞坏死也是机体病毒感染的常见结果之一,且可发生于病毒感染的任一阶段[1]。未被及时清除的坏死细胞,会通过释放胞内物质,如损伤相关分子模式(damage-associated molecular patterns,DAMPs)物质,引起炎症反应[2-3]。因此,机体免疫系统通过识别DAMPs 以起到清除坏死细胞和抑制炎症反应的功能[3]。
C 型凝集素 9 家族 A 成员( C-type lectin domain family 9,member A,Clec9A),又称为树突状细胞-NK细胞凝集素群受体1(DC-NK lectin group receptor-1,DNGR-1)是一种限制性表达在人外周血BDCA3+树突状细胞(dendritic cells,DC)和小鼠 CD8α+DC、CD103+DC 上识别细胞死亡信号的 DAMPs 受体[4-8]。研究表明人BDCA3+DC 具有与小鼠CD8α+DC 相似的表型和功能特性,能利用Clec9A 识别坏死细胞,通过主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类分子交叉提呈坏死细胞抗原[5,7-10]。
Clec9A 分子与受损或坏死细胞暴露的细胞骨架成分——纤维状肌动蛋白(filaments actin,F-ac‑tin)结合后通过其胞质区的免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif,ITAM)募集和活化脾酪氨酸激酶(spleen tyrosinebased kinase,Syk),交叉提呈坏死细胞的抗原,激活细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL),启动机体对坏死细胞的清除[4-6,11](见图1)。本文将从Clec9A 的分子结构、配体、信号通路、交叉提呈抗原等方面来阐述其介导坏死细胞清除的机制及研究进展。
1 Clec9A 的CTLD 是结合纤维状肌动蛋白的特异位点
Clec9A 属于2 型跨膜蛋白,具有典型的V 群C型凝集素样受体的结构。包括细胞外C型凝集素区域(C-type lectin-like domain,CTLD)、颈部区域和跨膜区以及胞质内带有半免疫受体酪氨酸活化基序(hem-ITAM)[6](见图 1)。ZHANG 等[11]研 究 发 现Clec9A 的 CTLD 是识别 F-actin 的区域,这与其中两个色氨酸残基有关。CTLD 结构虽与其他C 型凝集素相似,但这种特异性并不存在于其他C 型凝集素中[4,12]。进一步对 CTLD 结合 F-actin 的结构进行研究,发现每个CTLD 与螺旋状排列在F-actin 中的3个肌动蛋白亚基作用,连接两个肌动蛋白原丝[12]。这种拓扑结构不同于其他肌动蛋白结合结构,证实Clec9A 受体的特异性,与其作为识别坏死细胞的受体功能相一致。2016 年,HANČ 等[13]发现 Clec9A 的颈部区域能够感知细胞外pH 值和离子强度的变化,做出相应结构的改变,以提高交叉提呈抗原的能力。同时用其他C 型凝集素颈部结构替换,发现不能促进坏死细胞抗原的表达。表明Clec9A 的颈部区域属于受体功能完整性的一部分,对抗原的有效提呈是必不可少的。
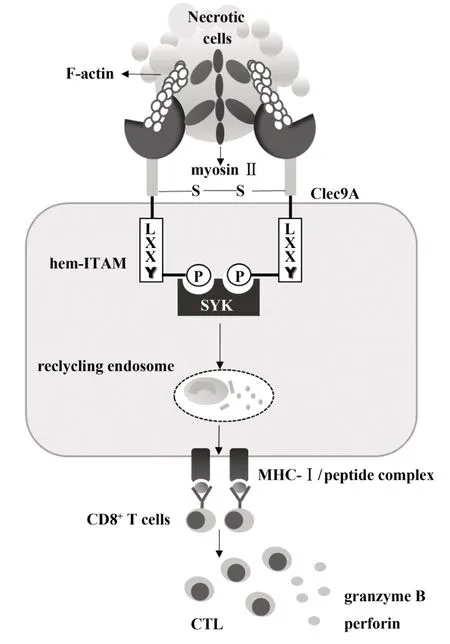
图1 Clec9A介导的体内坏死细胞清除机制示意图Fig.1 Clec9A mediated mechanism of phagocytosis necrotic cells in vivo
综上所述,Clec9A 的功能不同于其他C 型凝集素,能够特异性识别坏死细胞,交叉提呈至CD8+T细胞[4,11-12]。在识别过程中,病原因素所导致细胞损伤释放的细菌毒素、病毒核衣壳等微环境能够增加CTLD 对 F-actin 的亲和力[12]。此外,Clec9A 的颈部区域结构在抗原内吞途径中发生构象改变,这有助于坏死细胞抗原的交叉提呈[13]。
2 Clec9A 通过结合暴露的纤维状肌动蛋白识别坏死细胞
肌动蛋白是真核细胞中最丰富、最保守、功能最广泛的蛋白之一,是细胞骨架微丝系统的主要组成成分,在球状(G-actin)和丝状(F-actin)之间经历聚合和拆卸的循环[14]。SANCHO 等[5]发现 Clec9A的配体对糖苷酶和核酸酶有抵抗性,但对蛋白酶、高温和酸敏感。认为其配体是一种由于细胞坏死,失去胞膜的完整性而暴露出来的胞质蛋白质。进一步对配体受体复合物进行质谱分析发现该复合物是一个复杂的细胞骨架蛋白,包括血影蛋白、肌球蛋白和细丝蛋白[4]。2012 年,AHRENS 等[4]和ZHANG 等[11]研究发现纤维状肌动蛋白是 Clec9A 的特异性配体[4,11](见图 1)。近年研究指出Ⅱ型肌球蛋白(Myosin Ⅱ)能将肌动蛋白丝组织成束状,增强Clec9A 与 F-actin 的结合力[14]。而缺乏Ⅱ型肌球蛋白的纤维状肌动蛋白会减弱其刺激Clec9A 交叉提呈坏死抗原的能力。这一发现为临床增强Clec9A疫苗效果提供了新策略。
当细胞受到损伤,细胞膜破裂时,并不会突然导致细胞骨架完整性的丧失,相反死亡细胞也会保留聚合的肌动蛋白丝作为细胞坏死的信号[4]。这一特点使大量暴露的F-actin 非常适合作为一种细胞损伤的危险信号启动机体免疫反应[4,14]。而Clec9A结合F-actin 是启动坏死细胞相关抗原表达的基础[4-5,11-12]。此外,Clec9A 还可以识别晚期凋亡细胞,可能是由于细胞膜完整性丧失和胞膜上肌动蛋白暴露所致[11]。
3 Clec9A 通过激活胞内脾酪氨酸激酶Syk启动内吞坏死细胞
研究表明Clec9A 是一个激活受体,也是一个内吞受体[5-6]。Clec9A 的胞质含有与 C 型凝集素 1(Dectin-1)相同的 hem-ITAM 序列,且 Dectin-1 启动的信号通路依赖 Syk 激酶。因此,HUYSAME 等[6]构建了与Clec9A和Dectin-1胞质尾部相一致的酪氨酸磷酸化和非磷酸化形式的多肽,与RAW264.7 巨噬细胞溶解产物的信号分子进行免疫印迹反应,发现Clec9A 胞质的hem ITAM 序列能募集和活化Syk 激酶,诱导产生高水平的肿瘤坏死因子、Ⅲ型干扰素等。这些细胞因子能够激活体内其他免疫细胞,共同清除体内坏死细胞。进一步研究确认Clec9A 结合F-actin 后依赖Syk 激酶启动下游信号通路,内吞坏死细胞,同时信号启动的能力与结合F-actin 的含量有关[4-6](见图1)。
SCHREIBELT 等[7]通过 NIH3T3 成纤维细胞表面交联Clec9A 观察细胞表面受体,发现随着时间推移受体数目逐渐减少,晚期核内体/溶酶体标记物LAMP-1 染色也证实细胞内形成内吞小泡。与大多数的受体摄取抗原后将抗原送入胞质溶酶体内处理不同的是,Clec9A 通过Syk 激酶信号将坏死细胞碎片转移到一个不可降解的循环内体腔室,经过MHCⅠ类途径提呈[10](见图1)。这种特性可能会使Clec9A 保护抗原不被溶酶体降解,最大限度地提取抗原,继而激活机体获得性免疫应答。
4 Clec9A 交叉提呈坏死细胞抗原至CD8+T细胞,激活CTL
Clec9A 交叉提呈的坏死细胞抗原包括非感染的坏死细胞、病毒感染的坏死细胞和肿瘤相关抗原,在治疗肿瘤、抗病毒感染中具有重要作用[5,7,10,15]。IBORRA 等[15]研究指出向小鼠注射牛痘病毒感染细胞后,Clec9A 识别坏死细胞中的配体,启动抗牛痘病CD8+T 细胞的交叉反应(见图1)。在高免疫原性的环境(单纯疱疹病毒感染),缺乏Clec9A 的树突状细胞会影响 CTL 的活化[10]。体外培养BDCA3+DC 能够交叉提呈黑色素瘤抗原肽至CD8+T 细胞[7]。此外,最新研究指出 Clec9A 可以促进CD169+巨噬细胞摄取抗原后,通过cDC1s 激活CD8+T细胞的能力[16]。
活化的CTL 通过识别MHC Ⅰ类途径交叉提呈的抗原,特异性结合靶细胞,释放颗粒酶与穿孔素,而不攻击正常组织。因此,Clec9A 在机体免疫系统激活CTL 上具有一定作用,能够感应细胞坏死信号并且诱导T细胞反应,清除靶细胞[10]。
5 应用
Clec9A能够交叉提呈坏死细胞抗原,活化CTL,启动机体获得性免疫,在抗病毒感染和肿瘤治疗中具有重要作用。在丙型肝炎病毒感染中,人外周血BDCA3+Clec9A+DC 细胞能产生大量Ⅲ型干扰素,直接干扰病毒的复制[17]。同样的结果也发现在人类肝脏和扁桃体组织中的DC 上[18]。表明产生高水平的Ⅲ型干扰素是BDCA3+Clec9A+DC 的特点之一。进一步研究发现,在皮肤感染牛痘病毒的小鼠中,DNGR-1 可以促进BDCA3+DC 交叉提呈抗原,产生细胞因子IL-12、IL-15 和共刺激分子CD24,促进生成皮肤组织常驻记忆性T 细胞(Trm)[19]。此外,DN‑GR-1 同样有助于流感病毒感染后肺 Trm 的生成[19]。当皮肤和黏膜再次感染时,Trm 能够快速启动机体免疫应答。因此,Clec9A 通过结合F-actin 感知坏死细胞,启动强烈的CTL 抗病毒反应,同时在机体生成抗病毒记忆细胞中也起到重要作用[15,19]。
DC 是体内连接固有免疫和适应性免疫的专职提呈细胞,靶向抗原至DC 上的Clec9A 可以引起CTL的活化,识别肿瘤细胞表面相关肿瘤抗原,并通过细胞毒性促进肿瘤细胞的死亡[20-21]。KRISTEEN等[22]合成抗肿瘤免疫治疗剂抗Clec9A 抗体,该抗体能特异性与CD141+细胞结合,将抗原提呈至CD4+T及CD8+T 细胞,为制备Clec9A 抗体在肿瘤治疗中提供实验依据。ZENG 等[23]研究出含有抗 Clec9A 抗体和特异肿瘤抗原的纳米制剂,发现此纳米制剂能有效地将抗原提呈至靶向肿瘤浸润的DCs,促进抗原特异性CD4+和CD8+T 细胞增殖,增强抗肿瘤的CTL反应和抗体应答。最新研究发现在此纳米制剂中增加α-半乳糖神经酰胺免疫佐剂,不仅能增强CTL细胞的毒性,同时可以活化NKT 细胞,启动机体固有免疫,为肿瘤治疗提供了新思路[24]。
6 结语
机体对坏死细胞的清除障碍会导致坏死性碎片病理性的积聚,促进炎症因子的表达,加重炎症反应[5]。Clec9A 通过胞外 CTLD 区域不仅识别坏死细胞释放的F-actin,同时交叉提呈至CD8+T 细胞,激活CTL 特异性杀伤靶细胞,导致坏死细胞进一步清除[5-7,10]。在治疗肿瘤及抗病毒感染中具有重要研究前景。现阶段对Clec9A 启动的信号通路机制研究并不很明确,进一步探索Clec9A 的分子机制及其在病理反应中的作用,对基础医学和许多重大疾病的发展、诊断及治疗有重要意义。