实验性免疫性不育雄性小鼠滤泡辅助性T细胞相关细胞因子水平分析①
曹晓丹 魏任雄 张晓霞 周 俊 (浙江中医药大学附属宁波中医院男科实验室,宁波315010)
不育症日益受到社会的广泛关注,我国约有15%~20%的育龄夫妇不能生育,男性因素约占50%[1-4]。免疫性不育是在某些外因或内因的诱发下,自身免疫耐受状态被打破,持续迁延的自身免疫对自身抗原产生异常的免疫应答,导致免疫调节失衡,进而导致疾病发生。滤泡辅助性T(T follicular helper,Tfh)细胞由 IL-21 等诱导 Th0 分化产生,是真正意义上辅助B 细胞的一群新的CD4+Th 细胞亚群[5]。Tfh 细胞的产生和功能表达受多种因素调控。Bcl-6 等被认为是Tfh 细胞产生和分化的关键分子,IL-4、IL-21等细胞因子是Tfh细胞和B细胞状态和功能的关键指标。本研究通过建立免疫性不育小鼠模型,分析免疫性不育小鼠与健康对照小鼠脾脏淋巴细胞中滤泡辅助性T细胞相关细胞因子变化,探讨滤泡辅助性T细胞在免疫性不育发病过程中的意义。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级BALB/c小鼠,雄性,35只,6~8 周龄,体重16~18 g,购自上海斯莱克实验动物有限责任公司。对BALB/c 小鼠昼夜12 h 交替光照,自由食水,于室温(23±1)℃条件下饲养。
1.1.2 仪器与试剂 IL-4、IL-12、IL-17、IL-21 ELISA试剂盒(美国BioLegend公司);Trizol试剂、反转录试剂盒、RT-PCR 试剂盒(日本TaKaRa 公司);APC 标记抗小鼠CD4 单克隆抗体、PerCP/Cy5.5 标记抗小鼠CXCR5 单克隆抗体、FITC 标记抗小鼠ICOS 单克隆抗体(美国eBioscience 公司);小鼠抗精子抗体检测试剂盒(上海恒远生物科技有限公司);iMark 酶标仪(美国Bio-Rad 公司);ABI 7500 PCR 仪(美国ABI 公司);FACSCanto Ⅱ流式细胞计数仪(美国BD公司)。qPCR 特异引物由Primer5 软件设计(表1),上海桑尼生物科技有限公司合成。

表1 Bcl-6、IL-4、IL-12、IL-17、IL-21基因引物序列Tab.1 Primer sequences of Bcl-6,IL-4,IL-12,IL-17,IL-21
1.2 方法
1.2.1 免疫性不育小鼠模型的建立 每次免疫前取雄性BALB/c小鼠5只,共3次,CO2安乐死后取双侧睾丸组织,用生理盐水冲洗,置于M199 获能液中,剪碎,37℃ 静置15 min,尼龙网(孔径200µm)过滤,37℃ 培育 1.5 h,调整精子数为 2.0×106个/ml,加入完全弗氏佐剂,研磨混匀作为抗原。
取雄性BALB/c 小鼠20 只,随机分为正常组和实验组(10 只/组)。实验组双侧腹股沟颈背部脊柱两侧皮下多点注射0.5 ml 抗原作为首次免疫,10 d后于上述相同部位加强免疫。正常组注射生理盐水。分别于初免前及每次加强免疫后眼眶静脉采血,分离血清,ELISA 检测血清抗精子抗体(anti-sperm antibody,AsAb)。第 3 次加强免疫后检测小鼠血清AsAb 水平,筛选AsAb 阳性的小鼠进行后续研究。
1.2.2 小鼠脾脏淋巴细胞的分离 小鼠经CO2安乐死后,用75%的乙醇浸泡2~3 min,减少毛发造成的污染。将小鼠移入超净工作台,在无菌条件下,以仰卧位固定于解剖盘。采用眼科镊子夹起腹股沟中线处皮肤,眼科剪做一横切口。镊子捏住切口两端皮肤,向小鼠的尾部和头部纵向撕开皮肤,暴露腹腔膜壁,乙醇消毒。切开腹腔壁膜,采用镊子夹住脾脏,剪刀剪去与其相连的组织。将分离得到的脾脏组织浸泡于干净的PBS 溶液;在培养皿中加入适量PBS溶液,放置细胞筛,将脾脏取出置于细胞筛。取干净的注射器,用其按压处末端碾压组织。膜内细胞会慢慢游离出来,经过细胞筛后,悬浮于培养皿溶液。洗涤细胞筛,收集细胞筛外PBS 至50 ml 离心管,400 g 离心 15 min,去上清;加红细胞裂解液 2 ml,重悬,37℃ 静置 2 min 后,400 g 离心15 min,加入 5 ml PBS 洗涤,400 g 离心,去上清;加入5 ml PBS重悬,除去其中不可溶的组织纤维,悬浮液取10 µl细胞计数,调整细胞密度为1×106个/ml。
1.2.3 流式细胞术检测小鼠脾淋巴细胞内Tfh 细胞的比例[6]取1×106个上述方法分离获得的脾淋巴细胞,PBS 洗涤 2 次,4℃、1 000 r/min 离心 5 min。取100µl PBS 重悬细胞,分别加入APC 标记抗小鼠CD4 单克隆抗体、PerCP/Cy5.5 标记抗小鼠CXCR5单克隆抗体、FITC 标记抗小鼠ICOS 单克隆抗体各5 µl,混匀后4℃ 避光孵育30 min。4℃、1 000 r/min离心 5 min,弃上清,PBS 洗涤后重悬细胞,PBS 稀释至300~500µl,流式细胞仪检测。
1.2.4 qRT-PCR 检测免疫性不育小鼠脾淋巴细胞中 Bcl-6、IL-4、IL-12、IL-17、IL-21 水平 按照 Trizol试剂盒说明书提取脾淋巴细胞总RNA,并进行去除基因组 DNA 及反转录反应。Bcl-6、IL-4、IL-12、IL-17、IL-21 和内参基因GAPDH 的核酸序列通过基因库(Gene Bank)获得。反应体系采用SYBR Green 荧光染料法,避光操作,每个反应重复3 孔,在ABI 7500 PCR 仪上对转录因子和不同细胞因子转录水平进行检测,反应条件为:95℃ 30 s,95℃ 5 s,60℃34 s,共进行个循环。
1.2.5 ELISA 检测小鼠血清中 IL-4、IL-12、IL-17、IL-21水平 小鼠眼眶静脉采血,离心收集血清。待测样品孔中每孔分别加入待测血清100µl,所有样品均作复孔,反应板于37℃下孵育120 min。用300 µl 1×Wash Buffer 洗板 4~6 次,每个测试孔中分别加入IL-4、IL-12、IL-17、IL-21一抗工作液各50 µl,将反应板充分混匀后于37℃孵育60 min。洗板后,各测试孔加酶标抗体工作液100 µl,反应板于37℃孵育60 min。孵育结束后洗板,之后每孔加入底物液100 µl,置暗处反应5~10 min。每孔加入50 µl 终止液混匀。酶标仪检测450 nm 处每个孔的吸光值,根据标准品计算样品的浓度。
1.3 统计学分析 采用Graphpad Prism 5软件进行统计学分析。所有数据以表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫性不育小鼠模型的建立 对第3 次加强免疫后的小鼠血清进行AsAb 检测,结果显示,实验组小鼠血清吸光度值为0.45±0.04,对照组小鼠血清吸光度值为0.18±0.01。实验组10 只小鼠AsAb吸光度/正常对照组≥2.1,即为AsAb(+)。
2.2 小鼠脾脏淋巴细胞中CD4+CXCR5+ICOS+T 细胞表达水平 将分离的脾脏淋巴细胞进行多色免疫荧光标记,以CD4+CXCR5+ICOS+作为Tfh 的标志进行分析。免疫性不育小鼠脾脏淋巴细胞中CD4+CXCR5+ICOS+T 细胞比例明显高于正常对照组(P<0.001,图1)。
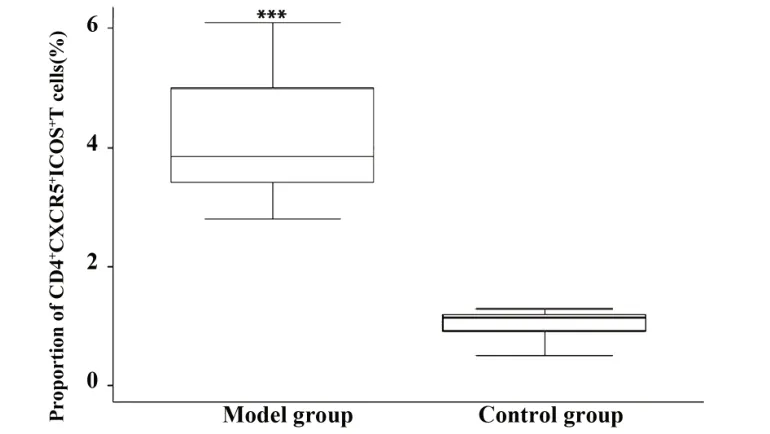
图1 小鼠脾脏淋巴细胞中CD4+CXCR5+ICOS+T 细胞的比例分析Fig.1 Analysis of proportion of CD4+CXCR5+ICOS+T cells in spleen lymphocytes of mice
2.3 小鼠脾脏淋巴细胞中 Bcl-6、IL-4、IL-12、IL-17、IL-21 mRNA 相对表达量 与对照组相比,免疫性不育小鼠脾脏淋巴细胞Bcl-6、IL-4、IL-12、IL-21 mRNA 含量升高,差异有统计学意义(P<0.05),IL-17 mRNA 含量变化无统计学差异(P>0.05)。见图2。
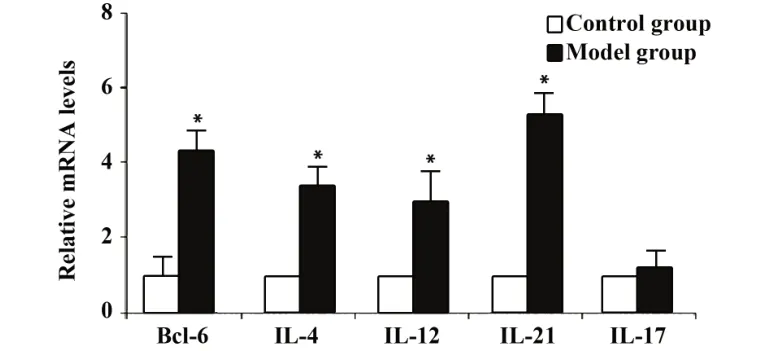
图2 小鼠脾脏淋巴细胞中Bcl-6、IL-4、IL-12、IL-17、IL-21 mRNA相对表达量Fig.2 mRNA relative expression levels of Bcl-6,IL-4,IL-12,IL-17,IL-21 in spleen lymphocytes of mice
2.4 小鼠血清中IL-4、IL-12、IL-17、IL-21 水平 与对照组相比,免疫性不育小鼠血清中IL-4、IL-12、IL-21 的含量升高(P<0.05),IL-17 含量变化差异无统计学意义(P>0.05,图3)。
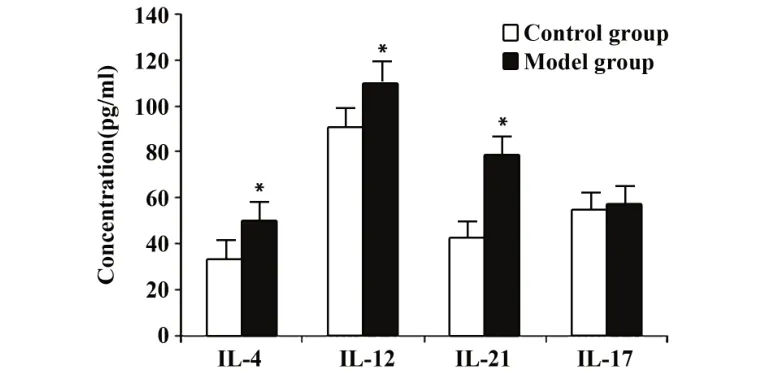
图3 小鼠血清中IL-4、IL-12、IL-17、IL-21水平Fig.3 Serum levels of IL-4,IL-12,IL-17,IL-21 in mice
3 讨论
前期研究认为Th1/Th2 细胞亚群的失衡和免疫性不育的发生有关[7]。在免疫系统中,初始CD4+T 淋巴细胞(Th0)在局部微环境中受不同细胞因子调控向不同方向分化,其分化方向决定免疫应答的类型。IL-21 和 IFN-γ 等可诱导 Th0 向 Th1 分化,主要介导细胞免疫应答。IL-4 等可诱导Th0 向Th2 分化,主要介导体液免疫应答。TGF-β 和IL-2可诱导Th0 向Treg 分化,主要发挥免疫抑制和免疫调节作用。TGF-β 和 IL-6(小鼠)或 IL-1β 和 IL-6(人)等可诱导Th0 向Th17 分化,主要通过分泌IL-17 刺激多种细胞参与机体的免疫防御,在固有免疫中发挥重要作用。由于Th2细胞分泌的IL-4等细胞因子能够诱导B 细胞活化、增殖及抗体产生,因此Th2 细胞一直被认为是辅助B 细胞的主要辅助性T细胞,但实验发现IL-4 基因敲除小鼠并不影响抗体的产生[8]。Tfh 细胞由 IL-21 等诱导 Th0 分化产生,是真正意义上辅助B 细胞的一群新的CD4+Th 细胞亚群。Tfh 细胞辅助B 细胞在生发中心存活、增殖,促进B细胞向浆细胞分化、抗体类别转换,在自身免疫性疾病中扮演重要角色[9]。
Tfh 细胞的产生和功能表达受多种因素调控。转录因子B 细胞淋巴瘤6(B cell lymphoma 6,Bcl-6)是Tfh 细胞特异性的转录因子,是区别于Th1、Th2、Th17 等辅助性T细胞的特征之一,在Tfh 的分化、特异性表面分子的表达及T细胞依赖的生发中心免疫应答中起关键作用[10]。研究显示,Bcl-6 缺陷的小鼠体内不能形成生发中心,Tfh 细胞发育障碍,且不能对胸腺依赖的抗原产生免疫应答[11]。本研究采用RT-PCR 方法检测免疫性不育小鼠脾脏淋巴细胞中Bcl-6 的mRNA 水平,结果显示,在免疫性不育小鼠中,Bcl-6 的表达显著高于健康对照小鼠。流式检测结果显示,免疫性不育小鼠脾脏淋巴细胞中CD4+CXCR5+ICOS+Tfh 细胞比例明显高于正常对照组。实验结果提示免疫性不育小鼠脾脏淋巴细胞中Bcl-6 的升高可诱导初始T 细胞向Tfh 分化,从而增加免疫性不育小鼠中Tfh 的数量。
免疫微环境中的相关细胞因子,如IL-12、IL-21等可促进初始 CD4+T 细胞分化为 Tfh 细胞[12-13]。IL-21 是Tfh 细胞的重要功能性细胞因子,具有强大的辅助诱导功能,IL-21 可通过与B 细胞表面受体结合促进B 细胞高频突变、Ig 类别转化及浆细胞形成[14-15]。IL-21受体(IL-21 receptor,IL-21R)表达在B细胞、T 细胞和NK 细胞表面,其中B 细胞是其作用的最主要的靶细胞。通过自分泌的方式,IL-21 能促进Tfh 自身的分化,同时影响Tfh 细胞转录因子Bcl-6的表达[16]。高表达IL-21 的小鼠浆细胞数目显著上升,而在IL-21 缺失或IL-21R 缺陷的小鼠中,T细胞依赖型抗体的分泌发生障碍,提示IL-21 为B细胞分化及类别转换的重要细胞因子,在B 细胞对T 细胞依赖抗原的免疫应答及体液免疫的长期维持中发挥重要作用[17]。在本研究中,免疫性不育小鼠脾脏淋巴细胞中IL-4、IL-12、IL-21 mRNA 的表达显著升高,两组间IL-17 的表达差异无统计学意义。ELISA 法检测血清中 IL-4、IL-12、IL-21、IL-17 的水平,得到了同样的结果。推测在免疫性不育的发生过程中,大量炎症细胞及免疫细胞被活化,产生大量 IL-4、IL-12 及 IL-21,导致免疫微环境紊乱,使CD4+Th 细胞向Tfh 细胞分化、增殖。本研究阐明了Tfh 细胞相关细胞因子在免疫性不育小鼠发病中的表达特征及意义,为后续Tfh 细胞在辅助免疫性不育机体B细胞分泌自身抗体过程中具体作用及机制的研究奠定基础。

