基于PI3K/Akt/GSK-3β通路探究葛根素减轻癫痫小鼠症状的机制
管 萍 刘文娟 卢鹏超 徐萌萌(湖北省天门巿第一人民医院神经内科,天门431700)
癫痫(epilepsy,EP)是一种临床常见的慢性神经系统疾病,具有进行性和反复性等特点,由大脑神经细胞过度异常放电引起,持续发作可引发脑内氧化应激及炎症,损伤脑组织,造成大脑认知功能障碍,并增加患者患精神疾病的风险,脑卒中、脑外部损伤、神经系统过度放电等均可引发癫痫,胶质细胞活化导致的脑内炎症反应是造成EP患者脑损伤,并进一步促使其发作的主要原因[1-2]。PI3K/Akt/GSK-3β是体内主要的存活信号通路,可调控氧化应激及炎症反应,激活该通路,可抑制炎症发生发展,减轻脑缺血再灌注损伤,并通过促使核因子E2相关因子活化,降低γ射线引起的神经毒性,由此推测,PI3K/Akt/GSK-3β信号可调控炎症发生及进展,可能是影响EP发作的潜在作用靶点[3-4]。葛根素是我国传统的药食两用植物葛根的主要药效成分之一,具有心脑血管保护、抗氧化、抗炎、降糖、保肝等药理活性,可激活PI3K/Akt/GSK-3β信号,抑制铅诱导的氧化应激,发挥脑保护作用,还可通过抗氧化应激减轻乙醇导致的慢性脑损伤,并通过抑制过度自噬而改善缺血性中风所致的脑损伤,因而推测葛根素可能通过激活PI3K/Akt/GSK-3β通路减轻癫痫发作[5-7]。本文通过建立EP模型小鼠,基于PI3K/Akt/GSK-3β通路对葛根素减轻癫痫小鼠症状的作用机制进行探究。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级BALB/c小鼠,雌雄各半,体重18~22 g,许可证号:SCXK(沪)-2009-0001,购自苏州大学比较医学中心,所有小鼠均在本院动物房中饲养,动物房环境达到清洁级,并保持安静、通风良好,自由饮食、饮水,自然光照,温度23℃,相对湿度45%,定时清洗、消毒鼠笼,随时添加饲料、饮用水,适应性饲养1周。
1.1.2 主要试剂及仪器 葛根素注射液(商品规格:2 ml∶0.1 g,国药准字:H20053731,湖北天圣康迪制药有限公司);LY294002(货号HY-10108,美国MCE公司);SOD检测试剂盒(货号S311,同仁化学研究所);MDA检测试剂盒[货号JK-(a)-2197,上海晶抗生物工程有限公司];小鼠IL-6及TNF-α ELISA试剂盒、小鼠ELISA试剂盒、兔源GAPDH、PI3K、p-PI3K、AKT、p-AKT、GSK-3β及p-GSK-3β一抗、羊抗兔 二 抗(货 号ab100772、ab100785、ab181602、ab151549、ab138364、ab179463、ab38449、ab75745、ab75745、ab150077,美国Abcam公司);RIPA裂解液、BCA试剂盒、HE染色试剂盒(货号P0013K、P0011、C0105,上海碧云天公司)等;Morris水迷宫(型号XR-XM101,上海欣软信息科技有限公司);酶标仪(型号XElx800,美国Perkin Elmer公司);切片机(型号CM3050S,德国Leica公司);光学显微镜(型号SMZ745,日本尼康公司);通用电泳仪(型号JY200C,上海楚柏实验室设备有限公司);蛋白转移电泳槽(型号Tanon-186,北京中慧天诚科技有限公司);凝胶成像仪(型号GIS-500,Miulab公司)等。
1.2 方法
1.2.1 动物模型制备及分组给药 以35 mg/kg的剂量[8]腹腔注射戊四氮制备EP小鼠模型,隔天注射1次,共注射15次,然后观察小鼠行为活动30 min判断癫痫发作级别,参照Racine分级标准:面部出现阵挛为Ⅰ级;颈部肌肉出现痉挛并甩尾/节律性点头为Ⅱ级;单侧前肢出现抽搐为Ⅲ级;双前肢出现抽搐为Ⅳ级;四肢出现抽搐,失去平衡,跳跃及跌倒等为Ⅴ级,如小鼠癫痫发作持续为Ⅳ级以上,表明模型制备成功,共建模53只,成功48只,随机分为模型组、LY294002组、葛根素组、葛根素+LY294002组4组,每组12只,另取12只小鼠腹腔注射等剂量生理盐水设为对照组。葛根素组、葛根素+LY294002组小鼠腹腔注射320 mg/kg[9]剂量的葛根素注射液,LY294002组、葛根素+LY294002组小鼠尾静脉注射0.3 mg/kg[10]剂量的LY294002,对照组与模型组小鼠,以与LY294002组相同剂量的生理盐水尾静脉注射,同时腹腔注射与葛根素组等剂量的生理盐水,每天1次,持续14 d。
1.2.2 小鼠癫痫发作检测 给药结束后24 h,观察小鼠行为活动,记录1 d之中小鼠癫痫发作次数、持续时间。
1.2.3 小鼠认知功能检测及标本收集 以Morris水迷宫实验检测小鼠认知功能,参照文献[11]及说明书中的步骤进行操作,使用平均逃避潜伏期及穿越原平台位置次数作为小鼠认知功能的判断标准。各组小鼠吸入乙醚麻醉后,眼眶取血1.5 ml,静置15 min后,4℃离心20 min,收集上清液即获得血清,储存在-80℃冰箱中;断头处死后解剖,获得大脑,剪碎后加入蛋白裂解液,匀浆制备为匀浆液,4℃离心20 min,收集上清液(蛋白样品液),储存在-80℃冰箱中。
1.2.4 小鼠脑组织SOD、MDA及血清IL-6、TNF-α水平检测 将1.2.3中的血清、蛋白样品液置于4℃冰箱中解冻,参照小鼠ELISA试剂盒说明书检测血清中IL-6、TNF-α水平,取适量蛋白样品液,参照SOD及MDA试剂盒说明书步骤检测其中SOD、MDA水平,剩余进行Western blot。
1.2.5 Western blot检测小鼠脑组织PI3K/Akt/GSK-3β通路相关蛋白表达 将1.2.4中剩余的蛋白样品液,采用BCA试剂盒(具体步骤参照说明书)测定其中蛋白总浓度,然后将各组蛋白浓度调至相同,取相同体积的各组蛋白样品液上样进行电泳,分离蛋白后湿转,转移全部蛋白至PVDF膜上,置于5%脱脂奶粉中,于摇床上室温封闭2 h,根据蛋白分子量截取目的蛋白条带置于小盒中,各种蛋白做好标 记,加 入 兔 源GAPDH、PI3K、p-PI3K、AKT、p-AKT、GSK-3β及p-GSK-3β一抗,于4℃冰箱中孵育过夜,TBST溶液漂洗后,以羊抗兔二抗室温孵育2 h,TBST溶液再次漂洗后,蛋白条带以ECL显色,然后以凝胶成像系统进行拍照,采用Quantity One软件对图像进行分析,得到各组蛋白相对表达量。
1.3 统计学分析 采用SPSS24.0软件对数据进行统计分析,以±s表示计量资料,多组间比较采用单因素方差分析,进一步两两比较行LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组小鼠癫痫发作情况 与对照组相比,模型组小鼠癫痫发作次数增加,持续时间明显延长(P<0.05)。与模型组相比,葛根素组小鼠癫痫发作次数减少,持续时间缩短(P<0.05);LY294002组小鼠癫痫发作次数增加,持续时间延长(P<0.05)。与LY29-4002组相比,葛根素+LY294002组小鼠癫痫发作次数减少,持续时间缩短(P<0.05)。与葛根素组相比,葛根素+LY294002组小鼠癫痫发作次数增加,持续时间延长(P<0.05),见表1。
表1 各组小鼠癫痫发作情况(±s,n=12)Tab.1 Seizures of mice in each group(±s,n=12)

表1 各组小鼠癫痫发作情况(±s,n=12)Tab.1 Seizures of mice in each group(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with Puerarin group,3)P<0.05;compared with LY294002 group,4)P<0.05.
Groups Control group Model group Puerarin group LY294002 group Puerarin+LY294002 group Number of attacks 0.00±0.00 15.24±3.421)2.47±0.322)22.45±2.641)2)3)16.47±3.571)3)4)Duration(s)0.00±0.00 45.03±9.071)2.06±0.282)64.89±10.581)2)3)46.67±9.161)3)4)
2.2 各组小鼠认知功能 与对照组相比,模型组小鼠平均逃避潜伏期明显延长(P<0.05),穿越原平台位置次数明显减少(P<0.05)。与模型组相比,葛根素组小鼠平均逃避潜伏期缩短(P<0.05),穿越原平台位置次数增加(P<0.05);LY294002组小鼠平均逃避潜伏期延长(P<0.05),穿越原平台位置次数减少(P<0.05)。与LY294002组相比,葛根素+LY294002组小鼠平均逃避潜伏期缩短(P<0.05),穿越原平台位置次数增加(P<0.05)。与葛根素组相比,葛根素+LY294002组小鼠平均逃避潜伏期延长(P<0.05),穿越原平台位置次数减少(P<0.05),见表2。
表2 各组小鼠认知功能(±s,n=12)Tab.2 Cognitive function of mice in each group(±s,n=12)
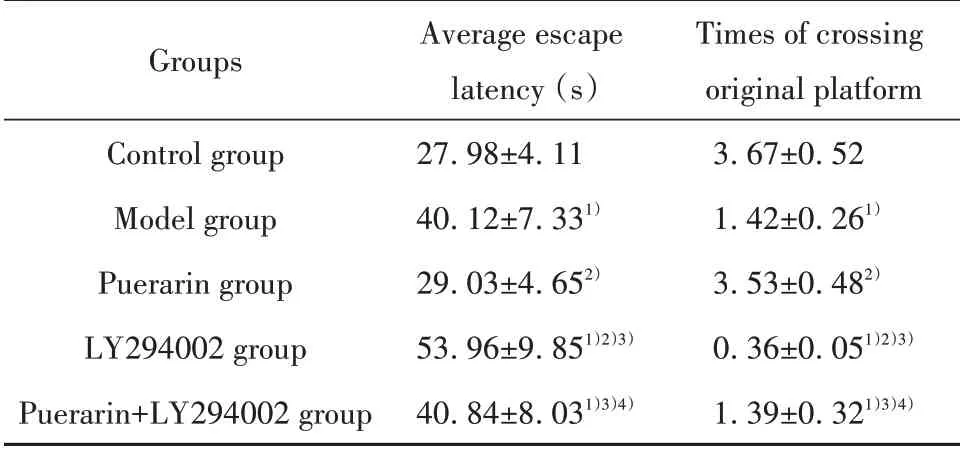
表2 各组小鼠认知功能(±s,n=12)Tab.2 Cognitive function of mice in each group(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with Puerarin group,3)P<0.05;compared with LY294002 group,4)P<0.05.
Groups Control group Model group Puerarin group LY294002 group Puerarin+LY294002 group Average escape latency(s)27.98±4.11 40.12±7.331)29.03±4.652)53.96±9.851)2)3)40.84±8.031)3)4)Times of crossing original platform 3.67±0.52 1.42±0.261)3.53±0.482)0.36±0.051)2)3)1.39±0.321)3)4)
2.3 各组小鼠脑组织MDA、SOD水平 与对照组相比,模型组小鼠脑组织MDA水平明显升高(P<0.05),SOD水平明显降低(P<0.05)。与模型组相比,葛根素组小鼠脑组织MDA水平降低(P<0.05),SOD水平升高(P<0.05),LY294002组小鼠脑组织MDA水平升高(P<0.05),SOD水平降低(P<0.05)。与LY294002组相比,葛根素+LY294002组小鼠脑组织MDA水平降低(P<0.05),SOD水平升高(P<0.05)。与葛根素组相比,葛根素+LY294002组小鼠脑组织MDA水平升高(P<0.05),SOD水平降低(P<0.05),见表3。
表3 各组小鼠脑组织MDA、SOD水平(±s,n=12)Tab.3 Levels of MDA and SOD in brain tissue of mice in each group(±s,n=12)
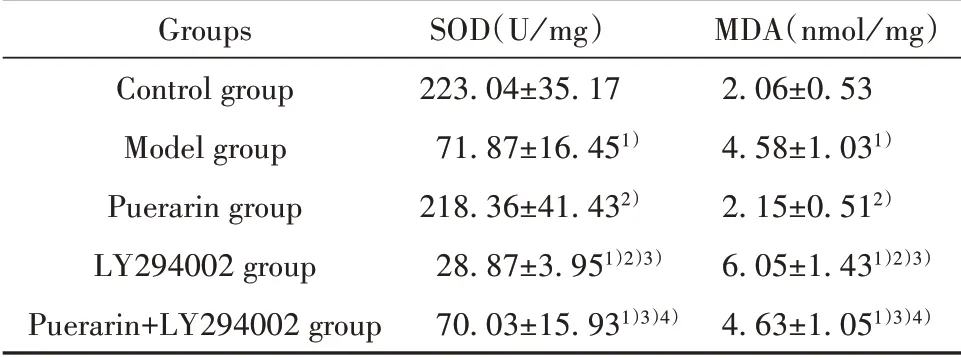
表3 各组小鼠脑组织MDA、SOD水平(±s,n=12)Tab.3 Levels of MDA and SOD in brain tissue of mice in each group(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with Puerarin group,3)P<0.05;compared with LY294002 group,4)P<0.05.
Groups Control group Model group Puerarin group LY294002 group Puerarin+LY294002 group SOD(U/mg)223.04±35.17 71.87±16.451)218.36±41.432)28.87±3.951)2)3)70.03±15.931)3)4)MDA(nmol/mg)2.06±0.53 4.58±1.031)2.15±0.512)6.05±1.431)2)3)4.63±1.051)3)4)
2.4 各组小鼠血清IL-6、TNF-α水平比较 与对照组相比,模型组小鼠血清IL-6、TNF-α水平明显升高(P<0.05)。与模型组相比,葛根素组小鼠血清IL-6、TNF-α水平降低(P<0.05),LY294002组小鼠血清中IL-6、TNF-α水平升高(P<0.05)。与LY294002组相比,葛根素+LY294002组小鼠血清IL-6、TNF-α水平降低(P<0.05)。与葛根素组相比,葛根素+LY294002组小鼠血清IL-6、TNF-α水平升高(P<0.05),见表4。
表4 各组小鼠血清IL-6、TNF-α水平(±s,n=12)Tab.4 Serum levels of IL-6 and TNF-α in each group(±s,n=12)
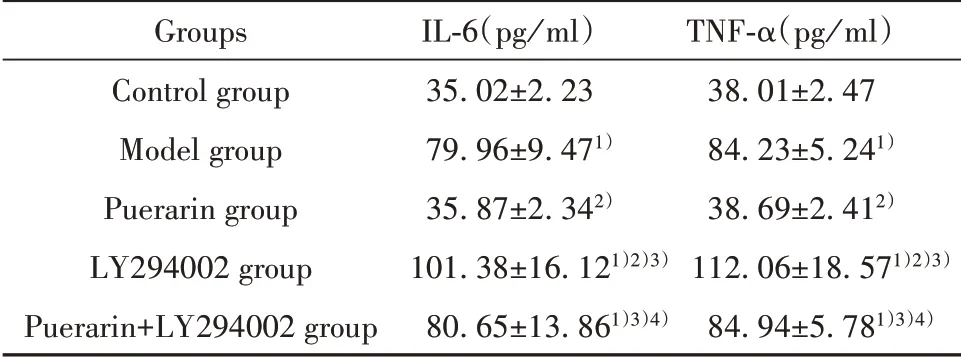
表4 各组小鼠血清IL-6、TNF-α水平(±s,n=12)Tab.4 Serum levels of IL-6 and TNF-α in each group(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with Puerarin group,3)P<0.05;compared with LY294002 group,4)P<0.05.
Groups Control group Model group Puerarin group LY294002 group Puerarin+LY294002 group IL-6(pg/ml)35.02±2.23 79.96±9.471)35.87±2.342)101.38±16.121)2)3)80.65±13.861)3)4)TNF-α(pg/ml)38.01±2.47 84.23±5.241)38.69±2.412)112.06±18.571)2)3)84.94±5.781)3)4)
2.5 各组小鼠脑组织PI3K/Akt/GSK-3β通路相关蛋白表达 与对照组相比,模型组小鼠脑组织中p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β明 显 降低(P<0.05)。与模型组相比,葛根素组小鼠脑组织中p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β升高(P<0.05);LY294002组小鼠脑组织中p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β降低(P<0.05)。与LY294002组相比,葛根素+LY294002组小鼠脑组织 中p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β升高(P<0.05)。与葛根素组相比,葛根素+LY294002组小鼠脑组织中p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β降低(P<0.05),见图1、表5。
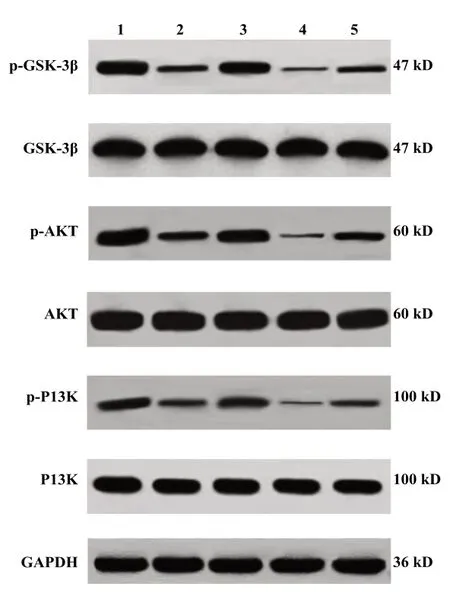
图1 各组小鼠脑组织中PI3K/Akt/GSK-3β通路蛋白免疫印迹检测结果Fig.1 Western blot results of PI3K/Akt/GSK-3β pathway protein in brain tissue of mice in each group
表5 各组小鼠脑组织中PI3K/Akt/GSK-3β通路相关蛋白相对表达(±s,n=12)Tab.5 Relative expression of PI3K/Akt/GSK-3β pathway related proteins in brain tissues of mice in each group(±s,n=12)
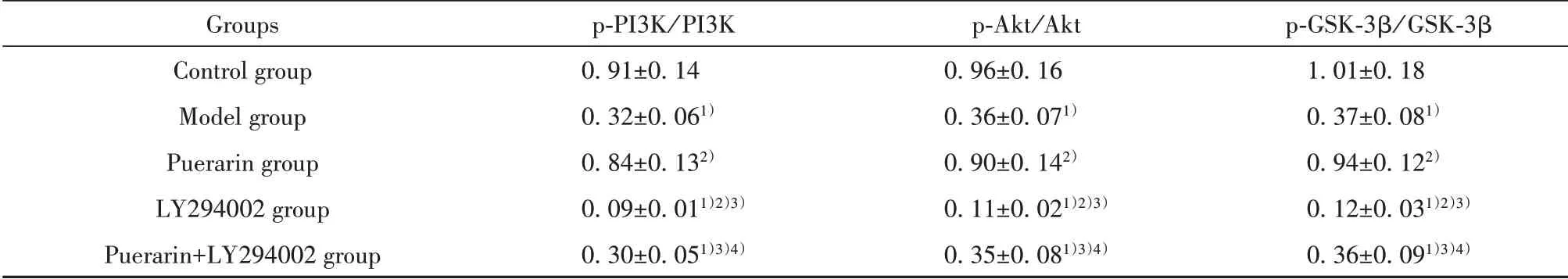
表5 各组小鼠脑组织中PI3K/Akt/GSK-3β通路相关蛋白相对表达(±s,n=12)Tab.5 Relative expression of PI3K/Akt/GSK-3β pathway related proteins in brain tissues of mice in each group(±s,n=12)
Note:Compared with the control group,1)P<0.05;compared with model group,2)P<0.05;compared with Puerarin group,3)P<0.05;compared with LY294002 group,4)P<0.05.
Groups Control group Model group Puerarin group LY294002 group Puerarin+LY294002 group p-PI3K/PI3K 0.91±0.14 0.32±0.061)0.84±0.132)0.09±0.011)2)3)0.30±0.051)3)4)p-Akt/Akt 0.96±0.16 0.36±0.071)0.90±0.142)0.11±0.021)2)3)0.35±0.081)3)4)p-GSK-3β/GSK-3β 1.01±0.18 0.37±0.081)0.94±0.122)0.12±0.031)2)3)0.36±0.091)3)4)
3 讨论
戊四氮作为一种GABAA受体拮抗剂,可使中枢神经系统兴奋,并过度放电,在短时间内造成动物抽搐,出现癫痫症状,而脑神经过度的放电及癫痫持续发作,可引发呼吸障碍、脑组织缺血缺氧,激活胶质细胞,上调炎症因子TNF-α、IL-6等异常表达,促使脑部氧化应激及炎症反应发生并进展,导致脑神经细胞凋亡,损坏认知功能[11-14]。本文通过腹腔注射戊四氮制备EP小鼠模型,结果显示,建模小鼠癫痫发作次数增加,发作持续时间及平均逃避潜伏期延长、脑组织MDA水平、血清IL-6及TNF-α水平明显升高,穿越原平台位置次数减少,SOD水平明显降低,表明戊四氮可引发氧化应激及炎症发生,造成小鼠脑组织过度氧化,损坏认知功能,导致小鼠癫痫发作,揭示模型建立成功。
EP的临床治疗以苯二氮卓类药物为主,可迅速减少癫痫发作,但EP患者大多需长期用药,临床常用的抗癫痫药物存在易形成耐受性、长期疗效差、毒副作用大等缺点,因此积极寻找更为安全有效的治疗药物至关重要[15]。葛根素提取自中药葛根,可抗氧化、抗炎、抑制神经细胞凋亡,进而改善创伤性脑损伤小鼠神经功能缺损,发挥脑保护作用[16-17]。本研究结果显示,EP模型小鼠经葛根素处理后,其癫痫发作次数减少,发作持续时间及平均逃避潜伏期缩短,脑组织MDA水平、血清IL-6及TNF-α水平降低,穿越原平台位置次数增加,SOD水平升高,表明葛根素可能通过抑制炎症反应,降低氧化应激水平,减轻小鼠癫痫发作,改善其认知功能。
PI3K/Akt/GSK-3β信号可调控机体免疫炎症、氧化应激、细胞存活、凋亡等生理病理过程,增强该信号中相关蛋白磷酸化水平,可激活该通路,进而抑制炎症,下调凋亡蛋白表达,减轻糖尿病肾病大鼠肾损伤[18]。研究发现,激活PI3K/Akt/GSK-3β通路可提高小鼠学习记忆能力,预防淀粉样β诱导的记忆障碍[19]。另外,在HepG2细胞胰岛素抵抗的研究中发现,葛根素可增强PI3K/Akt/GSK-3β信号转导,由此推测,葛根素减轻EP症状的药理机制可能与激活PI3K/Akt/GSK-3β通路有关[20]。本文结果显示,EP小鼠脑组织中PI3K/Akt/GSK-3β通路相关蛋白p-PI3K/PI3K、p-Akt/Akt及p-GSK-3β/GSK-3β明显降低,以PI3K抑制剂LY294002处理后,小鼠癫痫发作次数增加,发作持续时间及平均逃避潜伏期延长,穿越原平台位置次数减少,表明PI3K/Akt/GSK-3β信号参与介导癫痫发作过程,抑制该通路可减轻癫痫症状。进一步研究发现,经葛根素和LY294002联合处理后,EP小鼠癫痫发作次数减少,发作持续时间及平均逃避潜伏期缩短,脑组织MDA水平、血清IL-6及TNF-α水平比LY294002组小鼠降低,但高于葛根素组,穿越原平台位置次数增加、SOD水平比LY294002组小鼠升高,但低于葛根素组,表明可减弱葛根素阻止炎症发生、降低氧化应激水平、修复认知功能、减轻癫痫症状的作用可被LY294002逆转,进一步提示葛根素可能通过激活PI3K/Akt/GSK-3β通路,抑制EP小鼠氧化应激和炎症反应,减轻EP小鼠临床症状。
综上所述,葛根素可减轻EP小鼠脑部炎症及氧化应激损伤,改善其认知功能,进而减轻EP小鼠临床症状,为EP的临床治疗提供了新思路,激活PI3K/Akt/GSK-3β通路是其药理机制之一。但本文只在整体层面进行了初步探讨,关于PI3K/Akt/GSK-3β信号下游调控神经元凋亡的分子机制并未涉及,还存在一定不足,其更清楚完整的药理机制还需后续深入研究。