NLRP3炎症小体在甲型流感病毒肺炎小鼠肺组织的表达水平及其介导的炎症反应①
石云锋 师小函 梁晶晶 陈健宁 江振友 吴本权(中山大学附属第三医院,广州510630)
甲型流感病毒(甲流病毒)引起流行性感冒为主的呼吸系统急性感染性疾病,但病毒性肺炎在甲型流感大流行时发病率明显增高,并且在病程1周时易进展为重症病毒性肺炎或继发细菌性肺炎,病死率高[1-2]。甲流病毒感染激活肺泡巨噬细胞等免疫细胞中的NOD样受体蛋白3(NOD like receptor protein 3,NLRP3)炎症小体,后者引起IL-1β、IL-18的释放并介导炎症反应,该免疫反应是机体抗甲流病毒感染的主要机制[3]。在甲流病毒肺炎早期,NLRP3炎症小体的激活及介导的炎症反应有助于病毒的清除[4]。但在甲流病毒肺炎病程1周时,即进展至重症肺炎的高风险时期,NLRP3炎症小体具体活性如何,国内外未见深入研究。本研究以甲流病毒鼠肺适应株H1N1/FM1滴鼻感染C57BL/6小鼠建立肺炎模型,探索NLRP3、caspase-1、IL-1β的表达水平以及相应的炎症反应。
1 材料与方法
1.1 材料
1.1.1 实验病毒及动物 甲流病毒H1N1/FM1株为鼠肺适应株,前期研究证实其引起小鼠病毒性肺炎的致病力[5]。C57BL/6小鼠15只,雄性,鼠龄30~35 d,购于广东省实验动物中心,许可证号:SCXK(粤)2013-0002。动物实验过程遵循《赫尔辛基宣言》相关原则及动物伦理要求。
1.1.2 主要试剂MLV第一链合成试剂盒、SYBR®select master mix购于美国Life Technologies公司;RT qPCR引物由美国Life Technologies公司设计并合成;NLRP3单克隆兔抗体购于美国Cell Signaling Technology公司;caspase-1单克隆兔抗体购于美国Novus Biologicals公司;GAPDH兔抗体、辣根过氧化物酶标记的羊抗兔二抗、全蛋白提取试剂盒及BCA法蛋白浓度检测试剂盒购于广州杰特伟科技有限公司;ELISA试剂盒购于美国R&D公司。
1.2 方法
1.2.1 甲流病毒H1N1复苏、毒力测定 复苏液氮罐中冻存的甲流病毒H1N1/FM1株,于9日龄鸡胚尿囊腔连续传代2次扩增后,以鸡红细胞血凝试验测定扩增的病毒效价。用无血清DMEM培养液对H1N1/FM1病毒株行连续2倍递次稀释至1∶1 280。确定病毒效价为1∶640及半数致死量(LD50)为2-2.83/50 μl。
1.2.2 甲流病毒H1N1滴鼻建立小鼠肺炎模型及分组 小鼠饲养1周后开始实验,随机分成空白对照组、24 h组和1周组,每组5只。腹腔注射10%水合氯醛80 μl麻醉小鼠后,空白对照组每只小鼠以50 μl PBS液滴鼻,24 h组及1周组每只小鼠以50 μl LD50浓度的甲流病毒H1N1滴鼻建立甲流病毒肺炎模型。24 h组感染24 h,1周组感染168 h(1周)。观察并记录小鼠的生存状况、一般情况、体重等。体重变化率(%)=(实验点体重-初始体重)/初始体重×100%。
1.2.3 标本取材 在各实验点,眼眶取血后颈椎脱臼法处死小鼠。分离血清,用于IL-1β浓度ELISA检测。摘取小鼠肺脏,左肺上叶和下叶分别留作提取蛋白和RNA,右肺留作病理切片和HE染色。
1.2.4 RT-qPCR检测肺组织NLRP3、caspase-1和IL-1β的mRNA转录水平 将各组小鼠肺组织称重后研磨制成悬液。用Trizol法提取组织总RNA,检测RNA的浓度。应用ABI7500系统行PCR检测。反应条件为:50℃2 min、95℃2 min预变性,95℃15 s变性,60℃1 min退火,95℃15 s、60℃1 min、95℃30 s、60℃15 s延伸,共进行40个循环。记录目的基因与内参基因的Ct值,用2-ΔΔCt计算目的基因mRNA的相对表达量。RT-qPCR反应引物见表1。

表1 NLRP3、caspase-1和IL-1β的引物序列Tab.1 Primer sequences of NLRP3,caspase-1 and IL-1β
1.2.5 Western blot检测肺组织NLRP3、caspase-1的蛋白表达水平 裂解小鼠肺组织后,提取总蛋白。按凯基BCA蛋白含量检测试剂盒说明书,测定蛋白浓度。按Western blot步骤,转膜,封闭,给予相应的一抗、二抗孵育,在Chemi Scope化学发光成像系统显影,用Image J软件分析目的蛋白及内参蛋白的灰度值,计算各目的蛋白的相对表达量。
1.2.6 ELISA检测血清IL-1β的浓度 根据ELISA检测试剂盒的操作流程,设复孔数为3,取测量数据的平均值,依据标准曲线计算各组小鼠血清IL-1β的浓度。
1.3 统计学处理 采用SPSS Statistics 20.0软件进行统计分析。数据均符合正态分布,以±s表示,多组间比较选用单因素方差分析,两组间比较满足方差齐性的选择LSD-t检验,两组间比较方差不齐的选择Dunnett T3检验。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠生存状况及一般情况 各组小鼠均全部存活。空白对照组小鼠进食、活动如常,24 h后及1周后平均体重分别增加3.98%和10.54%。24 h组及1周组小鼠均出现精神萎靡、竖毛、毛色无光泽、摄食量下降、活动减少等情况。24 h组平均体重减轻6.78%,1周组在24 h后及1周后平均体重分别减轻4.31%与19.28%。
2.2 小鼠肺组织病理及肺炎模型的建立 空白对照组小鼠肺组织病理切片示正常肺组织,支气管壁完整,肺泡内及组织间隙无明显肿胀,无明显炎症细胞浸润。24 h组小鼠肺组织见局灶性支气管炎和弥散性间质肺炎,见较多的炎症细胞浸润,血管扩张充血,肺泡结构破坏。1周组小鼠肺组织病理可见炎症反应较24 h组加重,炎症细胞浸润及充血更加明显,并可见局灶性实变(图1)。
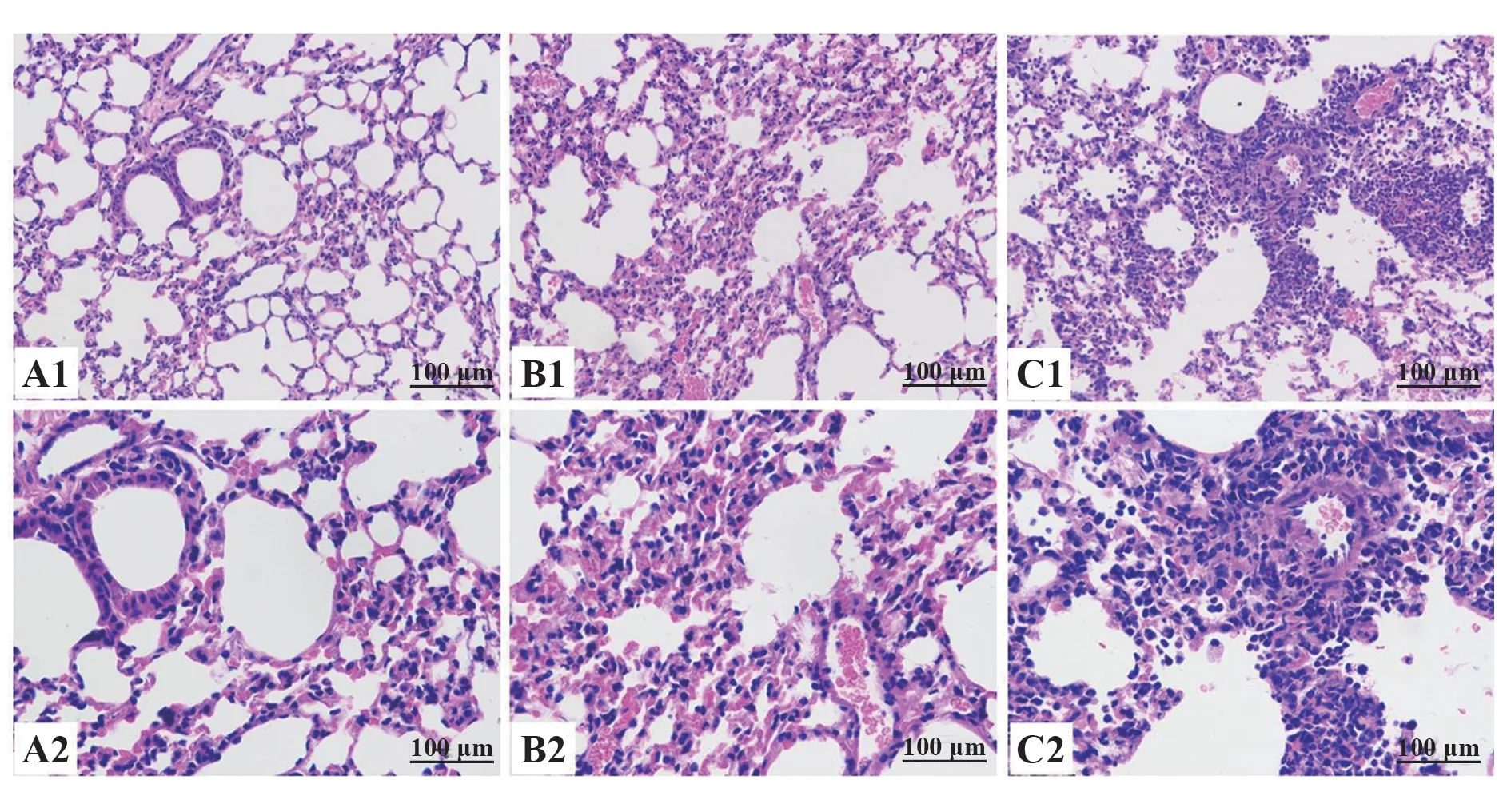
图1 甲流病毒H1N1感染致小鼠肺炎组织病理改变Fig.1 Pathology of pneumonia caused by IAV H1N1 infection in mice
2.3 小鼠肺组织NLRP3、caspase-1的mRNA及蛋白相对表达量RT-qPCR检测发现甲流病毒肺炎小鼠肺组织NLRP3的mRNA表达明显升高,24 h组、1周组均较空白对照组升高,1周组比24 h组升高,组间比较差异均有统计学意义(F=221.051,P<0.05,图2)。caspase-1的mRNA表达水平也升高,1周组比空白对照组、24 h组升高,差异有统计学意义(F=116.656,P<0.01,图2)。Western blot检测发现甲流病毒肺炎小鼠肺组织NLRP3的蛋白表达水平明显升高,24 h组、1周组均较空白对照组升高,1周组比24 h组升高,组间比较差异均有统计学意义(F=1 194.353,P<0.01,图3),此变化趋势与mRNA表达水平的结果相一致。caspase-1的蛋白表达水平明显升高,24 h组、1周组均较空白对照组升高,1周组比24 h组升高,组间比较差异均有统计学意义(F=173.997,P<0.05,图3)。
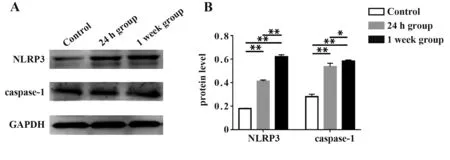
图3 Western blot检测甲流病毒肺炎小鼠肺组织NLRP3与caspase-1的蛋白相对表达量Fig.3 Protein levels of NLRP3 and caspase-1 in IAV pneumonia in mice measured by Western blot
2.4 小鼠肺组织IL-1β的mRNA相对表达量及血清IL-1β浓度RT-qPCR检测发现甲流病毒肺炎小鼠肺组织IL-1β的mRNA表达升高,24 h组、1周组均较空白对照组升高,1周组比24 h组升高,组间比较差异均有统计学意义(F=439.687,P<0.01,图4A)。ELISA检测发现甲流病毒肺炎小鼠血清IL-1β浓 度 升 高,24 h组(189.486±2.268)、1周 组(219.010±2.577)均 较 空 白 对 照 组(152.190±6.908)升高,1周组比24 h组升高,组间比较差异均有统计学意义(F=169.575,P<0.01,图4B)。
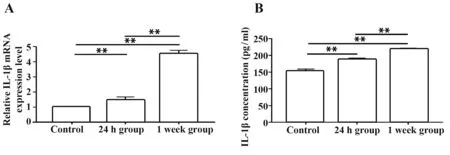
图4 甲流病毒肺炎小鼠肺组织IL-1β的mRNA相对表达量和血清IL-1β浓度Fig.4 Relative mRNA expression level and serum concentrations of IL-1β in IAV pneumonia in mice
3 讨论
甲流病毒感染呼吸系统引起流行性感冒、支气管炎、肺炎等疾病。甲流病毒通过感染并破坏呼吸道上皮细胞,直接引起肺损害。此外,甲流病毒的RNA、M2蛋白等结构成分激活肺泡巨噬细胞、树突状细胞等免疫细胞,引起炎症反应间接加剧肺损伤[1]。甲流病毒感染的预后取决于病毒负荷量、炎症反应强度以及有无继发感染[6]。流行性感冒有自限性的特点,感染1周时间是炎症反应的高峰期,固有免疫及体液免疫相继激活后病毒清除及病情缓解[7]。但甲流病毒肺炎在感染1周时易进展为重症病毒性肺炎,或者继发细菌性肺炎,该病理状况是甲流病毒感染者临床死亡的主要原因[8]。
肺泡巨噬细胞数量占肺泡灌洗液中细胞成分的80%,是介导甲流病毒感染引起炎症反应最重要的效应细胞[9]。而肺泡巨噬细胞表达的NOD样受体(NOD like receptor,NLRs)及其活性形式炎症小体,是其抗甲流病毒免疫的主要机制[3,10]。
NLRP3炎症小体是抗甲流病毒免疫炎症小体的主要成员,其结构成分包括NLRP3、凋亡相关斑点样蛋白(ASC)与半胱天冬酶1(caspase-1),以NLRP3为核心结构。NLRP3炎症小体抗甲流病毒免疫过程包含两条信号通路。信号通路1为Toll样受体17(TLR17)识别甲流病毒RNA及M2蛋白,通过NFκB途径,诱导NLRP3、caspase-1以及IL-1β基因的表达,生成NLRP3、caspase-1以及pro-IL-1β。信号通路2为NLRP3炎症小体三聚体形成,自剪切无活性的caspase-1为活化的cleaved-caspase-1,cleavedcaspase-1剪切pro-IL-1β为活性的IL-1β并分泌出细胞外[4]。IL-1β作为炎症反应上游的细胞因子,促进炎症反应并清除病原体[11-12]。
对NLRP3炎症小体初期的研究认为,NLRP3炎症小体在抗甲流病毒免疫中被激活并引起炎症反应,对机体起保护作用[13-14]。本实验发现,与空白对照组比,24 h组NLRP3、caspase-1的mRNA表达及蛋白表达均增强,IL-1β的mRNA表达及血清浓度也升高,表现出NLRP3炎症小体信号通路1以及信号通路2均活化。24 h组小鼠肺组织病理示轻度炎症反应。该部分研究结果验证了NLRP3炎症小体在甲流病毒肺炎的早期即被激活并促进炎症反应,而适度的炎症反应有助于病毒的清除,该结论与主流的研究相一致。
但近年越来越多研究认为,在甲流病毒感染1周后,NLRP3炎症小体介导的炎症反应对机体是有害的[15-16]。JIA等[17]发现,在甲流病毒肺炎后期加用奥司他韦联合西罗莫司,有助于减轻肺损害,而该效应是由奥司他韦与西罗莫司抑制了NLRP3炎症小体的活性介导的。因此,有观点认为,抑制NLRP3炎症小体信号通路从而减轻剧烈的炎症反应是甲流病毒肺炎治疗的新方向[18-19]。ZHANG等[20]研究发现,在甲流病毒肺炎的病程中,存在两波炎症细胞因子的高峰,第二波炎症细胞因子的高峰在病程7 d左右,但该研究未进一步研究其机制。本研究结果显示,在甲流病毒肺炎的1周时间,NLRP3及caspase-1的表达比早期进一步升高,IL-1β的转录及分泌也进一步增强,实验小鼠的健康状况及肺炎病理亦证实炎症反应在1周时明显加重。血清IL-1β浓度体现的是全身性的炎症反应水平,该结果支持了ZHANG等的研究发现,NLRP3炎症小体在感染1周时的进一步激活可能参与了第二波炎症细胞因子高峰的机制。本研究结果也与临床工作观察到的甲流病毒肺炎病例在感染1周后进展为重症病毒性肺炎或继发细菌性肺炎的现象相一致。NLRP3炎症小体在感染1周时的进一步激活及其介导的炎症反应可能是甲流病毒肺炎进展为重症病毒性肺炎的机制之一。
综上所述,本研究验证了NLRP3炎症小体在甲流病毒肺炎小鼠肺组织的表达水平及其介导的炎症反应,感染1周后NLRP3炎症小体的表达水平及小鼠肺组织炎症反应比肺炎早期明显增强,推断该效应可能是甲流病毒肺炎进展为重症病毒性肺炎的机制之一。同时,NLRP3炎症小体在甲流病毒肺炎的具体作用以及与其他的信号通路的关系,都有待更深入的研究,这是本实验的局限与展望。