肝双重动脉血供模型的建立与理论应用
田全发郑卫华王子航李朋飞张俊晶
(1.内蒙古医科大学附属医院肝胆外科,呼和浩特 010030;2.山西省汾阳医院泌尿男科,山西 汾阳 032200;3.呼和浩特市第一医院肝胆外科,呼和浩特 010030)
正常肝由门静脉和肝动脉双重血液供应。将肝动脉血保持不变,门静脉血完全或部分被动脉血替代灌注入肝称之为肝双重动脉血供(liver double artery blood supply,LDABS)。此术式是门静脉动脉化的一个分支(portal vein arterialization,PVA),最早由Qiao等[1]提出。LDABS目前主要应用于急性肝功能衰竭、原位肝移植以及辅助肝移植前后的门静脉血栓形成等[2-4],已显示较好的效果,且可维持肝功能和形态[5-7]。但LDABS毕竟改变了正常的生理解剖关系,特殊情况下应用产生的良好效果是否说明该技术可常规应用于此类患者,需要临床前的深入研究[8-9]。因此,建立适宜的动物模型,对于解决上述问题具有重要的意义。目前有关LDABS模型制备方法少有系统文献阐述,尤其在模型中涉及血流控制、血管吻合等问题更是让研究者望而却步。本研究旨在建立一种成熟稳定、易于操作的LDABS动物模型,在此基础上,探讨其理论应用价值。
1 材料和方法
1.1 实验动物
6~8周龄SPF级雄性SD大鼠76只,体重300~330 g,购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001]。本课题组适应性饲养,无菌手术在上海懿贝瑞生物医药科技有限公司中心屏障动物实验设施进行[SYXK(沪)2017-0014],饲养环境:温度21℃~24℃,湿度40%~50%,光照:12 h/12 h明暗交替,噪声<50 dB,IVC笼内饲养,自由饮食。实验过程中按“3R”原则给予人道的关怀。手术显微镜(Leica M 525 F20)双人配合完成,本实验研究通过内蒙古医科大学伦理审查(YKD2015102)。
1.2 主要试剂与仪器
0.9%氯化钠注射液,山东齐都药业有限公司;碳酸氢钠注射液,山西省芮城科龙兽药有限公司;肝素钠,上海化学试剂厂;低分子肝素钙,兆科药业(合肥)有限公司;5%葡萄糖注射液,广东圣戈生物科技有限公司;异氟烷,深圳市瑞沃德生命科技有限公司;注射用青霉素钠,华北制药股份有限公司;10-06-04-0缝合线,宁波医用缝线有限公司;医用纱布敷料,南昌市恩惠医用卫生材料有限公司;医用棉签,湖南永康医疗器械有限公司;M525F20莱卡显微镜,长沙医疗器械厂;小动物气体麻醉呼吸机,上海玉研科学仪器有限公司;显微镊、显微血管夹,上海医疗器械(集团)有限公司。
1.3 实验方法
(1)100%O22~4 L/min混合异氟烷吸入麻醉,浓度3.5%~5%诱导,1.5%~2.5%吸入维持。麻醉成功后取仰卧位,将大鼠四肢固定于自制固定板,术野常规脱毛消毒处理。采用腹正中切口,逐层进腹,自制拉钩暴露手术视野。
(2)血管夹阻断门静脉2 min,4-0线结扎肝左外叶及中叶,开放门静脉,可见剩余肝叶充血性改变(图1A),沿结扎线切除肝左外叶、中叶(图1B),可见残腹腔(图1C)。
(3)下腔静脉下方作隧道放4-0线预防出血。剥除下腔静脉与门静脉外膜,分离右肾动脉(图1D),斜形半剪开右肾动脉(图1E),插入聚乙烯管(管内充满肝素水,长度23 mm,内直径0.5 mm)后再离断右肾动脉,6-0线固定管。
(4)将门静脉骨骼化(图1F),冲洗腹腔。显微镊夹闭门静脉远端,调整脾静脉端在显微镊最里侧,定为“0”点。斜形45°半剪开门静脉(图2A),插入聚乙烯管另一端,6-0线绑定,再离断门静脉。门静脉开放过程不超过1 s。
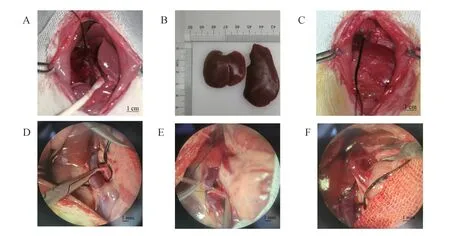
图1 肝双重动脉血供手术步骤Note.A,Results showed that the right lobe,papillary lobe and caudate lobe were congestive.B,Liver tissue removed.C,Abdominal cavity after partial hepatectomy.D,Separation of right renal artery.E,Catheterization of right renal artery.F,Skeletonization of portal vein.Figure 1 Operative steps for the liver arteral blood supply
(5)4-0线阻断下腔静脉两端。显微镊尖端提起下腔静脉,剪成鱼口状,修剪鱼状口直径与门静脉斜形断端直径大致相等,肝素水冲洗断端。可将门静脉近脾静脉端、下腔静脉近心端定为0点,门静脉远离脾静脉端、下腔静脉远心端定位为6点。“米”字形八个点使用找中点法按门静脉定点9-10.5-7.5-6-0-3-1.5-4.5顺序依次缝合(图2B)。每一针按“血管外-里-里-外”用10-0线与相对应点缝合,“0”“6”两点拐角位置,采用拐角水平褥式缝合(图2C)。拐角即血管吻合形成折角的位置。缝合最后一针前短暂开放门静脉使高凝血流出,再大量肝素水冲洗管腔,在肝素水里缝合最后一针。开放下腔静脉两端及门静脉,观察吻合口是否漏血及狭窄(图2D)。
(6)术毕检验聚乙烯管是否通畅。一是观察肝颜色判断管是否通畅,如肝颜色鲜红则通。如肝发黄或暗黄难判定时,显微镊从远心端朝近心端夹闭并撸、刮聚乙烯管,人为制造小气泡观察管是否通畅(图2E)。如通,小气泡被快速推走,如不通,小气泡在原处。
(7)观察如无活动性出血,6-0连续缝合肌肉层连同腹膜,4-0间断缝合大鼠皮层,动物模型成功。
3.3 入库:彻底清洁后将机子开进机库,无机库的要加盖防雨淋,日晒的简易棚,用塑料袋将柴油、机油的加油口、空滤器、排气管口包扎,以防尘土进入。
1.3.2 围手术期处理
术前12 h禁食,不限饮水。术前1 h称重,低分子肝素钙100 U/kg皮下注射,阿托品0.03 mg/kg肌注,同时颈部皮下注射生理盐水、5%葡萄糖及5%碳酸氢钠共4 mL(比例3∶3∶1配置)。术中根据大鼠呼吸频率判断麻醉深度以便调节异氟烷浓度,术毕停止吸入麻醉药,大鼠在术后4 min内苏醒,可翻身活动。术后暖光照射1 h,自由进水,术后第1天给食。术后前3 d青霉素肌注10000 U/100(g·d),皮下注射低分子肝素钙100 u/kg,q12 h。
1.4 观察内容
记录手术时间,计算造模成功率,观察大鼠术后一般情况,包括毛发、色泽、尿液颜色、体重、肝体积变化及色泽改变。术后24 h采用Vero 2100超高分辨率小动物超声影像系统(加拿大Visual Sonics)检测大鼠门静脉静脉及吻合口血流情况。
2 结果
共纳入76只大鼠,40只作为训练组,36只大鼠作为模型组。训练组动物术中门静脉出血3只,吻合口缝合完有渗血数量为10只;术后死亡尸检出血8只,肺栓塞10只,肝坏死4只,肠坏死5只。模型组大鼠死亡4只,尸检:肺栓塞2只,肝坏死1只,肠道坏死1只。模型组手术时间为(65.3±6.56)min,血管吻合时间(11.1±2.53)min。术中无明显副损伤,出血量(0.6±0.21)mL,术后存活超过24 h标志造模成功,成功率100%(36/36),相关并发症发生率为0%。大鼠术后能自由进食水,警觉,活动如常,毛发光泽略暗。术后24 h尿液呈淡红色,48~72 h后尿液颜色恢复正常色泽。术后24 h超声检测门静脉血流(5.8±1.5)mL/(min·g)肝重(与原门静脉血流量相似),吻合口血流通畅,无明显狭窄。1周后造模成功率88.9%(32/36),相关并发症发生率为11.1%。1周后大鼠取材,剖腹探查发现肝呈鲜红色色泽改变,肝体积饱满及增大明显,右肾实质发黄萎缩,吻合口愈合良好,通畅无狭窄(图2F)。
3 讨论
3.1 手术操作技巧及改进
此模型术式主要包括三个步骤:肝切除、门腔静脉吻合及门静脉动脉化。70%肝切除是经典肝再生研究模型,其手术技巧大多文献谈及[10]。此不再赘述,但得需注意以下问题:在结扎肝叶前阻断门静脉2 min,可使血量丢失更少。结扎位置较深肝叶时,避免撕扯、牵拉肝组织。打结时尽量靠近被切除的肝叶,避免结扎下腔静脉。门静脉动脉化指将门静脉改道,门静脉远端注入下腔静脉,近端引入右肾动脉血。
血管吻合口漏血及狭窄是主要并发症[11-13],这也是早期模拟训练需解决的主要问题之一。因门静脉及腔静脉位置固定、内径小、壁薄、位置深,门腔吻合在技术上更具有挑战性。吻合方式方法有多种,但至今没有一个理想的方法可供借鉴,完美的微血管缝合技术应具备吻合方式易操作、血管缺血时间短、血管壁损伤小及最佳的近远期通畅率等优点。陈永亮等[14]运用缝合的方式,将门静脉端侧与肝动脉吻合,侧侧吻合连接下腔静脉与门静脉制作完全门静脉动脉化(CPVA)大鼠模型。此方法对于外科手术者操作要求较高且稳定性较差,手术时间长,血液形成逆流,易致大量血栓形成,且创伤大。陈鹏等[15]通过切除左肾,利用同种异体材料作为套管,将左肾动脉与原有门静脉血共同汇入门静脉制作门静脉动脉化,优点是术式简单,手术时间短。但缺点也明显:门静脉属支有发生回流受阻的可能,易形成免疫反应,术后随时间推移发生血管扭转,引起狭窄的可能性较传统术式高。基于文献和课题组前期的工作基础[16-17],针对门腔静脉解剖特点,课题组再次对血管吻合进行了改进与创新。吻合口修剪为鱼口状,以脾静脉汇合处作为参照,按照特定的顺序进行(图2B),特定顺序能够在不必牵引血管情况下,保证外翻缝合。Qiao等[17]多采用定点缝合,反复牵引、调整位置用来保证外翻缝合,增加了血管壁损伤的概率,牵引张力不均匀亦出现针距的不均匀。而本研究提出的“米”吻合顺序无需反复翻转血管牵引缝合,可以避免上述情况发生。门腔静脉吻合时需将系膜组织以及肠管整体向左侧翻转,血管吻合时存在一定的张力,“米”顺序吻合时“0”“6”两点拐角位置尤为明显,当恢复正常解剖位置时,容易渗、出血。前期训练组常规方法吻合拐角,有渗血数量为10只,需用压迫3 min;术后出血死亡数为8只,尸检发现大部分是因两拐角出现问题,这种现象与门腔静脉血管解剖位置、吻合手法技巧有关。在此,笔者课题组创新性采用拐角两点水平褥式缝合法,既有利于外翻缝合,又让拐角结合处受力均匀,避免血管牵张力不均而形成漏,又使吻合口出血极少。36只模型组大鼠使用拐角两点水平褥式缝合法后实现了术中吻合口出血极少,术后出血死亡数为零。但需注意水平褥式缝合时缘距及针距不可过大,否则易狭窄。
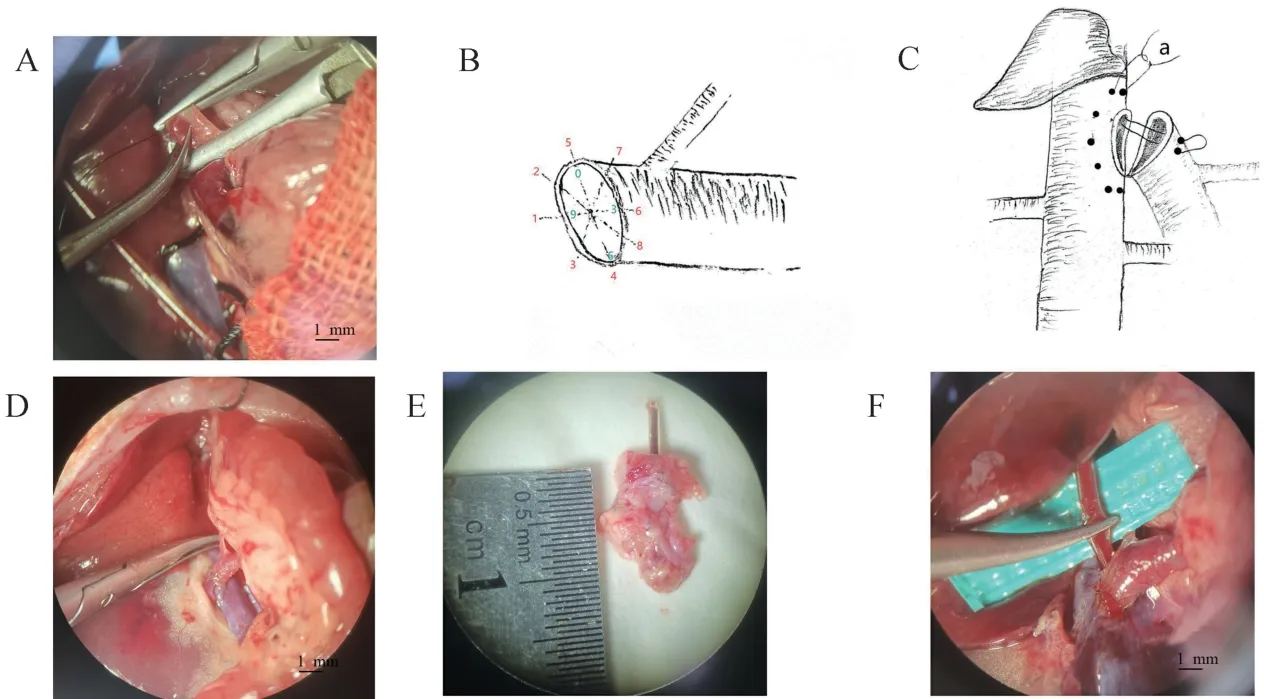
图2 肝双重动脉血供手术步骤及手术技巧简图Note.A,Oblique 45°half cut open-door vein.B,Oblique 45°cut open-door vein,the circle is the cross-section of blood vessel.The number in the tube wall represents the time of the clock and the number outside the tube wall indicates the suture sequence.C,Schematic diagram of portal vein anastomosis.a,Horizontal mattress suture at two points at the corner.D,Portal vena cava anastomosis(0 h).E,Unobstructed anastomosis(168 h).F,Artificially made small bubbles to observe whether the tube is unobstructed.Figure 2 Schematic diagram of the operative steps and surgicaltechnique for the liver dual arterial blood supply
门静脉动脉化时,因动脉壁厚且直径小,静脉壁薄且直径大,如直接吻合并发症多,且不易控制血流量。既往文献研究证实,门静脉压力过高过低都会抑制肝再生[18-20]。本研究借助内径0.5 mm聚乙烯管将右肾动脉血液引入门静脉,形成肝双重动脉血供。此管内径出血量与门静脉原有血流量相似,且可避免血管吻合所带来并发症。门静脉血流通畅是保证模型成功的基础,既往有文献报道,门静脉动脉化后肝萎缩,考虑与门静脉架桥血流不通畅有关[18]。架桥血管是否通畅,包含肾动脉侧因素、架桥血管因素以及门静脉侧因素。肾动脉侧需注意假道,肾动脉插入聚乙烯管时易把动脉内膜或肌层强推到管径内人为造成堵塞。此时手法技巧很重要,本研究首次使用斜形半剪开肾动脉后,镊子轻提肾动脉断端的全层,管旋转插入可避免。
门静脉侧置管,是本研究的创新点之一,本研究首次提出利用自身牵引法,斜形45°半剪开门静脉方法(图2A注意角度及位置)置管,然后离断,避免了门静脉回缩。45°斜切可使吻合口面积扩大2倍,不至于产生吻合口狭窄。此外,还需观察右肾动脉血液流出情况。可以短暂开放右肾动脉,如血流速度快,呈喷射状,可以置入;如血流速度较慢,注意观察右肾动脉有无分支。如有,需结扎肾动脉分支,否则会影响血流速度。操作过程中,保持肝素水不定时冲洗聚乙烯管管腔,防止血栓形成。
3.2 并发症的预防
血管吻合前已述及,是模型制备的关键,而由血管吻合导致的并发症发生率可以通过大量的模拟训练降低或避免。除此而外,其他并发症亦影响模型制备的效果和成功率,如模型操作过程中脏器功能保护、麻醉护理等等。通过前期模拟操作后,造模组仍有4只大鼠死亡,其原因考虑如下。
3.2.1 出血
分术中出血及术后出血,术后出血在门腔静脉吻合处已经谈及,此处不再赘述。术中出血多发生在门静脉骨骼化过程中,由于门静脉解剖结构复杂,门静脉下方紧贴肝固有动脉,左侧有脾动静脉分支,且无明显分离界限,由纤维组织缠绕相连。因此,术中动作尽量轻柔,必要时可用显微剪刀剪断纤维组织,不可强撕扯,易造成血管壁破裂。本组没有术中出血导致的死亡,但术中出血影响术后存活。
3.2.2 肺栓塞
为最严重及最常见的并发症之一。熟练显微操作,缩短手术阻断时间是关键因素之一,同时皮下注射低分子肝素钙[21]。及时清理吻合口周围微小杂物,缝合完毕前肝素水多次冲洗管腔。在吻合最后一针前,短暂开放门静脉释放淤阻的高凝血液与血凝块。通过改进,造模组此并发症大大减少,但仍有2只动物因此而死亡。
3.2.3 肝坏死
尸检时发现肝土黄色改变,肝表面有散在出血点。前已述及,结扎肝蒂时线尽量靠近预切除的肝叶,同时注意不能结扎了肝叶后方的下腔静脉。本组有1例动物肝坏死死亡,考虑与此有关。
3.2.4 肠道坏死
避免肠管长时间受到压力,暴露视野时,可暂将肠道置于腹腔外。每隔3 min暴露的肠管上滴加生理盐水,肠管放回原位时,采用棉签轻拨、动作轻柔,避免肠道折叠甚至打结造成肠梗阻。吻合口狭窄、血栓形成也是肠道坏死的重要原因,术后第1天内禁食,可预防急性胃肠扩张。通过模拟训练,此种情况在后期较为少见。
3.2.5 感染
由于实验环境在相对无菌条件下进行,加之术中及术后3 d常规应用青霉素肌注,同时注意术中严格按照无菌操作进行。本组大鼠均未因感染而死亡。
围术期护理方面:(1)吸入性麻醉剂异氟烷在肝代谢率低,肝毒性小,对胃肠道机能影响小,是理想的麻醉剂[22]。术中麻醉剂摄入值越小,副作用越小。当术中调整至浓度1.5%甚至更低时,此时应密切注意大鼠呼吸频率及幅度。当在大鼠出现首次惊厥,或呼吸频率急促,表示大鼠即将苏醒,说明给的剂量低,大鼠会在3~5 min内恢复意识。需立即调高流量0.3%~0.5%剂量。(2)术前肌注阿托品,可减少呼吸道分泌物、防止窒息等并发症。(3)因门腔静脉吻合时需阻断门静脉、下腔静脉血液回流,时间过长易致缺氧性酸中毒,适当的补充碳酸氢钠则可改善肠道缺血缺氧再灌注损伤形成的酸中毒。(4)皮下注射低分子肝素钙可预防长时间血流阻断,细小血凝块析出致肺栓塞发生的几率。(5)术后24 h内需禁食,进食可能因手术、麻醉等致胃肠蠕动功能降低,有可能导致急性胃肠扩张,必要时可行胃插管进行胃肠减压对症治疗,可建议给予颈部皮下注射生理盐水、5%葡萄糖及5%碳酸氢钠共4 mL(比例3∶3∶1配置)进行基础能量补充。术后第1天再给予鼠粮进食。
综上所述,多种因素都能影响LDABS动物模型的存活。因此,必须重视操作中所有细节。熟练进行显微外科操作,精准手术是缩短操作过程及减少手术并发症的前提;良好的麻醉控制,稳定的血流动力学及术后围手术期精心护理等才能够使手术成功率大大提高。

