齿科研磨粉尘致大鼠肺组织损伤的实验研究
刘 名,王 蔚*,侯玉明,艾红军
(1.中国医科大学口腔医学院 附属口腔医院,辽宁省口腔疾病重点实验室,沈阳 110002;2.绍兴市中心医院,浙江 绍兴 312000)
近年来粉尘污染越来越引起人们的关注,长期接触粉尘的作业人员,当吸入的粉尘量达到一定数量时即可引发尘肺病、鼻炎、咽炎、支气管炎、皮疹、眼结膜损害等[1-2]。粉尘污染同时也存在于口腔行业,诊疗过程中牙体组织的切除、修复材料的调磨,气枪、水枪、高速手机及低速手机产生的气雾、飞沫、尘埃等均会对周围环境造成污染[3]。
钴铬钼合金(商品名:维他灵Vitallium)、二氧化锆(zirconiumdioxide, ZrO2)全瓷、PMMA(polymethyl methacrylate)树脂等修复材料在口腔领域广泛应用,Vitallium主要应用于可摘局部义齿金属支架,ZrO2全瓷主要应用于单冠、嵌体冠及固定桥的修复,而PMMA树脂为全口义齿及基托的重要组成部分,修复体材料在制作及调磨过程中会产生不同形状及大小的粉尘。Vitallium粉尘颗粒主要由钴、铬、钼、铁组成,其中钴铬钼的合金含量高达97%以上,研究表明,长期的钴铬钼暴露会引起以化痰、流涕为主的呼吸道疾病及肺组织损伤甚至肺纤维化[4-6]。ZrO2组粉尘颗粒的主要元素为硅、氧、钾、铝、钠,主要成分为二氧化硅,长期吸人二氧化硅粉尘会引起肺部组织的慢性疾病,有研究表明口腔修复诊室中饰面瓷粉尘的时间加权平均容许浓度为0.393 mg/m2,超出国家安全范围[2];且已有齿科二氧化硅致矽肺、肺部多发性肉芽肿伴淀粉样沉积的病例报道[7-9]。PMMA组的粉尘颗粒主要元素为碳和氧,为有机粉尘,长期暴露于PMMA环境下可导致机体产生皮肤炎症、刺激眼睛或粘膜、过敏性皮炎、哮喘、中枢和周围神经系统疾病及过敏性肺炎等呼吸系统损伤[10-12]。
目前关于齿科研磨粉尘对健康影响的研究多局限于病例报道及流行病学调查,针对口腔修复诊室,调磨、修改义齿过程中产生的粉尘污染问题研究较少,尚缺乏建立统一的动物模型进行系统的定性定量的分析研究,本研究使用扫描电镜(scanning electron microscope,SEM)及激光粒度分析仪(particulate size description analyser,PSDA)作为检测手段分析齿科研磨粉尘及精细研磨粉尘颗粒的表面形态及粒径大小,通过非暴露式气管染尘法建立齿科粉尘大鼠染尘模型,用吉姆萨染色(Giemsa)及酶联免疫吸附测定法(ELISA)检测染尘大鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中炎症细胞的数量变化及白细胞介素-6(interleukin-6,IL-6),白细胞介素-16(interleukin-16,IL-16)水平的变化,同时应用HE染色观察肺组织切片病理改变,旨在探讨齿科粉尘对大鼠肺组织是否产生潜在影响,为今后进一步研究齿科粉尘暴露对机体健康影响提供理论基础,同时也为齿科临床防尘保护提供依据。
1 材料和方法
1.1 实验动物
雄性SPF级Wistar大鼠,8周龄,63只,体重(250±10)g,由沈阳陆军总院实验动物中心提供[SCXK(辽)2015-0001],饲养于沈阳陆军总院实验动物中心[SYXK(辽)2018-0008],实验研究过程遵守“3R”原则,并通过沈阳军区总医院实验动物伦理委员会伦理审查(2015042)。
1.2 主要试剂与仪器
甲苯(国药公司,中国);苏木精(国药公司,中国);曙红Y,醇溶(国药公司,中国);大鼠白介素酶联免疫分析试剂盒(上海卧宏,中国)。Ⅱ型自凝模型粉及义齿基托树脂液剂(上海珊瑚齿科材料有限公司,中国);Vitallium金属(登氏柏公司,美国);ZrO2体瓷(VITA公司,德国);SSX-550扫描电子显微镜(岛津公司,日本);电子显微镜(LUMPUS公司,日本);能量分散光谱仪(岛津公司,日本);Master sizer Macro激光粒度分析仪(Malvern公司,英国);-30℃恒冷低温切片机(Cleica,德国)。
1.3 实验方法
1.3.1 齿科研磨粉尘的制备
将Vitallium金属、ZrO2体瓷、PMMA树脂制备成14 mm×14 mm×3 mm的实验模块,用金刚砂车针调磨处理,收集调磨后的粉尘颗粒各10 g,平均分为两组,随机选取其中一组粉尘,分别在玛瑙研钵中研磨2 h致粉尘颗粒变小。
1.3.2 扫描电子显微镜观察
取齿科研磨粉尘颗粒各样本,分别固定于载物台上真空中喷镀金膜,应用SEM对各组样本进行观察检测。
1.3.3 激光粒度分析仪检测
取齿科研磨粉尘颗粒各样本,分别置于激光粒度分析仪的样品槽内,在网兜处加入钢球后进行PSDA测量分析。
1.3.4 实验动物分组
将大鼠随机分成7组,每组又分为三个时间点共9只:对照组(N,不染尘,生理盐水组)、实验组齿科材料颗粒未研磨PMMA组(A1)、未研磨Vitallium组(B1)、未研磨ZrO2组(C1)、和精细研磨PMMA组(A2)、精细研磨Vitallium组(B2)、精细研磨ZrO2组(C2),每组的实验周期均为3周、6周、12周。
1.3.5 实验大鼠非暴露式气管染尘
将未研磨组与精细研磨组粉尘,分别溶于生理盐水中配成浓度5 g/100 mL悬液,高温高压灭菌,加入800000 U青霉素备用。将大鼠麻醉、固定、气管插管,插入穿刺针至主支气管上方约1 cm处,回抽注射器可见气泡且回抽时无阻力,确认已插入气管内,将1 mL实验组悬液及对照组不染尘生理盐水分别打进大鼠双肺中,染尘后的大鼠,应尽快从染尘架上取下来,并给予心肺复苏。
1.3.6 实验大鼠肺泡灌洗液收集及细胞计数
分别于术后3周、6周、12周,大鼠进行麻醉处死,分离气管至肺组织完全暴露,在气管离心端做一横行切口,用注射器吸取2 mL预冷的生理盐水,通过导管以较小的压力将盐水缓慢注入肺内,见肺逐渐膨隆、苍白,立即缓慢回抽灌洗液,再将所得液体缓缓注回肺内,反复2次,置于离心管中冷冻离心2000 r/min 10 min,分离上清液和细胞,使用0.1 mL预冷的PBS重悬细胞,吹匀后,吸取10μL细胞悬液,滴加在细胞计数板上,显微镜下行白细胞总数计数;另吸取10μL细胞悬液,制成细胞涂片,甲醇固定后进行Giemsa液染色,显微镜下观察细胞形态,并进行细胞分类计数。
1.3.7 ELISA检测肺泡灌洗液中IL-6、IL-16浓度
按照ELISA试剂盒说明书,依次梯度稀释标准品蛋白,并进行加样、温育、洗涤、加酶、再次温育、洗涤、显色、终止,最后在450 nm波长测定各孔吸光度(OD值),并用空白孔调零,以标准品的浓度为横坐标,调零后的OD值为纵坐标,绘制标准曲线,由标准曲线计算出待测样品浓度。
1.3.8 肺组织HE染色
打开大鼠胸腔,将大鼠全肺取出将肺剔除气管、支气管结缔组织及心脏,在生理盐水内漂洗1次,用滤纸吸干。将整个肺用10%中性缓冲福尔马林液固定,石蜡包埋,切片厚度为5μm,HE染色,普通光镜下观察肺组织病理变化。
1.4 统计学方法
实验数据应用SPSS 21.0软件进行统计分析,数据以平均数±标准差(±s)表示,组间比较采用单因素方差分析,两组间比较采用t检验,P<0.05为差异有显著性。
2 结果
2.1 SEM观察结果
六组不同齿科粉尘颗粒的表面形态有明显差异(图1),PMMA组(图1A1、A2)颗粒呈团块状,大小不一,尺寸相差较大,表面形态不规则;Vitallium组(图1B1、B2)颗粒较大,形状不规则,呈薄片状、卷曲波纹状结构;ZrO2组(图1C1、C2)粉尘颗粒相对较小,边缘锐利,呈团块状不规则结构。精细研磨后粉尘颗粒明显变小,除PMMA精细研磨组(图1A2)粉尘表面圆钝外其余两组形态无明显改变。

图1 齿科材料研磨粉尘颗粒的SEM观察Note.A1,PMMA non-grinding group.A2,PMMA fine grinding group.B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Figure 1 SEM observation of dental dust particles
2.2 激光粒度分析结果
三组不同齿科材料及精细研磨后粉尘颗粒的粒径分布结果(表1、图2),三种齿科研磨粉尘的粒径分布均不同,且分布范围较为广泛,精细研磨后粉尘粒径不同程度减小。
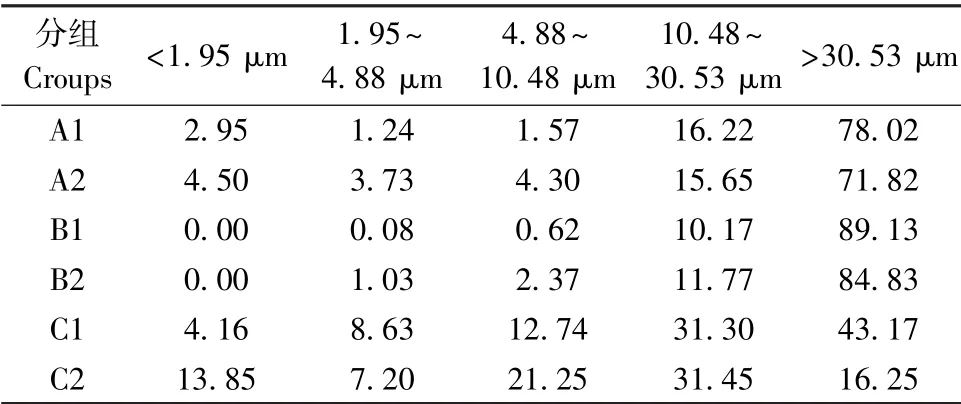
表1 未研磨及精细研磨后粉尘颗粒的粒径分布(%)Table 1 Particle size distribution of non-grinding dust and fine grinding dust
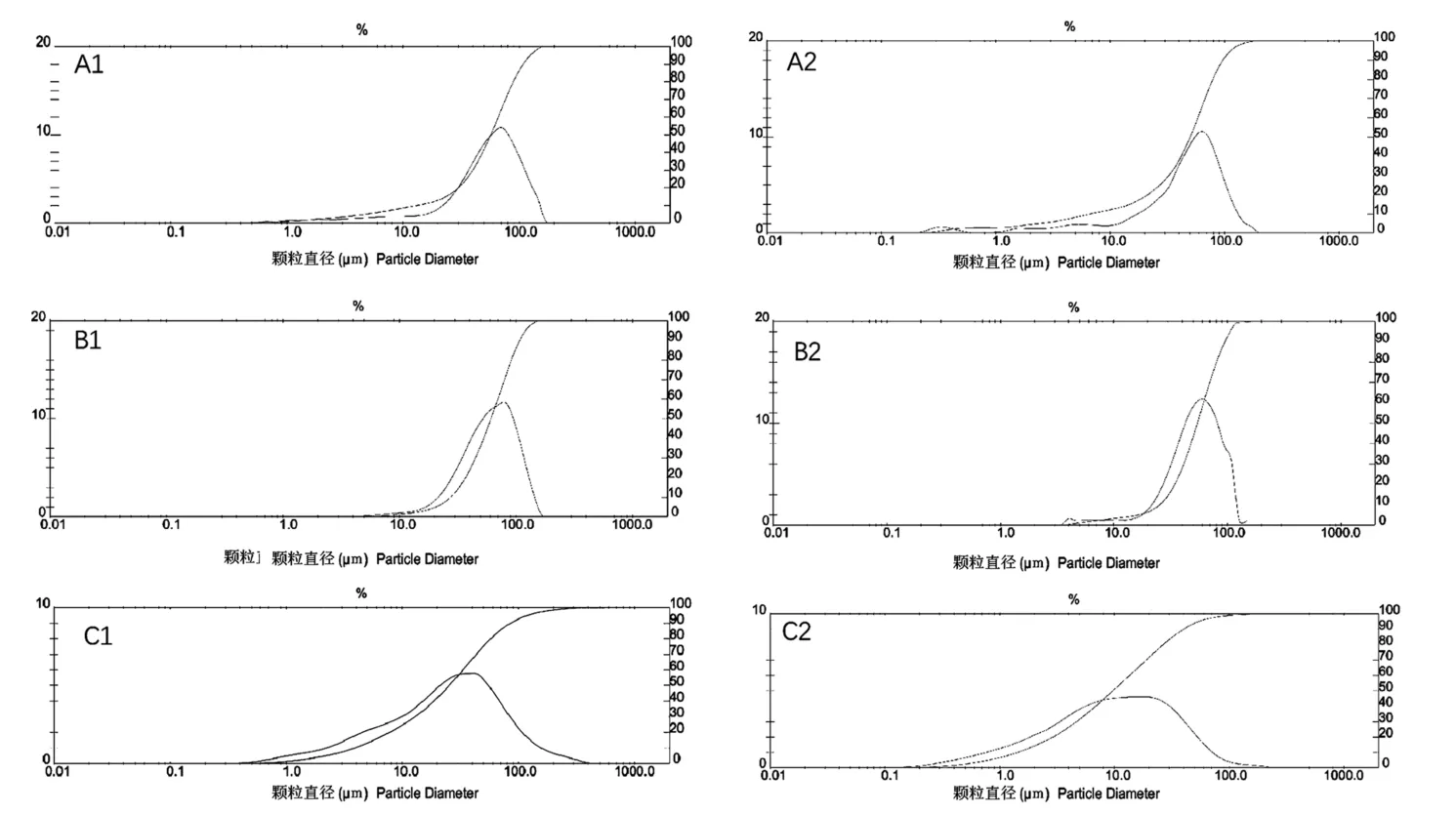
图2 未研磨及精细研磨后粉尘颗粒的粒径分布曲线Note.A1,PMMA non-grinding group.A2,PMMA fine grinding group.B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Figure 2 Particle size distribution curves of non-grinding dust and fine grinding dust
2.3 支气管肺泡灌洗液的炎症细胞染色图片及计数
2.3.1 大鼠BALF中炎症细胞Giemsa染色图片
如图3所示,红色箭头所示为中性粒细胞,其特点为细胞圆形,胞浆粉红色,核形不一,细胞核常染成深紫红色;绿色箭头所示为巨噬细胞,其特点为胞体圆形,胞质疏松、淡染,呈淡蓝色;黄色箭头所示为淋巴细胞,其特点为细胞核占细胞体积大且致密,胞浆极少,常染成深蓝色至蓝色。与不染尘生理盐水的对照组相比,未研磨及精细研磨染尘组在3周、6周、12周的BALF中白细胞总数均明显增高,且随染尘时间的延长,细胞数量的增加越明显。

图3 不同观察时点各染尘组及对照组Giemsa染色图Note.N,Control group.A1,PMMA non-grinding group.A2,PMMA fine grinding group.B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Red arrow,Neutrophil.Green arrow,macrophage.Yellow arrow,lymphocyte.Figure 3 Giemsa staining in dust exposed group and control group at different observation time points
2.3.2 大鼠BALF中白细胞总数的改变
将Giemsa染色结果进行白细胞总数计数后,如图4所示,与不染尘生理盐水的对照组比,未研磨及精细研磨染尘组在3周、6周、12周的BALF中白细胞总数均明显增高,并具有统计学意义(P<0.05),且随染尘时间的延长,细胞数量的增加越明显;与未研磨组比,从第6周起,除12周C2组外其余各精细研磨组白细胞数量均明显高于未研磨组,差异具有统计学意义(P<0.05)。
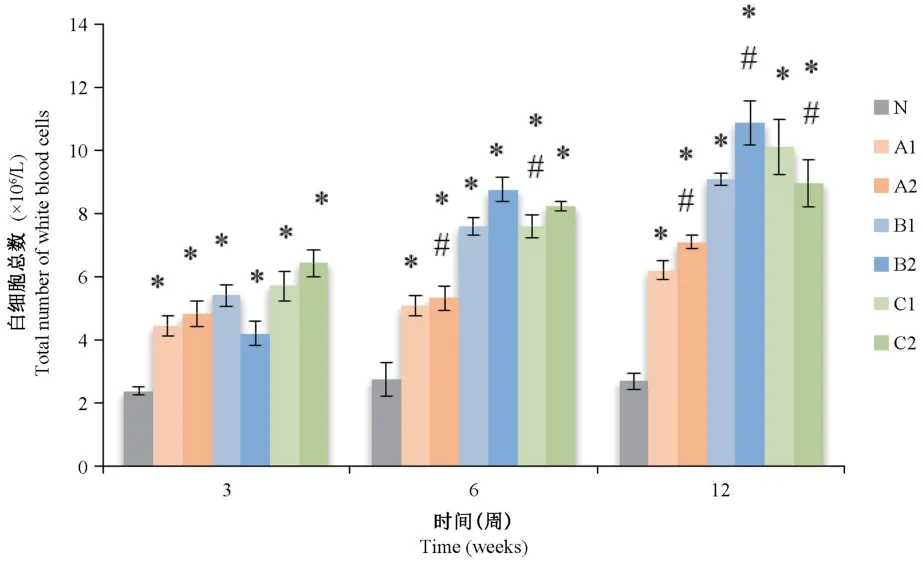
图4 各组大鼠BALF白细胞总数变化情况Note.N,Control group.A1,PMMA non-grinding group.A2,PMMA fine grinding group.B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Dust group compared with the control group,*P<0.05.Fine grinding group compared with the non grinding group,#P<0.05.The same as below.Figure 4 Total number of white blood cells in BALF of rats in each group
2.3.3 大鼠BALF中巨噬细胞数量改变
将Giemsa染色结果进行巨噬细胞计数后,如图5所示,与对照组相比,研磨及精细研磨染尘组在3周、6周、12周的BALF中巨噬细胞数量明显增高,并具有统计学意义(P<0.05);与未研磨组相比,从第6周开始,除12周C2组外其余各精细研磨组巨噬细胞数量均明显高于未研磨组,差异有统计学意义(P<0.05)。
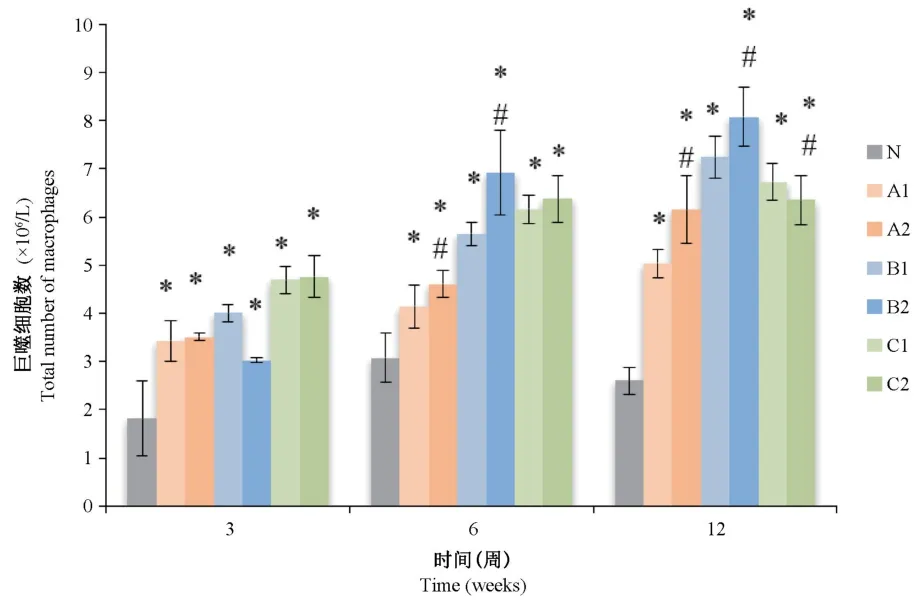
图5 各组大鼠BALF巨噬细胞总数变化情况Figure 5 Total number of macrophages in BALF of rats in each group
2.4 支气管肺泡灌洗液中IL-6、IL-16含量
2.4.1 大鼠BALF中IL-6含量
如图6所示,与对照组相比,染尘组BALF中IL-6含量均增高,12周时明显增高,除6周A1,A2组外,其余组差异均具有统计学意义(P<0.05);与未研磨组相比,精细研磨组在各时间点BALF中IL-6含量均增高,12周时B2组相比于B1组,C2组相比于C1组,差异有统计学意义(P<0.05)。

图6 各组大鼠BALF中IL-6含量Figure 6 IL-6 content in BALF of rats in each group
2.4.2 大鼠BALF中IL-16含量
如图7所示,与对照组相比,染尘组BALF中IL-16含量均增高,除6周A1,A2组外,其余组差异均具有统计学意义(P<0.05);与未研磨组相比,精细研磨组在各时间点BALF中IL-16含量均增高,12周时B2组相比于B1组,C2组相比于C1组,差异有统计学意义(P<0.05)。

图7 各组大鼠BALF中IL-16含量Figure 7 IL-16 content in BALF of rats in each group
2.5 肺组织切片病理变化
HE染色结果如图8所示,对照组(图8A)肺组织3周时有少量炎细胞浸润,结构无明显改变,6周及12周肺组织结构完整,清晰,肺泡壁连续。而各染尘组(图8B、8C、8D)3周时可见少量炎细胞浸润,6周炎细胞浸润增多,肺泡间隔增宽,肺泡壁被破坏,12周肺组织破坏明显,肺泡结构紊乱,肺泡腔及间质内大量炎性细胞浸润,纤维化形成;其中,C2组在6周即出现纤维样改变。

图8 不同观察时点各染尘组及对照组肺组织变化Note.A,N,Control group.B,A1,PMMA non-grinding group.A2,PMMA fine grinding group.C,B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.D,C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Figure 8 Changes of lung tissue in dust exposed group and control group at different observation time points
3 讨论
不同粒径的粉尘引发的机体生物学毒性差异显著,粉尘粒径大小决定了其在人体呼吸系统内沉积的位置及对人体健康的危害程度[13-14]。研究表明,大于10μm的粉尘可沉积在鼻咽和气管支气管的呼吸道区域,10~0.1μm的粉尘有90%可沉积于人体呼吸道和肺泡上,5~0.5μm的粉尘沉积率随粒径的减小而逐渐降低,而0.4μm以下的粉尘随粒径减小沉积率增大,其中粒径小于2.5μm的粉尘主要沉积在肺泡,更易导致机体的损伤[15-16]。鉴于粉尘收集过程中环境无法达到绝对密闭,打磨过程中产生的小粒径粉尘,易悬浮在空气中无法收集,且悬浮于空气中的小粒径粉尘颗粒更易被吸入,故本实验采用研磨精细研磨收集的粉尘,以模拟临床上产生的小粒径粉尘,本实验结果也表明,精细研磨后Vitallium及ZrO2粉尘较研磨前,对大鼠肺组织炎性损伤更强。
中性粒细胞、巨噬细胞、淋巴细胞等炎症细胞的迁移和活化为肺部损伤的主要炎症性免疫反应,支气管肺泡灌洗液中粒细胞的增多,被认为与肺纤维化密切相关,它的大量出现是肺细胞损伤的标志[17-19],巨噬细胞是粉尘作用的主要靶细胞,巨噬细胞的活跃在肺损伤以及纤维化过程中发挥重要作用[20]。本实验中大鼠染尘后白细胞及巨噬细胞数量高于对照组(P<0.05),除了12周C2组外,从6周开始精细研磨组的白细胞及巨噬细胞含量均高于未研磨组,其中12周B2组炎症反应最为明显,说明Vitallium粉尘研磨后致炎作用更强,而C2组白细胞及巨噬细胞数量在6周时明显高于C1组,但12周时低于C1组,表明C2组染尘后期炎细胞表达有所降低,可能与其早期就有纤维化的形成有关,本实验结果与HE染色中C2组(图7)在早期就观察到纤维组织形成结果一致,并提示精细研磨后ZrO2粉尘对大鼠肺组织早期炎性作用明显。
随着炎症的发展,巨噬细胞吞噬粉尘颗粒,细胞活化并产生大量炎性因子,白介素作为一种重要的细胞因子,在调控尘肺炎症和纤维化过程中发挥了重要的作用,其中IL-6能促使黏附分子浸润到肺中,诱导胶原的合成,抑制胶原的降解[21],研究发现,细胞因子IL-6在患有肺纤维化的小鼠和人类中明显升高[22],IL-6等促炎细胞因子的增加以及中性粒细胞内流是肺囊性纤维化炎症的显著早期特征[23]。IL-16又称淋巴细胞趋化因子,Zhou等[24]发现IL-16在小鼠肺损伤及纤维化过程中明显增高,Glass等[25]发现,在博来霉素引起的大鼠肺纤维化中IL-16发挥了重要作用,可以作为一种肺纤维化的候选指标。本实验中染尘大鼠BALF中IL-6与IL-16含量变化趋势一致,各染尘组12周IL-6与IL-16的含量较3周、6周时增加更明显,可能与12周时,肺组织结构逐渐纤维化有关[23-25],IL-6与IL-16的变化说明3种齿科粉尘对大鼠肺组织均有损伤,可导致大鼠早期肺炎症反应及早期纤维化改变,与HE染色结果相符。12周时Vitallium及ZrO2粉尘精细研磨组与未研磨组相比,IL-6与IL-16含量存在统计学差异,说明Vitallium及ZrO2粉尘经精细研磨后对大鼠肺组织的损伤作用及早期纤维化作用增强。
综上所述,Vitallium金属、ZrO2全瓷、PMMA树脂3种齿科粉尘研磨前后,均能引起染尘大鼠肺组织炎性损伤,齿科临床医师长期暴露于齿科粉尘颗粒环境下可能会引起肺组织炎症甚至损伤,金属及瓷粉粉尘粒径越小其致病力可能越强,具体损伤机制及程度,有待进一步研究。

