二甲双胍调控miR-34a对慢阻肺大鼠气道炎症的影响研究
苏红见,乔亚红*,安云霞,韩 利
(1.河南省胸科医院呼吸与危重症二病区,郑州 450003;2.河南省人民医院呼吸内科,郑州 450003)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种气流受限疾病,表现为气流受阻不可逆,并呈进行性变化,且肺、气管、支气管因有害物质导致的慢性炎症疾病[1]。吸烟是COPD发生的最主要原因,生物燃料的大量采集和消耗亦促进COPD发生[2]。目前尚无根治COPD的有效方法,二甲双胍(metformin,Met)作为经典的降压药,是临床上2型糖尿病的首选药物[3];随着研究深入,Met还有抗炎、抗氧化、保护心血管系统等功效,在多发性硬化症中能够降低炎症因子白介素-6的表达[4];在COPD中能减轻肺部炎症反应及氧化应激,从而改善肺功能[5],但针对其具体作用机制尚不清楚。微小RNA(microRNA,miRNA)可影响其他物质水平而发挥抗氧化和抗炎作用,已成为临床上最具潜力的生物标志物[6],且Met能够调控miRNA的表达从而影响多囊卵巢综合症患者卵丘颗粒细胞增殖和凋亡,从而影响疾病[7]。推测Met可能影响miRNA水平而影响疾病。本文建立COPD大鼠模型,Met处理观察对COPD的影响,并观察miR-34a高表达是否影响其作用。
1 材料和方法
1.1 实验动物
54只SPF级SD大鼠,雄性、9周龄,购自北京维通利华实验动物技术有限公司[SCXK(京)2018-0021],在河南省中医药研究院实验动物中心暂养并进行实验[SYXK(豫)2019-0001],体重(250±10)g。将动物置于温度(24.5±0.5)℃、湿度(50±5)%、12 h光照/12 h黑暗环境中饲养,正常饮食,通风良好。本实验经本院伦理委员会审核并通过(20190017),实验符合3R原则。
1.2 主要试剂与仪器
脂多糖(lipopolysaccharide,LPS)、苏木精-伊红(hematoxylin-eosin,HE)试剂盒(Solarbio公司,货号分别为:L8880-10 mg、L9406);盐酸Met片(悦康药业集团股份有限公司,批准文号:国药准字H-20184075);agomir NC、miR-34a agomir均购自广州锐博生物科技公司;引物由茎环法+染料法设计、上海生工生物工程有限公司合成;wright染色试剂盒(北京雷根生物技术有限公司,货号:DM0004);大鼠白介素(interleukin,IL)-6、IL-8、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒、一抗兔抗沉默信息调节因子1(sirtuin 1,sirt1)(英国abcam公司,货号分别为:ab213777、ab108869、ab188865、ab263899、ab110304)。实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)仪(赛默飞世尔,型号:PikoREAL);蛋白凝胶成像仪(美国Bio-Bad公司,型号:170-8200)。
1.3 实验方法
1.3.1 动物建模及分组
参照文献[8]制备COPD模型:将44只大鼠放置在点燃8支香烟的烟熏箱中烟熏,每天烟熏30 min,持续30 d,并在第1、14、28天经气道滴注2 mL LPS溶液(盐水溶解为1 g/L LPS),气道滴注当日不进行烟熏。造模过程中死亡4只,其余40只大鼠随机分为模型(model)组、Met组、Met+阴性对照(Met+agomir NC)组、Met+miR-34a高表达(Met+miR-34a agomir)组,每组10只。另取10只大鼠在第1、14、28天经气道滴注2 mL生理盐水为对照(control)组。模型处理后第2天Met组每天灌胃230 mg/kg Met[5],Met+阴性对照组灌胃230 mg/kg Met、尾静脉注射1μmol/L agomir NC,Met+miR-34a高表达组灌胃230 mg/kg Met、尾静脉注射1μmol/L miR-34a agomir,每天1次、连续2周。
1.3.2 样品收集
实验前、实验结束后对所有大鼠称重,观察大鼠情况。麻醉大鼠切开胸腔,暴露出心脏,心脏取血约5 mL;右主支气管结扎,套管针在隆突后穿刺进入左肺,2 mL生理盐水灌洗左肺,缓慢回抽,每次回抽约1.5 mL液体,反复灌洗3次,对支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细胞计数。取右肺,部分置于4%多聚甲醛中固定;部分置于-80℃冰箱保存待检。
1.3.3 qRT-PCR检测肺组织中miR-34a水平
-80℃取部分肺组织,RNA提取试剂盒提取总RNA、cDNA合成试剂盒合成第一条链cDNA,qRTPCR仪对miR-34a、U6扩增。引物序列miR-34a F:5’-TGGCAGTGTCTTAGCTGGTTG-3’、R:5’-GGCAG TATACTTGCTGATTGCTT-3’;U6 F:5’-CTCGCTTC GGCAGCACA-3’、R:5’-AACGCTTCACGAATTTG CGT-3’。上样体系20μL:cDNA(50 ng/μL)1μL,F/R(10μmol/L)(0.5/0.5)μL,2×Hi SYBR Green QPCR Mix 10μL,ddH2O 8.0μL。反应条件:95℃、5 min;94℃、50 s,55.6℃、40 s,40个循环。2-ΔΔCT法计算肺组织中miR-34a水平。
1.3.4 BALF细胞计数和分类
4℃、1200 r/min离心BALF 10 min,离心后取细胞沉渣,PBS重悬后检测白细胞总数。取部分细胞沉渣,调整浓度后wright染色,计数每200个白细胞中的中性粒细胞、嗜酸性粒细胞、单核-巨噬细胞、淋巴细胞比例。
1.3.5 HE检测肺组织形态
4%多聚甲醛中固定的肺组织,脱水后石蜡包埋,切片(厚度:6μm)。经苏木精染色、伊红复染后显微镜下观察肺组织形态。
1.3.6 ELISA检测血清中IL-6、IL-8、IL-1β、TNF-α水平
心脏血室温静置2 h,3000 r/min室温离心10 min,取血清,ELISA试剂盒检测血清中IL-6、IL-8、IL-1β、TNF-α水平。
1.3.7 Western blot检测肺组织中sirt1蛋白水平
-80℃冰箱中取部分肺组织,冰上研磨并裂解,4℃、16000 r/min离心20 min,上清为总蛋白,凝胶电泳分离蛋白、PVDF膜转膜;5%脱脂奶粉室温封闭2 h;对应加入一抗sirt1、GAPDH,4℃孵育过夜;加入对应二抗,室温孵育2 h。蛋白凝胶成像仪拍照和灰度分析。
1.3.8 双荧光素酶鉴定miR-34a与sirt1的靶向关系
TargetScan查找sirt1 mRNA的3′UTR与miR-34a结合位点。设计合成sirt1的野生型(sirt13′UTR WT)和突变型(sirt13′UTR MUT),分别与miR-34a mimic或miR-34a mimic NC共转染至293 T细胞,双荧光素酶报告基因检测试剂盒检测各组荧光素酶活性。
1.4 统计学方法
采用SPSS 25.0软件进行统计学分析,计量数据均采用平均数±标准差(±s)表示,多组间比较行单因素方差分析,进一步两两比较行SNK-q检验。P<0.05为差异具有统计学意义。
2 结果
2.1 Met对大鼠一般情况影响
实验前,对照组、模型组、Met组、Met+阴性对照组、Met+miR-34a高表达组体重分别为(246.16±8.16)g、(245.76±6.97)g、(246.58±7.43)g、(251.16±7.91)g、(247.33±6.93)g,差异无统计学意义(P>0.05)。实验结束后,对照组、模型组、Met组、Met+阴性对照组、Met+miR-34a高表达组体重分别为(316.15±16.59)g、(271.19±19.45)g、(306.11±11.36)g、(305.91±10.67)g、(284.73±9.73)g,与对照组比,模型组体重降低(P<0.05);与模型组相比,Met组、Met+阴性对照组体重升高(P<0.05);分别与Met组、Met+阴性对照组比,Met+miR-34a高表达组体重降低,差异具有统计学意义(P<0.05)。
对照组大鼠饮食饮水正常,毛发润泽、色泽度好,无口鼻分泌物、无咳嗽现象,且反应敏捷、呼吸平稳;模型组大鼠饮食饮水减少,毛色干枯、缺少光泽,有口鼻分泌物、咳嗽出现,反应迟钝、呼吸急促;Met组和Met+阴性对照组大鼠饮食饮水量相较于模型组增加,口鼻分泌物减少、咳嗽减轻,反应欠敏感,呼吸出现急促现象但不明显;Met+miR-34a高表达组状况介于模型组和Met组之间。
2.2 Met对大鼠肺组织中miR-34a的影响
RNA鉴定结果见图1。对照组、模型组、Met组、Met+阴性对照组、Met+miR-34a高表达组肺组织中miR-34a水平分别为1.01±0.13、2.49±0.06、1.46±0.15、1.84±0.16、2.15±0.21,与对照组比,模型组肺组织中miR-34a水平升高(P<0.05);与模型组比,Met组、Met+阴性对照组肺组织中miR-34a水平降低(P<0.05);分别与Met组、Met+阴性对照组比,Met+miR-34a高表达组肺组织中miR-34a水平升高,差异具有统计学意义(P<0.05)。
图1 5组大鼠肺组织RNA 1%琼脂糖胶凝胶电泳Note.A,Control group.B,Model group.C,Met group.D,Met+agomir NC group.E,Met+miR-34a agomir group.(The same as below)Figure 1 Lung tissue RNA 1% agarose gel electrophoresis of 5 groups of rats
2.3 Met对大鼠BALF中细胞计数的影响
与对照组相比,模型组BALF中白细胞数量,中性粒细胞、嗜酸性粒细胞、淋巴细胞比例升高,单核-巨噬细胞比例降低(P<0.05);与模型组相比,Met组、Met+阴性对照组BALF中白细胞数量,中性粒细胞、嗜酸性粒细胞、淋巴细胞比例降低,单核-巨噬细胞比例升高(P<0.05);分别与Met组、Met+阴性对照组相比,Met+miR-34a高表达组BALF中白细胞数量,中性粒细胞、嗜酸性粒细胞、淋巴细胞比例升高,单核-巨噬细胞比例降低,差异具有统计学意义(P<0.05)。见图2、图3。
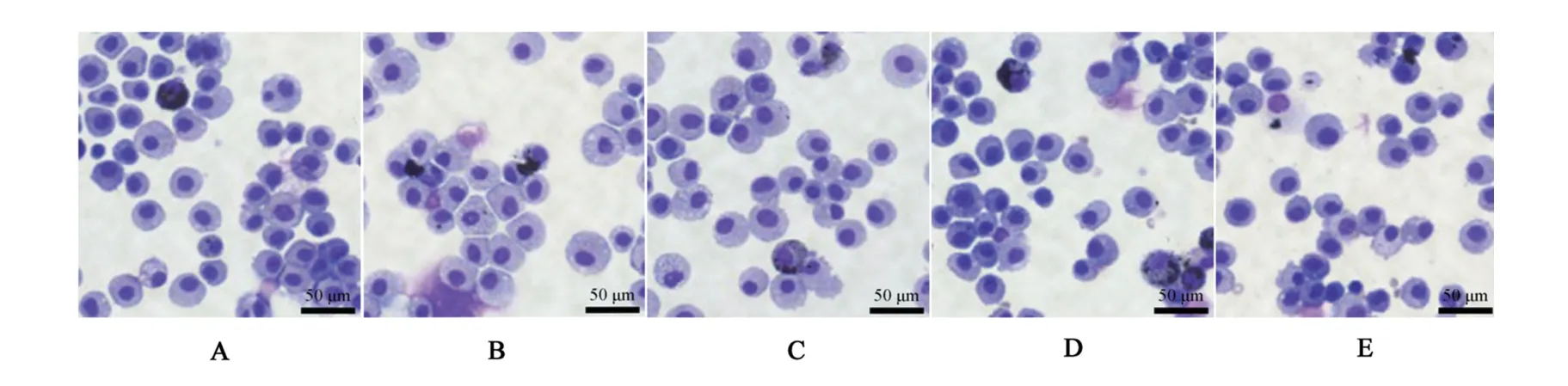
图2 5组大鼠BALF中wright染色结果Figure 2 Wright staining results in BALF of 5 groups of rats
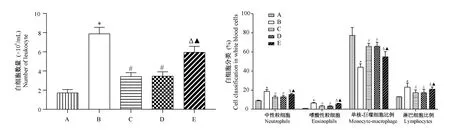
图3 5组大鼠BALF中细胞计数比较Note.Compared with control group,*P<0.05.Compared with model group,#P<0.05.Compared with Met group,△P<0.05.Compared with Met+antagomic NC group,▲P<0.05.Figure 3 Comparison of cell counts in BALF of 5 groups of rats
2.4 Met对大鼠肺组织形态影响
对照组肺组织结构完整,肺泡排列整齐均匀,无明显间隔破坏。模型组大鼠肺组织气管及支气管粘液腺增多,腺管扩张,气道平滑肌肥大,支气管黏膜上皮细胞纤毛粘连,小气道平滑肌增生及纤维化,管腔内可见不同程度粘液栓及大量炎性细胞,肺泡管、肺泡囊、肺泡膨胀,肺泡融合,肺泡简单化,形成肺大泡。Met组与Met+阴性对照组类似,肺泡结构有所缓解,炎症现象不明显;Met+miR-34a高表达组肺泡结构与模型组类似。见图4。

图4 5组大鼠肺组织形态学情况Figure 4 Morphology of the lung tissues of the 5 groups of rats
2.5 Met对大鼠血清中IL-6、IL-8、IL-1β、TNF-α水平的影响
与对照组相比,模型组血清中IL-6、IL-8、IL-1β、TNF-α水平升高(P<0.05);与模型组相比,Met组、Met+阴性对照组血清中IL-6、IL-8、IL-1β、TNF-α水平降低(P<0.05);分别与Met组、Met+阴性对照组相比,Met+miR-34a高表达组血清中IL-6、IL-8、IL-1β、TNF-α水平升高,差异具有统计学意义(P<0.05)。见表1。
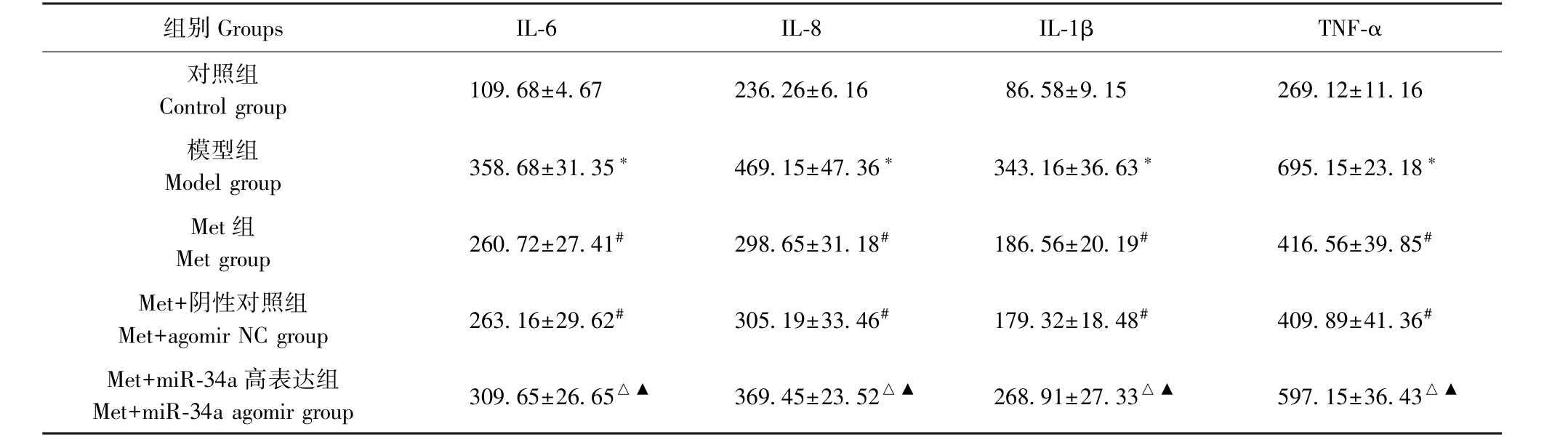
表1 5组大鼠血清中IL-6、IL-8、IL-1β、TNF-α水平比较(pg/mL)Table 1 Comparison of serum levels of IL-6,IL-8,IL-1βand TNF-αin the 5 groups of rats
2.6 Met对大鼠肺组织中sirt1蛋白的影响
对照组、模型组、Met组、Met+阴性对照组、Met+miR-34a高表达组肺组织中sirt1水平分别为1.16±0.21、0.11±0.02、0.86±0.06、0.84±0.08、0.36±0.04,与对照组相比,模型组肺组织中sirt1蛋白水平降低(P<0.05);与模型组相比,Met组、Met+阴性对照组肺组织中sirt1蛋白水平升高(P<0.05);分别与Met组、Met+阴性对照组相比,Met+miR-34a高表达组肺组织中sirt1蛋白水平降低,差异具有统计学意义(P<0.05)。见图5。
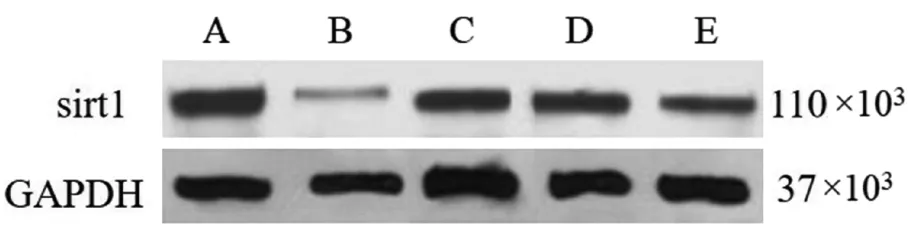
图5 5组大鼠肺组织中sirt1蛋白表达情况Figure 5 Protein expression of sirt1 in the lung tissues of the 5 groups of rats
2.7 双荧光素酶验证miR-34a与sirt1的靶向关系
Targetscan预测结果显示,sirt1基因3′UTR区存在与miR-34a结合位点,见图6。荧光素酶实验验证二者的靶向关系。miR-34a NC+3′UTR-WT、miR-34a mimic+3′UTR-WT、miR-34a NC+3′UTRMUT、miR-34a mimic+3′UTR-MUT的荧光素酶相对活性分别为1.02±0.11、0.43±0.04、0.98±0.08、0.99±0.08,与miR-34a NC+3′UTR-WT组相比,miR-34a+3′UTR-WT组细胞荧光素酶相对活性下降(P<0.05)。
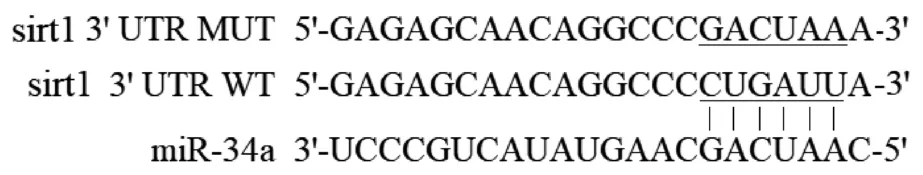
图6 sirt1与miR-34a结合位点预测Figure 6 Prediction of the binding site of sirt1 and miR-34a
3 讨论
COPD会造成大鼠体重减轻、饮食饮水减少,毛色干枯,口鼻中出现分泌物、出现咳嗽等现象,鉴定BALF,发现BALF中白细胞数量,中性粒细胞、嗜酸性粒细胞、淋巴细胞比例升高,单核-巨噬细胞比例降低;提示COPD中出现明显的炎症现象。COPD长期慢性炎症可影响肺实质和周围呼吸道,炎症主要特征为肺泡巨噬细胞、嗜中性粒细胞、T淋巴细胞等淋巴样细胞数量增加,促进分泌多种促炎性介质,包括细胞因子、趋化因子、生长因子和脂质介质的分泌,从而加速DNA损伤、促进细胞衰老,加重疾病[9-10]。而Met具有抗炎作用,在百草枯诱发的急性肺损伤中可降低血浆及肺组织中IL-6、TNF-α水平,并减轻肺组织病理损伤[11]。本研究中使用Met后可缓解肺组织气管及支气管粘液腺增多、炎性细胞过多现象,从而减轻肺泡管、肺泡囊、肺泡膨胀,肺泡逐渐恢复。但具体作用机制尚不清楚。
miRNA可普遍存在于真核细胞中,进化上高度保守,具有组织和时序特异性,在慢性气道炎症性疾病哮喘中参与气道炎症调节,与基质金属蛋白酶、炎症反应、一系列信号通路关系密切,且通过改变miRNA在动物体内的表达水平可改变气道嗜酸性粒细胞、气道黏液分泌、Th1/Th2细胞相关因子的表达情况,从而影响疾病[12]。miR-29b通过靶向溴结构域蛋白4可调节香烟提取物诱导的IL-8表达,从而参与COPD的气道炎症,且血浆miR-29b可以作为COPD疾病严重程度的生物标志物[13]。miR-34包括miR-34a、miR-34b、miR-34c,与肺的发生发展关系密切,与肺支气管发育不良、COPD、肺癌、肺动脉高压等肺部疾病关系密切[14],上调miR-34c-5p可降低动态肺顺应性和降低由于COPD升高引起的呼吸频率及气道阻力以及BALF中IL-8和TNF-α的水平升高现象,从而缓解炎性细胞浸润、肺泡破裂、肺泡腔扩大和胶原纤维沉积增加,平均线性截距增加和平均肺泡数降低现象[15]。在本研究中模型组肺组织中miR-34a水平上调,miR-34a在COPD中表达上调,与肺功能关系密切,可能是肺功能损伤的直接指标[16]。miR-34a与氧化应激损伤、炎症反应关系密切,miR-34a水平升高明显加重机体氧化应激损伤、促进炎症反应[17]。miR-34a需要调控靶基因发挥生物学作用,研究发现,在溃疡性结肠炎中miR-34a水平升高可抑制靶基因sirt1的表达从而加重氧化应激、促进炎症损伤[18]。sirt1被称为长寿基因,在吸烟者体中sirt1水平降低可诱导金属蛋白酶抑制剂-1乙酰化进而加重肺损伤[19]。上调sirt1的表达来减轻香烟烟雾引起的内质网应激和细胞凋亡,从而预防COPD[20-21]。表明在COPD中烟熏可诱导miR-34a上调,促进分泌多种促炎性介质,包括IL-6、IL-8、IL-1β、TNF-α等的分泌从而加重炎症细胞浸润、肺泡破裂、肺泡腔扩大和胶原纤维沉积增加现象,从而加重疾病。而使用Met后炎症因子水平降低,肺泡破裂、肺泡腔扩大现象得以缓解。添加miR-34a逆转Met作用,提示Met可能通过下调miR-34a表达轻炎症水平,实现对COPD大鼠的保护。进一步研究发现,miR-34a与sirt1存在靶向关系,提示Met下调miR-34a的表达,从而促进sirt1的表达,进而减轻因香烟烟雾引起的内质网应激和细胞凋亡,减缓疾病。
综上所述,Met通过下调miR-34a实现对COPD气道炎症的缓解,本文首次验证了COPD中Met与miR-34a的关系。但miR-34a靶基因较多,亦可能影响别的靶基因发挥作用,也将成为进一步研究重点。

