MUC1在HER2阳性乳腺癌发病中的作用及机制研究
王成志,邓华云,庞 智,黄 雷
上海交通大学基础医学院组织胚胎学与遗传发育学系,上海 200025
我国乳腺癌的发病率和死亡率分别位居女性恶性肿瘤的第一位和第五位[1]。在临床上根据雌激素受体(estrogen receptor,ER)、孕 激 素 受 体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2或ERBB2)的表达情况,乳腺癌分为4种不同亚型:Luminal A型(ER或/和PR阳性,HER2阴性)、Luminal B型(ER或/和PR阳性,HER2阳性)、HER2过表达型(ER和PR阴性,HER2阳性)以及三阴性(ER、PR和HER2均为阴性)[2]。其中HER2过表达型占乳腺癌的20%~30%,是由HER2基因扩增等机制而导致HER2受体过表达。由于HER2可与其家族成员其他激酶受体HER1(EGFR)、HER3或HER4形成异源二聚体,激活下游信号通路,使细胞获得快速增殖和侵袭能力,因此HER2过表达型乳腺癌患者具有不良的预后[3]。
靶向HER2的单抗药物和小分子抑制剂已广泛应用于HER2阳性转移性乳腺癌的临床治疗,可显著改善HER2阳性乳腺癌患者的预后[4-5]。人源化单克隆抗体曲妥珠单抗和帕妥珠单抗可结合于HER2细胞外结构域Ⅱ,阻止其形成同源和异源二聚体,其中包括HER2/HER3异源二聚体[6-7],从而阻断HER2信号转导。拉帕替尼是一种口服酪氨酸激酶抑制剂(tyrosinekinaseinhibitor,TKI),通过可逆性地抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)和HER2激酶活性,而用于治疗晚期HER2阳性乳腺癌[8]。尽管如此,仍有约70%的HER2阳性乳腺癌患者对上述治疗出现耐药性[9]。因此,筛选新的生物靶标将为HER2阳性乳腺癌的临床治疗提供指导意义。
黏蛋白1(mucin 1,MUC1)属黏蛋白家族成员,是一种Ⅰ型单次跨膜糖蛋白,主要表达于大多数分泌型上皮细胞的管腔面,呈极性分布。MUC1与上皮细胞分泌产生的其他黏蛋白一起形成生理屏障,保护细胞免受外界损伤、有毒化合物和微生物的侵袭等[10]。MUC1在肿瘤中高表达且失去极性,MUC1的胞外段(又称CA153)在临床上已经作为乳腺癌和胰腺癌的诊断指标,也可作为肿瘤免疫治疗的靶标[11-12]。MUC1的胞内结构域(cytoplasmic domain,CD)高度保守,且含有7个酪氨酸位点,参与生长因子受体和细胞内激酶等信号转导[13]。同时,MUC1可与STAT3、核因子κB(nuclear factor-κB,NF-κB)、p53和β-连环蛋白(β-catenin)等多种转录因子结合,参与靶基因的表达调控[14-15]。由于基因拷贝数的增加和异常的转录调控,MUC1在超过90%的乳腺癌中高表达。MUC1-C端可参与STAT1/3和NF-κB等信号并正反馈促进MUC1在乳腺癌中的表达[16]。
多项研究[17-18]证明,MUC1与HER2存在相互作用并与单抗药物治疗耐药密切相关。但MUC1在HER2阳性乳腺癌发病中的作用未见报道。本研究旨在通过对MUC1在HER2阳性乳腺癌发病中的作用进行研究,揭示MUC1是否促进HER2阳性乳腺癌细胞恶性特征,并初步探讨其机制。
1 材料与方法
1.1 材料
1.1.1 仪器 PCR仪、核酸凝胶成像仪(Bio-Rad,美国),LAS-4000 mini化学发光成像系统(通用,日本),超净工作台、细胞培养箱(Thermo,美国)。
1.1.2 试剂 胶回收试剂盒、质粒抽提试剂盒(MN,德国),Lipo 2000转染试剂(Thermo,美国),DMEM、DMEM/F-12基础培养基(Hyclone,美国),F-12液体培养基(上海源培生物科技股份有限公司),胎牛血清(foetal bovine serum,FBS)(Gibco,美国),胰蛋白酶(苏州新赛美生物科技有限公司),胰岛素、表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长 因 子 (basic fibroblast growth factor, bFGF)(Peprotech,美国)、BSA(Sigma,美国),细胞计数试剂盒8(cell counting kit-8,CCK-8)(同仁,日本),βactin抗体(CST,美国)。
1.1.3 细胞 小鼠HER2阳性永生型乳腺癌上皮细胞MT2由上海交通大学医学院生物化学与分子生物学系吴学峰老师馈赠。MT2细胞中转入诱导表达的质粒pInducer-MUC1,记 为MT2 pInducer-MUC1(MT2/MUC1);MT2细胞中分别转入Vector和MUC1-CD,记为MT2/Vec和MT2/CD。
1.2 实验方法
1.2.1 细胞培养 ①MT2细胞培养基制备:取胰岛素(10 mg/mL)25μL,氢化可的松(1 mg/mL)50μL,EGF(100μg/mL)5μL,庆 大 霉 素(100 mg/mL)25μL,FBS 7.5 mL,F-12培养基补至50 mL。②成球培养基制备:取8%BSA 2.5 mL,bFGF 10μL,EGF(100 μg/mL)10μL,胰 岛 素(25 mg/mL)100μL,B27 1 mL,DMEM/F12培养基补至50 mL,0.22μm滤头过滤后4℃保存。细胞培养在37℃,5%CO2的培养箱中。
1.2.2 稳转细胞株构建 ①质粒构建。将MUC1-HA基因酶切并连接至pENTRTM1A质粒中,构建pENTRTM1AMUC1-HA质粒;pENTRTM1A-MUC1-HA与pInducer-20进行重组反应,构建pInducer-MUC1-HA质粒。经酶切、测序鉴定后,将质粒转染293T细胞,并加入多西环素(doxycycline,DOX)诱导表达,采用蛋白质印迹法(Western blotting)检测蛋白质表达。②病毒包装。将293T细胞铺至10 cm培养皿中,密度以第2日达30%~40%为宜。在1.5 mL EP管中,按密度ρ=0.4 g/L(质粒∶转染试剂)取Lipo 2000 20μL加至250μL opti-MEM中。同时,在另一个1.5 mL EP管中,将pMD2.G质粒1μg、psPAX2质粒3μg、目的质粒4μg加至250μL opti-MEM中,室温静置5 min。两管混合均匀,室温静置20 min后逐滴滴加至培养皿中,37℃、5%CO2培养箱中培养,4~6 h后换液。培养48 h后,用20 mL注射器吸取病毒上清液经0.45μm滤头过滤,分装病毒并保存于-80℃。③病毒感染。MT2细胞接种至6 cm培养皿中,密度以第2日达30%~40%为宜。配制病毒感染体系:取4 mL无双抗的完全培养基、1 mL病毒液和4μL polybrene(终浓度8μg/mL),弃原培养基,加入配制好的病毒液至培养皿中,感染4~6 h后换液,37℃、5%CO2培养箱培养。待细胞长满后按一定比例传代,并加入抗性筛选药物G418(终浓度0.8μg/mL),筛选1周后收集混合克隆细胞检测蛋白表达。
1.2.3 Western blotting 将收集的细胞样品加入NETN150裂解液,用考马斯蓝染色法将蛋白定量;取20μg总蛋白量上样至SDS-PAGE胶进行电泳;电泳结束后,转移SDS-PAGE胶至NC膜或PVDF膜上;转膜结束后,5%脱脂牛奶室温封闭1 h;加入一抗(2%BSA配制),4℃孵育7~9 h或过夜;加入5%牛奶配制的二抗,室温孵育;化学发光成像系统进行显色反应。
1.2.4 细胞计数试剂盒8法检测细胞增殖 细胞接种至96孔板中,设置3复孔,37℃、5%CO2培养;待细胞完全贴壁后,在第0日的孔中加入CCK-8试剂,37℃反应2 h,酶标仪检测吸光度;绘制不同时间细胞的生长曲线。
1.2.5 平板克隆形成实验 细胞接种至6孔板,设置3个复孔,37℃、5%CO2培养10 d;形成肉眼可见的克隆时,终止培养,弃培养液,加入甲醇固定;弃甲醇,加入结晶紫染色,自来水缓慢冲洗去除残留结晶紫,室温晾干;扫描仪扫描成像,计数克隆数,并根据以下公式计算克隆形成率:克隆形成率=克隆数/细胞数×100%。
1.2.6 划痕实验 细胞消化计数后,按2.5×105/孔的密度接种至12孔板中,以第2日细胞密度达到100%为宜;待细胞密度达到100%后,用干净的中枪头沿着直尺在12孔板的孔中央划一道痕;弃去培养基,PBS洗涤3次去除漂浮的细胞,加入无血清培养基,10倍显微镜下拍照(T0);37℃、5%CO2培养24 h后,10倍显微镜下拍照(T1)。采用Image J软件计算划痕平均距离。根据以下公式计算细胞迁移率:细胞迁移率=(宽度T0-宽度T1)/宽度T0×100%。
1.2.7 Transwell迁移实验 用无血清培养基重悬细胞,并加至上室中,37℃、5%CO2培养24 h;吸去小室中残留培养基,转移至甲醇中固定;吸去残留甲醇,转移至结晶紫中染色过夜;用自来水洗去残留染色液,并用棉签擦去上室中未迁移的细胞,室温晾干;10倍镜下选取不同视野拍照,计数迁移的细胞数目,并做统计分析。
1.2.8 肿瘤细胞成球实验 用不含FBS的DMEM/F12培养基重悬细胞,梯度稀释后细胞接种至低吸附的24孔板中,设置3个复孔,37℃,5%CO2培养4~7 d;4倍镜下拍照。以≥50μm为1个球,统计每个孔中球的个数,并做统计分析。
1.2.9 GEPIA数据库基因表达相关性分析 采用GEPIA数据库分析MUC1和HER2的表达水平。使用GEPIA数据库网站(http://gepia2.cancer-pku.cn/)Expression Analysis功能项中的Expression DIY(Box Blot)或Correlation Analysis功能模块,以BRCA(乳腺癌)作为癌症种类,对MUC1和HER2进行相关性分析。采用TCGA数据库分析6-磷酸葡萄糖脱氢酶 (glucose-6-phosphate 1-dehydrogenase,G6PD)的表达水平。对于乳腺癌(BRCA),选择基于1 097例Tumor以及113例Normal样本的RNA-seq counts数据,采用GDC工具下载RNA-seq counts文件。使用DEseq2中的估计色散方法(estimate the dispersion)对数据进行标准化。G6PD基因在癌(1 097例)与癌旁(113例)组织样本的表达差异通过箱式图来表示。纵轴为各个样本表达量的原始数据,横轴为样本类型分类(normal和tumor),每个点代表一个样本。
1.3 统计学分析
实验数据采用GraphPad Prism 6和Adobe Illustrator CS4软件作图,统计分析采用SPSS 20软件。定量数据均以±s表示,两样本间比较采用独立样本t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 MUC1过表达细胞株构建
为了探究MUC1对HER2阳性乳腺癌细胞特性的影响,首先利用MUC1全长或MUC1-CD病毒表达载体感染Her2转基因小鼠的乳腺癌原代细胞MT2,构建MUC1全长诱导表达和MUC1-CD过表达的细胞株。Western blotting结果检测显示,与对照组相比,MUC1诱导表达组(DOX+)中MUC1表达水平明显上调(图1A);MUC1-CD过表达组中也检测到MUC1的表达(图1B)。
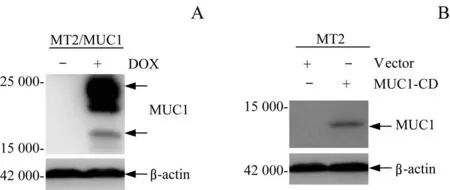
图1 Western blotting检测MUC1的表达Fig 1 Expression of MUC1 was detected by Western blotting
2.2 MUC1促进乳腺癌细胞增殖和克隆形成
为了检测MUC1过表达对MT2乳腺癌细胞增殖的影响,首先通过CCK-8对细胞的增殖能力进行了检测。结果显示,MUC1诱导表达组(DOX+)细胞的生长速度与对照组(DOX-)相比明显增加,且差异具有统计学意义(均P<0.05)(图2A)。与MUC1诱导表达组(DOX+)细胞相同,MUC1-CD过表达组细胞也表现出明显增殖优势,且差异具有统计学意义(均P<0.05)(图2B)。利用平板克隆形成实验进一步检测MUC1的作用,发现过表达MUC1全长(图2C)和MUC1-CD(图2D)后,细胞形成克隆数目明显增多,且差异具有统计学意义(均P<0.05)。这些结果说明,MUC1过表达具有促进乳腺癌细胞增殖和克隆形成的能力。
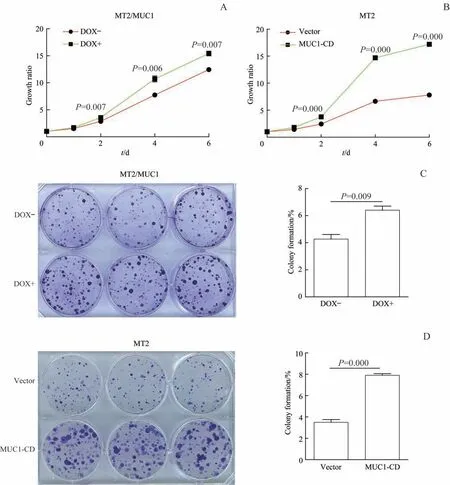
图2 MUC1促进乳腺癌细胞增殖和克隆形成能力Fig 2 MUC1 promotes breast cancer cell proliferation and colony formation ability
2.3 MUC1促进乳腺癌细胞迁移
为了检测MUC1的过表达对乳腺癌细胞的迁移能力的影响,分别进行了划痕实验和Transwell迁移实验。划痕实验结果显示,与对照组相比,不论是MUC1诱导表达组(DOX+)还是MUC1-CD过表达组的细胞迁移率均显著增加(图3A、B)。同时,Transwell迁移实验结果也表明,MUC1诱导表达组(DOX+)和MUC1-CD过表达组中细胞的移行能力增强显著(图3C、D)。上述结果差异均具有统计学意义(均P<0.05)。这些结果说明,MUC1的过表达可促进乳腺癌细胞的迁移能力。
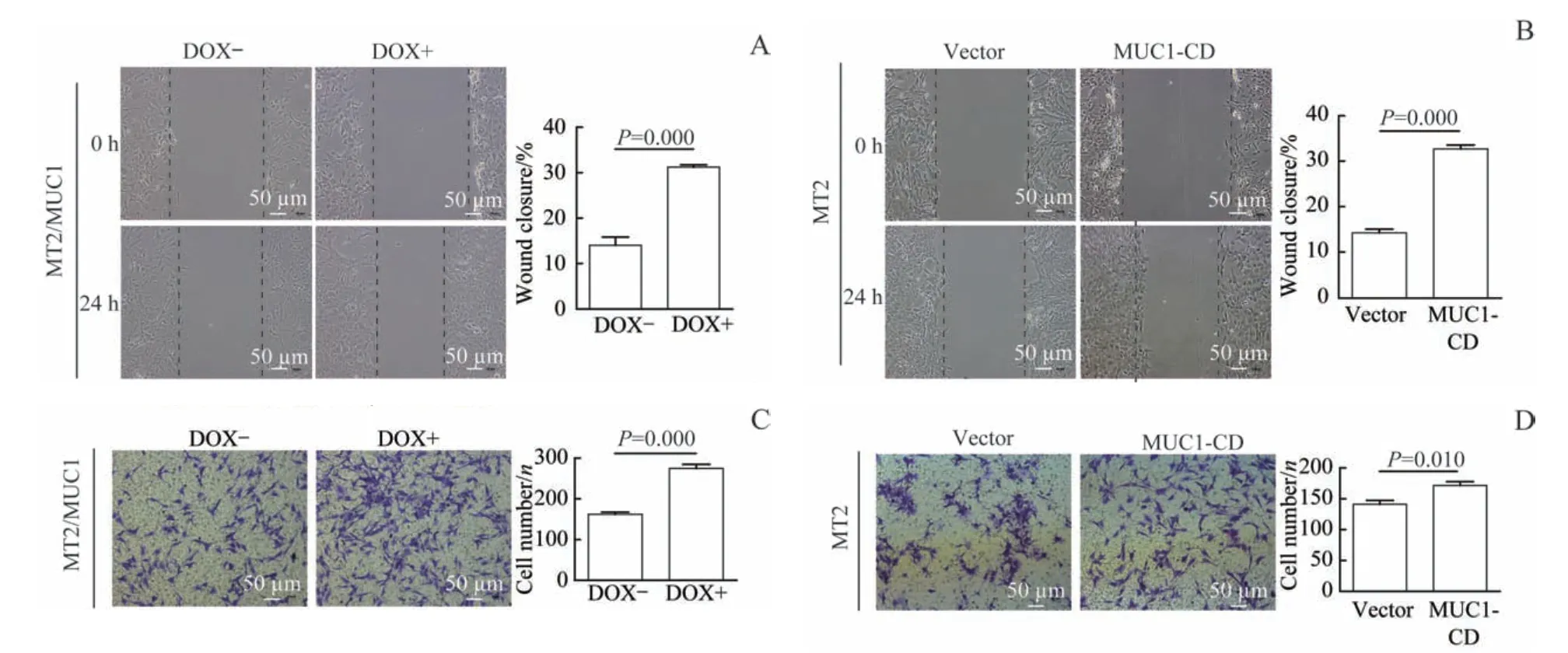
图3 MUC1促进乳腺癌细胞迁移Fig 3 MUC1 promotes breast cancer cell migration
2.4 MUC1增加乳腺癌细胞成球数目
肿瘤细胞中的干细胞或起始细胞是导致肿瘤增殖和耐药的重要原因之一。通过成球实验检测MUC1的过表达对乳腺癌干细胞的影响。实验结果表明,与对照组相比,MUC1全长诱导表达组和MUC1-CD过表达组成球数目增多(图4A、B),差异具有统计学意义。提示MUC1促进乳腺癌细胞的成球能力。
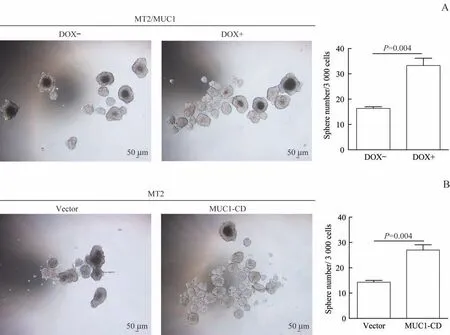
图4 MUC1增加乳腺癌细胞的成球能力Fig 4 MUC1 increases the sphere formation of breast cancer cells
2.5 G6PD参与MUC1诱导的乳腺癌细胞增殖作用
快速增殖是肿瘤细胞共有的特征,磷酸戊糖途径(pentose phosphate pathway,PPP)在细胞增殖过程中为其提供DNA合成所需的原料,而G6PD是PPP途径的第一个限速酶。GEPIA数据库的分析表明,MUC1与HER2(ERBB2),HER2(ERBB2)与G6PD在乳腺癌中具有相关性,但未发现MUC1和G6PD在mRNA水平的相关性(图5A、B)。为了探究G6PD是否参与MUC1对HER2阳性乳腺癌细胞恶性表型的调控作用,利用MT2/MUC1和MT2/MUC1-CD 2个细胞系进行相关研究。Western blotting结果显示,与对照组相比,MT2/MUC1和MT2/MUC1-CD细胞中G6PD的蛋白质表达水平均明显上调(图5C、D)。上述结果表明MUC1过表达可上调HER2阳性乳腺癌细胞中G6PD的蛋白质表达水平。
G6PD的抑制剂6-AN,可以抑制细胞内G6PD的酶活性。为进一步证明G6PD是否参与MUC1诱导的乳腺癌细胞恶性特征形成,利用6-AN抑制剂处理细胞,并检测乳腺癌细胞的增殖情况。CCK-8结果显示,在MUC1诱导过表达组和过表达组中,与对照组相比,加入6-AN后均可显著抑制MUC1全长或MUC1-CD诱导的细胞增殖(图5E、F)。上述结果表明,G6PD蛋白参与MUC1诱导的乳腺癌细胞增殖作用。

图5 G6PD参与MUC1诱导的乳腺癌细胞增殖作用Fig 5 G6PD is involved in the proliferation of breast cancer cellsinduced by MUC1
2.6 G6PD在乳腺癌中高表达且与患者生存期呈负相关
为了深入分析G6PD在乳腺癌样本中的表达情况,分别在GEPIA和TCGA数据库中对HER2、MUC1和G6PD的表达水平进行分析。结果显示,HER2、MUC1和G6PD在乳腺癌中均呈高表达(图6A~C)。同时,通过Kaplan-Meier法对G6PD高表达的乳腺癌的5年生存期分析发现,G6PD高表达患者总生存期(overall survival,OS)和无复发生存期(relapse-free survival,RFS)均下降(图6D、E),差异有统计学意义。数据库分析表明,G6PD在乳腺癌中高表达且与不良预后密切相关。
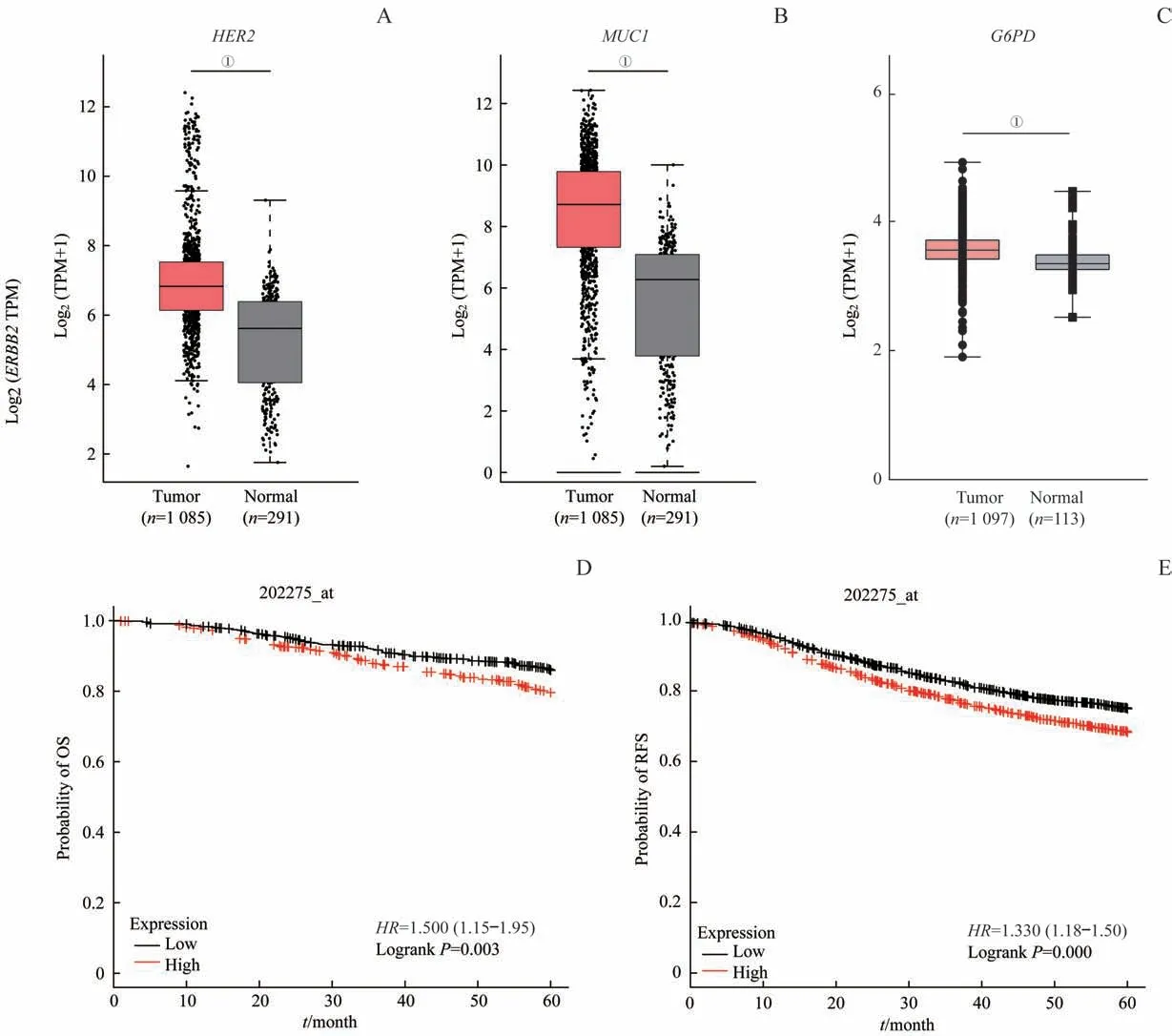
图6 利用数据库分析G6PD表达与生存期的关系Fig 6 Database analysis of the expression of G6PD and survival
3 讨论
研究表明,MUC1可通过胞内段与其他癌基因编码的蛋白,如β-catenin、EGFR以及C末端Src激酶(Cterminal Src kinase,Csk,又称c-Src)等相互作用,参与细胞内信号转导[19-20]。研究[17]证明,MUC1与HER2存在相互作用,并且在HER2单抗药物治疗耐药细胞株中相互作用加强。MUC1过表达可以促进HER2阳性乳腺癌对他莫昔芬的治疗抵抗;相反,MUC1的敲减可显著阻断耐药株中HER2下游信号的激活,并可缓解HER2靶向治疗的耐药情况[17]。这些结果表明MUC1可与HER2相互作用并参与HER2阳性乳腺癌耐药的过程。但在人乳腺癌细胞中MUC1与HER2之间的研究较多,在小鼠细胞中MUC1与HER2的研究较少。本研究发现过表达MUC1可促进小鼠肿瘤细胞的增殖和迁移能力,进一步研究发现过表达MUC1也促进了小鼠肿瘤细胞克隆形成和成球能力。对MUC1作用的功能域进行研究发现,MUC1-CD即可发挥促进肿瘤恶性特征的作用。
快速增殖能力和异常的能量代谢是肿瘤的两大特征。在肿瘤生长过程中,葡萄糖作为主要的能源物质,除了经糖酵解和三羧酸循环途径生成ATP和CO2之外,还存在其他代谢途径,如PPP等。G6PD是调控PPP的关键限速酶。PPP生成的NADPH可为细胞的各种合成反应提供还原剂,如参与脂肪酸和固醇类物质的合成。此外,PPP途径产生的5-磷酸核糖(ribose-5-phosphate,R5P)是细胞内唯一参与核酸生物合成的五碳糖,对于维持细胞内DNA和RNA的水平具有重要作用。G6PD在许多正常代谢组织中高表达,包括肝脏、脂肪组织,以及乳腺和肾上腺[21],肿瘤细胞中也有高水平的表达。核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)在转移性乳腺癌细胞中过表达,并通过促进G6PD和HIF-1α途径上调Notch1的表达,进而促进乳腺癌的增殖转移[22]。G6PD受细胞外刺激和信号通路的调节,这些通路可以调节其表达并通过翻译后修饰调节G6PD活性。酪氨酸激酶Src可直接磷酸化G6PD并诱导细胞转移[23]。在某些细胞类型中,cAMP直接或间接下调G6PD活性。cAMP激活蛋白激酶A(protein kinase A,PKA),可以直接磷酸化G6PD的丝/苏氨酸残基并抑制其活性。NADP+/NADPH比率是该酶的主要调节剂之一。NADPH负调节G6PD的活性,而NADP+是其酶活性和正确构象所必需的[24]。抑制G6PD可降低NADPH的产生,降低GSH的水平,进而降低清除ROS水平的能力,并通过体外ROS介导的损伤增强奥沙利铂诱导的结直肠癌细胞凋亡[25]。也有研究[26]发现,胰腺癌细胞中MUC1的过表达通过增强糖酵解、PPP和核苷酸生物合成降低辐射诱导的细胞毒性和DNA损伤作用。GEPIA数据库分析发现,MUC1与HER2的表达呈正相关,而HER2与G6PD的表达也呈正相关,这提示MUC1与G6PD之间可能也存在相关性。
本研究发现,在MUC1和MUC1-CD过表达的MT2细胞中,G6PD均呈现高表达,提示G6PD可能参与MUC1对肿瘤细胞的增殖、迁移和成球能力的调控。为此,进一步利用G6PD抑制剂6-AN处理细胞,并对肿瘤细胞的恶性特征进行观察。结果表明,MUC1过表达细胞用6-AN处理后可显著降低MUC1过表达引起的细胞增殖,提示G6PD的上调参与了MUC1对肿瘤细胞的增殖、迁移和成瘤能力的促进作用。
为了验证G6PD在乳腺癌中的作用,进一步利用TCGA数据库乳腺癌样本进行分析,结果表明,G6PD在乳腺癌中呈现高表达,与本研究发现相一致。
利用Kaplan-Meier Plotter数据库对G6PD高表达的乳腺癌的5年生存期分析的结果也表明,G6PD高表达患者的总生存期和无复发生存期均下降,这提示G6PD高表达的患者具有不良的预后反应。也有研究[27]发现,MUC1过表达与乳腺癌患者的预后降低、恶性程度增加和癌组织分级增加有关。MUC1和G6PD在乳腺癌中均呈现高表达,说明两者之间可能存在一定的相关性。后续工作还需进一步明确MUC1与G6PD的调控关系及作用机制。数据库分析未发现两者在mRNA水平的相关性,接下来需要通过qPCR作进一步验证。同时,MUC1是否会在蛋白质表达水平对G6PD的稳定性进行调控仍需要深入研究。
总之,本研究发现了MUC1过表达促进小鼠HER2阳性乳腺癌的恶性特征,初步机制研究表明MUC1可能通过调控G6PD的表达而发挥促肿瘤作用,提示抑制PPP可能成为MUC1相关的HER2阳性乳腺癌治疗的靶点。
参·考·文·献
[1] Chen W,Sun K,Zheng R,et al.Cancer incidence and mortality in China,2014[J].Chin JCancer Res,2018,30(1):1-12.
[2] Harbeck N,Gnant M.Breast cancer[J].Lancet,2017,389(10074):1134-1150.
[3] Mitri Z,Constantine T,O′Regan R.The HER2 receptor in breast cancer:pathophysiology,clinical use,and new advances in therapy[J].Chemother Res Pract,2012,2012:743193.
[4] Pernas S,Tolaney SM.HER2-positive breast cancer:new therapeutic frontiers and overcoming resistance[J].Ther Adv Med Oncol,2019,11:1758835919833519.
[5] Loibl S,Gianni L. HER2-positive breast cancer[J]. Lancet,2017,389(10087):2415-2429.
[6] von Minckwitz G,Procter M,de Azambuja E,et al.Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer[J].N Engl J Med,2017,377(2):122-131.
[7] Nemeth BT,Varga ZV,Wu WJ,et al.Trastuzumab cardiotoxicity:from clinical trials to experimental studies[J].Br JPharmacol,2017,174(21):3727-3748.
[8] Nishimura R,Toh U,Tanaka M,et al.Role of HER2-related biomarkers(HER2,p95HER2,HER3,PTEN,and PIK3CA)in the efficacy of lapatinib plus capecitabine in HER2-positive advanced breast cancer refractory to trastuzumab[J].Oncology,2017,93(1):51-61.
[9] Vu T,Claret FX.Trastuzumab:updated mechanisms of action and resistance in breast cancer[J].Front Oncol,2012,2:62.
[10] McAuley JL,Linden SK,Png CW,et al.MUC1 cell surface mucin is a critical element of the mucosal barrier to infection[J].JClin Invest,2007,117(8):2313-2324.
[11] Li X,Xu Y,Zhang L.Serum CA153 as biomarker for cancer and noncancer diseases[J].Prog Mol Biol Transl Sci,2019,162:265-276.
[12] Jiang XT,Tao HQ,Zou SC.Detection of serum tumor markers in the diagnosis and treatment of patients with pancreatic cancer[J].Hepatobiliary Pancreat Dis Int,2004,3(3):464-468.
[13] Nath S,Mukherjee P.MUC1:a multifaceted oncoprotein with a key role in cancer progression[J].Trends Mol Med,2014,20(6):332-342.
[14] Ahmad R,Raina D,Joshi MD,et al.MUC1-C oncoprotein functions as a direct activator of the nuclear factor-κB p65 transcription factor[J].Cancer Res,2009,69(17):7013-7021.
[15] Ahmad R,Rajabi H,Kosugi M,et al.MUC1-C oncoprotein promotes STAT3 activation in an autoinductive regulatory loop[J].Sci Signal,2011,4(160):ra9.
[16] Khodarev N,Ahmad R,Rajabi H,et al.Cooperativity of the MUC1 oncoprotein and STAT1 pathway in poor prognosis human breast cancer[J].Oncogene,2010,29(6):920-929.
[17] Raina D,Uchida Y,Kharbanda A,et al.Targeting the MUC1-C oncoprotein downregulates HER2 activation and abrogates trastuzumab resistance in breast cancer cells[J].Oncogene,2014,33(26):3422-3431.
[18] Kharbanda A,Rajabi H,Jin C,et al.Oncogenic MUC1-C promotes tamoxifen resistance in human breast cancer[J].Mol Cancer Res,2013,11(7):714-723.
[19] Kufe DW.MUC1-C oncoprotein as a target in breast cancer:activation of signaling pathways and therapeutic approaches[J].Oncogene,2013,32(9):1073-1081.
[20] Ren J,Raina D,Chen W,et al.MUC1 oncoprotein functions in activation of fibroblast growth factor receptor signaling[J].Mol Cancer Res,2006,4(11):873-883.
[21] Park J,Rho HK,Kim KH,et al.Overexpression of glucose-6-phosphate dehydrogenase is associated with lipid dysregulation and insulin resistance in obesity[J].Mol Cell Biol,2005,25(12):5146-5157.
[22] Zhang HS,Zhang ZG,Du GY,et al.Nrf2 promotes breast cancer cell migrationviaup-regulation of G6PD/HIF-1α/Notch1 axis[J].J Cell Mol Med,2019,23(5):3451-3463.
[23] Pan S,World CJ,Kovacs CJ,et al.Glucose 6-phosphate dehydrogenase is regulated through c-Src-mediated tyrosine phosphorylation in endothelial cells[J].Arterioscler Thromb Vasc Biol,2009,29(6):895-901.
[24] Au SW,Gover S,Lam VM,et al.Human glucose-6-phosphatedehydrogenase:the crystal structurereveals astructural NADP+molecule and provides insights into enzymedeficiency[J].Structure,2000,8(3):293-303.
[25] Ju HQ,Lu YX,Wu QN,et al.Disrupting G6PD-mediated redox homeostasis enhances chemosensitivity in colorectal cancer[J].Oncogene,2017,36(45):6282-6292.
[26] Gunda V,Souchek J,Abrego J,et al.MUC1-Mediated metabolic alterations regulate response to radiotherapy in pancreatic cancer[J].Clin Cancer Res,2017,23(19):5881-5891.
[27] Jing X,Liang H,Hao C,et al.Overexpression of MUC1 predictspoor prognosis in patients with breast cancer[J].Oncol Rep,2019,41(2):801-810.

