miR-3143对胃癌HS-746T细胞增殖、细胞周期及凋亡的影响
吴 菁,吕志武,蒋志勇,李奎生,刘 芳,黄明沂,肖 瑶
(1.深圳市宝安区福永人民医院消化内科,广东 深圳 518103;2.南方医科大学附属深圳宝安医院消化内科,广东 深圳 518101;3.武汉大学中南医院影像科,湖北 武汉 430071)
胃癌是一种发病率较高的消化系统恶性肿瘤,严重威胁人类的健康及生命安全[1]。近年来随着我国居民饮食结构的改变及幽门螺杆菌感染率的增加,胃癌的发病率逐年升高,且此病患者的发病年龄趋于年轻化。探究胃癌发生的分子机制,对胃癌的诊断和靶向治疗具有重要意义。miRNA是一类非编码RNA序列,广泛分布于真核细胞内,其长度约为23个核苷酸[2]。miRNA主要在转录后水平调节下游靶基因mRNA的稳定性,影响靶基因的表达[3]。近年来随着分子生物学的发展,研究miRNA在胃癌细胞中的作用为胃癌的分子靶向治疗提供了新的方向[4]。miR-3143是一种新发现的miRNA,参与乳腺癌细胞的代谢过程[5]。miR-3143对胃癌细胞功能的影响尚不明确。本文主要是探讨miR-3143对胃癌HS-746T细胞增殖、细胞周期及凋亡的影响。
1 材料与方法
1.1 细胞株与主要试剂
胃癌HS-746T细胞(购于中国科学院上海生科院细胞资源中心),胎牛血清和DMEM培养基(购于美国Gibco公司),miR-NC和miR-3143 mimic(购于广州锐博生物科技有限公司),Lipofectamine 3000转染试剂(购于美国Invitrogen公司),qRT-PCR试剂盒(购于日本TaKaRa公司),细胞周期检测试剂盒和细胞凋亡试剂盒(购于南京凯基生物科技有限公司),一抗GAPDH、TOP2A、Cyclin H和IAPs(购于美国Affinity公司),辣根过氧化物酶标记的二抗(购于武汉博士德生物科技公司)。
1.2 细胞培养和转染
采用含10%(体积分数)胎牛血清的DMEM培养HS-746T细胞,培养条件:温度为37℃,二氧化碳(carbon dioxide,CO2)浓度为5%。取对数生长期的HS-746T细胞接种于24孔板上,根据Lipofectamine 3000转染试剂的说明书对细胞进行转染,分别转染miR-3143 mimic(miR-3143组)和miR-NC(Control组),二者的终浓度均为50 nmol/L,24 h后收集细胞进行后续实验。
1.3 采用qRT-PCR法检测miR-3143和TOP2AmRNA的相对表达量
采用TRIzol(一种新型的总RNA抽提试剂)提取HS-746T细胞总RNA,反转录制备cDNA,以cDNA为模板采用实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,qRT-PCR)法进行扩增检测。根据2-ΔΔCt方法计算miR-3143和TOP2A mRNA的相对表达量。以U6为内参计算miR-3143的相对表达量,以GAPDH为内参计算TOP2A mRNA的相对表达量。miR-3143的上游引物为5’- AAGAAGCGCTTTACAATGTTAT-3’, 下 游 引物 为5’- CAGTGCGTGTCGTGGAGT-3’。U6的 上 游 引物 为5’- GCGCGTCGTGAAGCGTTC-3’,下 游 引 物 为5’- GTGCAGGGTCCGAGGT-3’。TOP2A的 上 游 引 物为5’-TGGCTGTGGTATTGTAGAAAGC-3’,下游引物为5’-TTGGCATCATCGAGTTTGGGA-3’。GAPDH的上游引物为5’-GGAGCGAGATCCCTCCAAAAT-3’,下游引物为5’-GGCTGTTGTCATACTTCTCATGG-3’。
1.4 采用平板细胞克隆形成实验检测HS-746T细胞的增殖活力
将Control组和miR-3143组各1000个HS-746T细胞接种于6孔板上,在培养箱中培养2周左右,直至出现肉眼可见的克隆。弃去上清液,加入多聚甲醛在室温下固定35 min。弃去上清液,加入结晶紫染色液在室温下染色35 min。用流水洗去染液,在室温下干燥,用肉眼观察HS-746T细胞的克隆形成数。
1.5 采用流式细胞技术检测HS-746T细胞的细胞周期和凋亡情况
将Control组和miR-3143组HS-746T细胞消化收集,采用预冷的乙醇溶液(体积分数为70%)固定细胞8 h,加入核糖核酸酶A(RNase A)作用30 min,加入溴化乙锭避光孵育30 min。采用流式细胞仪检测两组HS-746T细胞的周期变化。将Control组和miR-3143组HS-746T细胞消化收集,分别加入异硫氰酸荧光素(fluorescein Isothiocyanate,FITC)标记的Annexin V试剂和溴化乙锭试剂,避光孵育30 min,采用流式细胞仪检测两组HS-746T细胞的凋亡率。
1.6 采用生物信息学技术预测miR-3143的下游靶基因
运用miRNA靶基因预测数据库miRecords和miRGator对miR-3143的下游靶基因进行预测。
1.7 采用Westernblot检测HS-746T细胞中TOP2A蛋白的表达
收集Control组和miR-3143组HS-746T细胞,采用RIPA裂解液(RIPA Lysis Buffer)裂解HS-746T细胞并提取总蛋白,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法分离蛋白质。将分离出的蛋白质电转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%(质量分数)的脱脂牛奶在室温下封闭2 h。在一抗TOP2A(浓度为1:3000)、Cyclin H(浓度为1:1000)、IAPs(浓度为1:1000)、GAPDH(浓度为1:1000)中孵育过夜。洗膜后,加入辣根过氧化物酶标记的二抗(浓度为1:10 000),在室温下孵育1 h。按照超敏发光试剂盒的说明书对蛋白条带进行曝光、显影,测定拓扑异构酶Ⅱα(topoisomeraseⅡalpha,TOP2A)的表达情况。
1.8 观察指标
观察并记录miR-3143细胞的瞬时转染效率、miR-3143对HS-746T细胞增殖能力、细胞周期及细胞凋亡的影响。观察并记录miR-3143与靶基因的靶向关系及上调miR-3143对HS-746T细胞靶基因mRNA、蛋白表达的影响。
1.9 统计学方法
采用SPSS 21.0软件对本研究中的数据进行处理,计量资料用均数±标准差(±s)表示,两组间比较用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 miR-3143细胞的瞬时转染效率
本研究进行qRT-PCR检测的结果显示,Control组和miR-3143组HS-746T细胞中miR-3143的表达水平分别 为(1.07±0.22)和(7.79±1.55),miR-3143组HS-746T细胞中miR-3143的表达水平是Control组的7.28倍,组间相比差异有统计学意义(t=4.30,P<0.01)。这表明本研究进行miR-3143 mimics转染成功。
2.2 miR-3143对HS-746T细胞增殖能力的影响
本研究进行平板细胞克隆形成实验的结果显示,Control组和miR-3143组HS-746T细胞的克隆形成数分别为(175.70±22.29)个和(67.93±16.78)个,组间相比差异有统计学意义(t=3.86,P<0.01)。这表明上调miR-3143的表达能抑制胃癌HS-746T细胞的增殖活性。详见图1。

图1 miR-3143对HS-746T细胞增殖活性的影响
2.3 miR-3143对HS-746T细胞细胞周期的影响
本研究采用流式细胞技术进行检测的结果显示,与Control组相比,miR-3143组G0-G1期的HS-746T细胞更多,S期的HS-746T细胞更少,差异有统计学意义(P<0.01)。这表明上调miR-3143的表达能够将HS-746T细胞阻遏在G0-G1期。详见图2。

图2 miR-3143对HS-746T细胞细胞周期的影响
2.4 miR-3143对HS-746T细胞凋亡的影响
本研究采用流式细胞技术进行检测的结果显示,Control组和miR-3143组HS-746T细胞的凋亡率分别为(9.71±1.69)%和(18.63±2.59)%,组间相比差异有统计学意义(t=2.88,P<0.05)。这表明上调miR-3143的表达能促进HS-746T细胞的凋亡。详见图3。

图3 miR-3143对HS-746T细胞凋亡的影响
2.5 miR-3143与靶基因的靶向关系
运用miRNA靶基因预测数据库miRecords和miRGator预测miR-3143的靶基因可能是TOP2A,互补结合序列详见图4。
2.6 上调miR-3143的表达对HS-746T细胞TOP2AmRNA表达的影响
本研究进行qRT-PCR检测的结果显示,Control组和miR-3143组HS-746T细胞中TOP2A mRNA的表达水平分别为(1.07±0.19)和(0.31±0.05),组间相比差异有统计学意义(t=4.98,P<0.01)。这表明上调miR-3143的表达能显著抑制TOP2A mRNA的表达。
2.7 上调miR-3143的表达对HS-746T细胞TOP2A蛋白表达的影响
本研究进行Western blot检测的结果显示,与Control组相比,miR-3143组HS-746T细胞中TOP2A蛋白的表达明显降低,细胞周期蛋白Cyclin H的表达明显降低,细胞凋亡抑制蛋白IAPs的表达明显降低。详见图5。
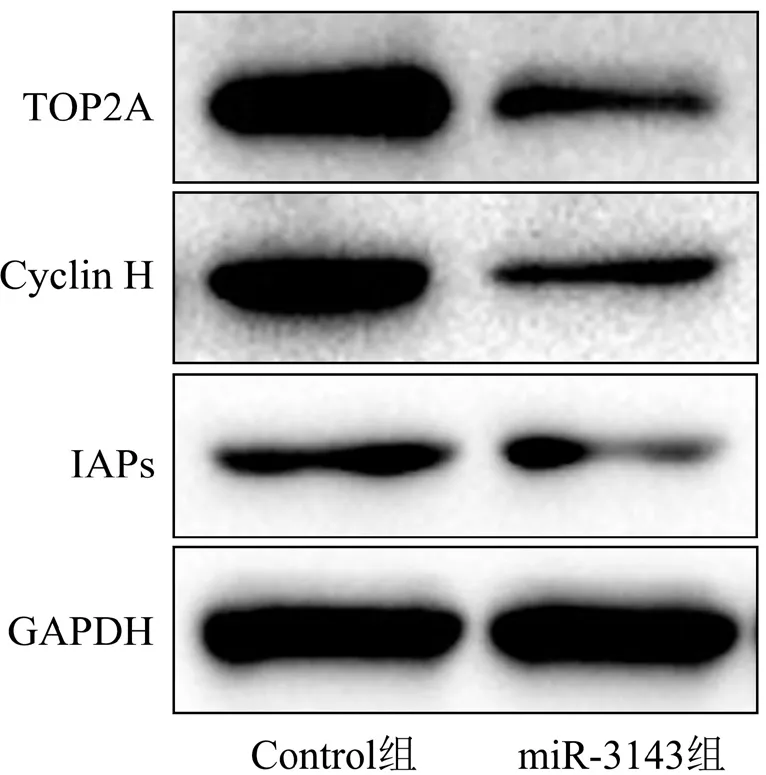
图5 上调miR-3143的表达对TOP2A蛋白表达的影响
3 讨论
近年来的研究发现,在胃癌组织中存在多个异常表达的miRNA,miRNA的异常表达在胃癌发生、发展中的作用日益受到重视[6]。miRNA可作为癌基因或抑癌基因在胃癌细胞的增殖或凋亡中发挥作用。Ding等[7]研究发现,miR-146b-5p在胃癌组织中的表达下调,出现癌细胞淋巴结转移和远处转移的胃癌患者癌组织中miR-146b-5p的表达低于未出现癌细胞淋巴结转移和远处转移的患者,miR-146b-5p过表达可减弱胃癌细胞的增殖和迁移能力。He等[8]研究指出,miR-96-5p在胃癌细胞株和胃癌患者的血清样本中呈高表达,miR-96-5p在体外能显著加快胃癌细胞的生长。miR-3143是一个新发现的miRNA,其可影响乳腺癌细胞的代谢[5]。本研究将miR-3143转染至胃癌HS-746T细胞,结果发现,当miR-3143表达上调后,胃癌HS-746T细胞的克隆形成能力可明显降低,细胞周期进展减慢,细胞的凋亡增加,这表明miR-3143可发挥抑制胃癌HS-746T细胞的作用。miRNA抑制胃癌HS-746T细胞的主要机制是靶向互补结合靶基因mRNA的3’-UTR,促进靶基因mRNA的降解或抑制其翻译为蛋白,从而下调靶基因在细胞中的表达水平[9]。本研究利用miRecords和miRGator数据库预测miR-3143的靶基因可能是TOP2A。TOP2A基因位于17号染色体长臂,TOP2A蛋白可改变DNA的超螺旋结构,调控基因的复制和转录,在细胞周期、增殖、有丝分裂等过程中发挥着重要作用[10]。TOP2A蛋白在肿瘤组织(如前列腺癌组织、乳腺癌组织、胰腺癌组织)中的表达水平明显高于正常组织,其表达水平与患者对化疗的敏感度、预后等存在明显的相关性[11-12]。TOP2A蛋白在胃癌组织中呈高表达,与胃癌的恶性程度有关,下调TOP2A的表达可抑制胃癌细胞的生长和侵袭[13]。
综上所述,上调miR-3143的表达能有效地抑制胃癌HS-746T细胞的增殖活力,调控细胞周期,促进细胞的凋亡,这一作用机制可能与miR-3143能够抑制TOP2A基因的表达有关。miR-3143可能为胃癌提供新的基因治疗靶点。

