类胡萝卜素裂解双加氧酶基因AgCCD4调控芹菜不同组织的着色
王昊,尹莲,刘洁霞,贾丽丽,丁旭,沈迪,冯凯,徐志胜,熊爱生
类胡萝卜素裂解双加氧酶基因调控芹菜不同组织的着色
王昊,尹莲,刘洁霞,贾丽丽,丁旭,沈迪,冯凯,徐志胜,熊爱生
南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室,南京 210095
【】研究类胡萝卜素裂解双加氧酶基因在不同颜色芹菜中的基因型及相对表达量,结合类胡萝卜素含量测定,分析对芹菜组织中类胡萝卜素积累的影响,为进一步研究CCD亚家族基因在不同颜色芹菜组织着色中的作用奠定基础。采用同源比对法检索芹菜基因组中的CCD家族基因。从‘津南实芹’‘黄太极’‘紫杆一号’和‘赛雪’4种不同颜色芹菜中分别克隆获得芹菜类胡萝卜素裂解双加氧酶基因。对芹菜AgCCD4的蛋白氨基酸序列组成、蛋白质理化性质、亲缘关系、空间结构等进行分析,预测其保守结构域和二级结构以及建立三级结构模型。采用荧光定量PCR技术检测在不同颜色芹菜不同组织中的表达水平。采用超高效液相色谱(UPLC)对4种颜色芹菜的叶片、叶柄和根中叶黄素和-胡萝卜素的含量进行测定。采用农杆菌介导的瞬时表达转化法,研究AgCCD4蛋白在烟草表皮细胞中的亚细胞定位。序列分析结果表明包含1个长度为1 779 bp的开放阅读框(ORF),编码592个氨基酸。‘赛雪’中的核苷酸序列与其他品种相比存在18个碱基和9个氨基酸位点的差异,蛋白质相对分子质量分别为65.07 kD和65.12 kD,等电点分别为6.03和5.95。进化树分析表明,芹菜AgCCD4与菊科的向日葵和莴苣CCD4进化关系较近。AgCCD4蛋白的二级结构中包含多个-螺旋和无规则卷曲,三级结构主要以-折叠为主。亚细胞定位分析表明AgCCD4是一个定位在叶绿体上的蛋白。对4种颜色芹菜叶片、叶柄和根中叶黄素和-胡萝卜素的含量进行测定,结果显示芹菜根中均未检测到叶黄素和-胡萝卜素,叶片中叶黄素和-胡萝卜素含量均以‘津南实芹’最高,分别为1 102.58 μg∙g-1DW和241.92 μg∙g-1DW,‘紫杆一号’最低,分别为57.12 μg∙g-1DW和45.65 μg∙g-1DW。在叶柄中,仅在‘黄太极’中检测到-胡萝卜素,叶黄素也只在‘津南实芹’和‘黄太极’中被检测到。荧光定量PCR结果显示,在芹菜叶片中表达量最高,在根中最低。‘紫杆一号’和‘赛雪’叶片中的相对表达量相似,都显著高于‘津南实芹’和‘黄太极’。本研究从4种颜色芹菜中分别克隆得到,其中‘赛雪’的基因序列和其他品种存在差异,其蛋白均含有RPE65保守结构域。表达量在芹菜不同组织中具有显著差异。芹菜中表达量与类胡萝卜素含量呈负相关。植物体中类胡萝卜素的含量和种类影响植株的颜色变化,可能通过降解类胡萝卜素来调控芹菜组织着色。
芹菜;类胡萝卜素裂解双加氧酶基因;亚细胞定位;基因表达;类胡萝卜素
0 引言
【研究意义】植物组织的颜色主要由植物体内的色素种类和含量决定[1]。富含叶绿素的植物呈现绿色。黄酮类物质如花青素,其颜色在植物细胞液呈酸性时偏红色,呈碱性时偏蓝色;花葵素在酸性条件下为橙色,中性条件下为无色,碱性条件下呈蓝色。类胡萝卜素是影响植物组织颜色形成的重要色素,不同种类类胡萝卜素的积累可使植物呈现黄色、橙色和红色等颜色。通过羟化酶途径、双加氧裂解途径和氧化酶途径可降低植物体内类胡萝卜素含量,从而导致植物组织的颜色发生变化[2]。类胡萝卜素(carotenoids)是一类重要天然色素的总称,在动物、高等植物、微生物中普遍存在。除抗氧化作用外,类胡萝卜素还具有免疫调节、抗突变、抑制癌变、维护身体健康以及延缓细胞衰老等生理和药理作用[3]。类胡萝卜素经类胡萝卜素裂解双加氧酶(carotenoid cleavage dixoygenases,CCDs)或非酶作用合成的阿朴类胡萝卜素及其衍生物在植物中可以作为着色剂、植物激素、芳香物质和信号物质[4]。【前人研究进展】CCD酶可以在特定位点裂解氧化类胡萝卜素而形成多种脱辅基类胡萝卜素[5]。拟南芥()AtCCD1可将-阿朴-8'-胡萝卜醛裂解产生-紫罗酮[6];玉米()ZmCCD1可将δ-胡萝卜素裂解产生柠檬醛[7]。CCD家族可分为CCD和9-顺式-环氧类胡萝卜素双加氧酶(nine- epoxycarotenoid dioxygenase,NCED)两个亚家族[8]。NCED主要参与脱落酸的合成,其氧化裂解反应是ABA合成的限速步骤[9]。CCD除了影响植物的花香和花色外,还参与独脚金内酯的合成。植物体内CCD基因家族主要包括CCD1、CCD4、CCD7和CCD8[10]。CCD1蛋白的主要作用是催化类胡萝卜素裂解生成香气物质[11]。CCD7和CCD8主要通过调控合成独脚金内酯来影响植物的生长发育[2]。CCD4可以分解C9-C10及C5-C6双键[12],通过裂解质体中的类胡萝卜素可以改变花瓣和果实的颜色,以及影响香气物质的合成[13]。如菊花()的白色花瓣是由于的特异性表达形成的,抑制的表达量使白色花瓣变为黄色[14]。Campbell等[15]在白色马铃薯()成熟的块茎中发现高表达,利用RNAi技术下调的表达后,白色马铃薯块茎和花瓣呈现黄色。此外,的高表达还可促进植物发育,增强植株抗逆性,如转入番红花()的拟南芥植株根系发育得到促进,且对非生物胁迫的耐受性增强[16]。【本研究切入点】CCD4在植物组织着色和生长发育调控中发挥着重要的作用,但在芹菜()中的相关研究报道较少。且在不同颜色的芹菜品种中,的基因型还未得到鉴定,其表达量和类胡萝卜素积累量之间的关系尚不清楚。在芹菜组织着色中的作用也未见报道。【拟解决的关键问题】本研究分别以‘津南实芹’‘黄太极’‘紫杆一号’和‘赛雪’4种不同颜色的芹菜为材料,分别克隆获得类胡萝卜素裂解双加酶基因,并对AgCCD4蛋白理化性质、二级和三级结构以及系统进化等进行分析。利用荧光定量PCR技术检测在不同颜色芹菜不同组织中的表达,并对植株不同组织中叶黄素和-胡萝卜素的含量进行测定与分析。
1 材料与方法
试验于2020年5月在南京农业大学蔬菜学作物遗传与种质创新国家重点实验室进行。
1.1 试验材料
试验使用材料为‘津南实芹’‘黄太极’‘紫杆一号’和‘赛雪’,种质资源保存于南京农业大学作物遗传与种质创新国家重点实验室。‘津南实芹’由天津市津南区地方品种经过多年提纯选育而成,其颜色为绿色,纤维少,适应性广,耐寒耐热;‘黄太极’为引进国外资源新选育而成,属早熟速生空心黄芹;‘紫杆一号’叶柄为紫色,能耐低温弱光,商品性状好;‘赛雪’为中晚熟品种,植株叶柄直立雪白,叶柄横断面实心(图1)[17-18]。于2020年5月将其种子播种于穴盘中,每品种各15株,种植于人工气候室。播种60 d后对不同品种芹菜的叶片、叶柄和根组织分别取样,用锡纸包裹后立即放入液氮,于-80℃冰箱保存。不同品种的每个组织均取3个生物学重复。
大肠杆菌菌株DH5α、根癌农杆菌GV3101和载体pCAMBIA1301由笔者实验室保存。DNA聚合酶、Prime Script RT reagent Kit试剂盒等均由大连TaKaRa公司生产;荧光定量PCR酶Hieff qPCR SYBR Green Master Mix采购于上海翊圣生物科技有限公司。叶黄素(纯度≥90%)标准品购于上海源叶生物科技有限公司(上海,中国),-胡萝卜素(纯度≥95%)标准品购于和光纯药工业株式会社(大阪,日本)。

a:津南实芹;b:黄太极;c:紫杆一号;d:赛雪a: Jinnan Shiqin; b: Huangtaiji; c: Zigan NO.1; d: Saixue
1.2 AgCCD4的克隆
参照RNA Simple Total RNA Kit试剂盒(北京Tiangen)说明,分别提取‘津南实芹’‘黄太极’‘紫杆一号’和‘赛雪’芹菜样品总RNA,检测RNA浓度后按照Prime Script RT reagent Kit试剂盒说明,将总RNA反转录成cDNA。
基于本课题组芹菜转录组数据库和基因组数据库检索得到芹菜的基因序列[19-21],设计特异性引物进行PCR扩增。正向序列为:5′-ATGGATGCTT TCTCATCTTCTT-3′;反向序列为:5′-TTATAGGTT GTTGAGTTCACT-3′。PCR反应体系为20 μL,包括cDNA、正反向引物各1 μL,双蒸水(ddH2O)7 μL和Prime STAR Max Premix(大连TaKaRa公司)10 μL。反应程序为:98℃预变性10 s;98℃变性10 s,55℃退火10 s,72℃延伸30 s,共35个循环;72℃延伸10 min。PCR扩增产物使用1.2%的琼脂糖凝胶进行电泳检测,回收反应产物连接至载体pCAMBIA 1301并转化至大肠杆菌DH5α中,过夜培养后挑取单菌落,摇混后送至安徽通用生物科技有限公司测序。
1.3 序列生物学分析
运用BioXM 2.6软件进行核苷酸及氨基酸序列分析;利用DNAMAN 6.0软件对芹菜与其他物种的CCD4进行多序列比对;使用BLAST工具,获得目的基因的保守域预测并进行同源性分析;系统进化树通过MEGA 5.2软件绘制而成;利用Prot Scale软件分析蛋白的亲疏水性;通过序列处理在线工具包(SMS)分析芹菜AgCCD4的相对分子质量、氨基酸组成和理论等电点等理化性质;利用NPS@在线网站(https:// npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和网站(http://www.cbs.dtu.dk/services/ CPHmodels/)分别预测芹菜AgCCD4的蛋白二级结构以及建立三级结构模型。利用Plant CARE在线分析网站对启动子进行顺式作用元件分析。
1.4 AgCCD4的表达特性分析
采用Primer Premier 6.0设计荧光定量引物,正向引物为:5′-GGTGCGAATCCAGAGAAGGTTCC-3′,反向引物为:5′-TCACCACCGTATCTCCACCATCTT -3′。使用芹菜作为内参基因[22]。采用实时荧光定量PCR分析该基因在不同颜色芹菜不同组织中的表达情况。反应体系为20 μL,包括正、反引物各0.4 μL,SYBR Green I mix 10 μL,ddH2O 7.2 μL和cDNA 2 μL。反应程序为:95℃预变性5 min,95℃变性10 s,60℃退火延伸30 s,共循环40次。使用Excel软件,依据2-△△Ct方法[23]对的相对表达量进行分析。
1.5 芹菜组织中类胡萝卜素的提取和含量的测定
参考李静文[24]和Ma[25]等的方法,将芹菜叶片、叶柄和根组织经液氮研磨后进行冷冻抽干。称取样品,于避光环境下用丙酮提取类胡萝卜素。提取液经0.45 μm有机系滤头过滤后定容,通过UPLC(超高效液相色谱仪)系统检测类胡萝卜素含量。UPLC检测柱型:UPLC BEH C18(2.1 mm×100 mm,1.7 μm;Waters,美国),检测波长:450 nm,流动相为乙腈﹕甲醇=9﹕1,流速:0.25 mL·min-1,色谱柱温:30℃。设置3个生物学重复。
1.6 AgCCD4的亚细胞定位
设计特异性引物扩增片段,并将其克隆到pSPYE载体中,获得AgCCD4-EGFP重组载体。通过电击转化法将重组质粒AgCCD4-EGFP导入根癌农杆菌GV3101中。将获得的菌株在28℃培养过夜,4 000 r/min离心10 min收集菌株,使用缓冲液(10 mmol∙L-1MES,10 mmol∙L-1MgCl2,150 μmol∙L-1乙酰丁香酮)洗涤并重悬,调节菌液OD600=0.8,将其用注射器渗入一月龄的烟草叶片中进行瞬时表达。5 d后利用激光共聚焦扫描显微镜(Zeiss LSM 780,德国)观察AgCCD4在烟草叶片细胞中的定位[26]。
1.7 数据分析
用Microsoft Excel进行数据录入整理和作图,使用SPSS 20.0进行数据的显著性差异分析。
2 结果
2.1 芹菜AgCCD4的克隆与序列分析
从‘津南实芹’‘黄太极’‘紫杆一号’和‘赛雪’中分别克隆获得,结果表明的开放阅读框长度为1 779bp,编码592个氨基酸。保守域预测结果表明(图2-a),属于RPE65亚家族,为一类包含CCD家族类胡萝卜素裂解氧化酶特殊保守结构域的亚家族[27]。将4个芹菜品种中的核苷酸序列进行比对,结果表明,‘津南实芹’‘黄太极’和‘紫杆一号’中的核苷酸序列(GenBank登录号:MW271039)完全相同,而‘赛雪’中的核苷酸序列(GenBank登录号:MW271040)与其他3个品种相比存在18个碱基位点的差异,导致其编码的氨基酸序列与其他品种相比存在9个位点的差异。差异位点分别为第54位T/G(‘赛雪’/‘津南实芹’,下同),第62位T/C,第120位T/C,第214位T/C,第251位C/G,第291位A/T,第354位G/C,第385位G/A,第390位G/A,第495位T/G,第502位T/A,第507位T/C,第555位A/G,第618位G/A,第627位A/G,第639位C/A,第1500位C/G和第1560位A/G。氨基酸序列差异表现为第18位丝氨酸(Ser)/精氨酸(Arg),第21位亮氨酸(Leu)/脯氨酸(Pro),第57位异亮氨酸(Ile)/苏氨酸(Thr),第72位丝氨酸(Ser)/脯氨酸(Pro),第84位苏氨酸(Thr)/丝氨酸(Ser),第129位缬氨酸(Val)/异亮氨酸(Ile),第168位丝氨酸(Ser)/苏氨酸(Thr),第507位丙氨酸(Ala)/甘氨酸(Gly)和第528位赖氨酸(Lys)/谷氨酸(Glu)。
2.2 芹菜与其他植物CCD4蛋白氨基酸序列的多重比对
利用DNAMAN 6.0软件对芹菜及胡萝卜(;XP_017227382.1)、哥伦比亚锦葵(;XP_021286209.1)、矮牵牛(;QBC36242.1)、烟草(;NP_001312446.1)、枸杞(;AIY62809.1)、黄连木(;XP_031272013.1)、甘薯(;AIZ09098.1)、辣椒(;PHU28865.1)、向日葵(;XP_021977754.1)、欧洲甜樱桃(;XP_ 021809777.1)、银白杨(;XP_034891069.1)、杨梅(;KAB1215613.1)、莴苣(;XP_023751666.1)、山杜鹃(;BBH75251.1)、克莱门柚(;XP_006437482.1)、芜菁(;XP_009132578.1)、盐芥(;XP_006414000.1)、蓖麻(;XP_002519944.1)的CCD4蛋白序列进行比对(图2-b),结果表明,以上植物的CCD4蛋白序列一致性为72.58%,表明CCD4蛋白序列在不同物种间具有高度保守性。
2.3 AgCCD4启动子顺式作用元件分析
除基本作用元件CAAT-box外,启动子中还包含乙烯应答元件ERE和赤霉素响应元件F-box等激素响应相关元件以及非生物胁迫响应相关元件(表1),如厌氧诱导必需顺式作用元件ARE、参与防御和应激反应的顺式作用元件TC-rich repeat、创伤诱导响应元件WUN-motif(图3)。此外,在启动子中还发现了大量光响应元件,包括TCT-motif、GT1-motif、Box 4和ACE,可见光诱导会影响启动子的表达。

表1 AgCCD4启动子区顺式作用元件特性
2.4 系统进化树分析
为了进一步探究CCD4蛋白的进化关系,选取18个物种的CCD4氨基酸序列构建系统进化树进行分析。结果表明,芹菜与菊科的向日葵和莴苣进化关系较近,而与杨柳科的银白杨和漆树科的黄连木进化关系较远(图4)。
2.5 AgCCD4氨基酸的理化性质和亲/疏水性分析
‘赛雪’中AgCCD4的理论相对分子量为65.07 kD,理论等电点为6.03,‘津南实芹’‘黄太极’和‘紫杆一号’中AgCCD4的理论相对分子量为65.12 kD,理论等电点为5.95(表2)。芹菜和其他18种植物CCD4的氨基酸数目均在588—623,酸性氨基酸和碱性氨基酸的占比均约为12%。脂肪族氨基酸比例也在19%—21%,而芳香族氨基酸比例较低,约为9%。不同植物中CCD4蛋白的总平均疏水性均为负值,表明在不同物种内编码的氨基酸理化性质相似。
利用Prot Scale 软件获得蛋白质亲疏水性图(图5),结果表明芹菜中AgCCD4蛋白为亲水性蛋白,其中亲水性最强的位置为第500位的天冬氨酸(Asp),疏水性最强的位置为第413位的缬氨酸(Val)。
2.6 芹菜AgCCD4蛋白二级与三级结构的预测及分析
‘赛雪’中AgCCD4蛋白二级结构包括79个-螺旋(13.34%)、34个-折叠(5.74%)、128个延伸主链(21.62%)和351个无规则卷曲(59.29%)。‘津南实芹’‘黄太极’和‘紫杆一号’中AgCCD4蛋白二级结构由88个-螺旋(14.86%)、26个-折叠(4.39%)、126个延伸主链(21.28%)和352个无规则卷曲(59.46%)组成。
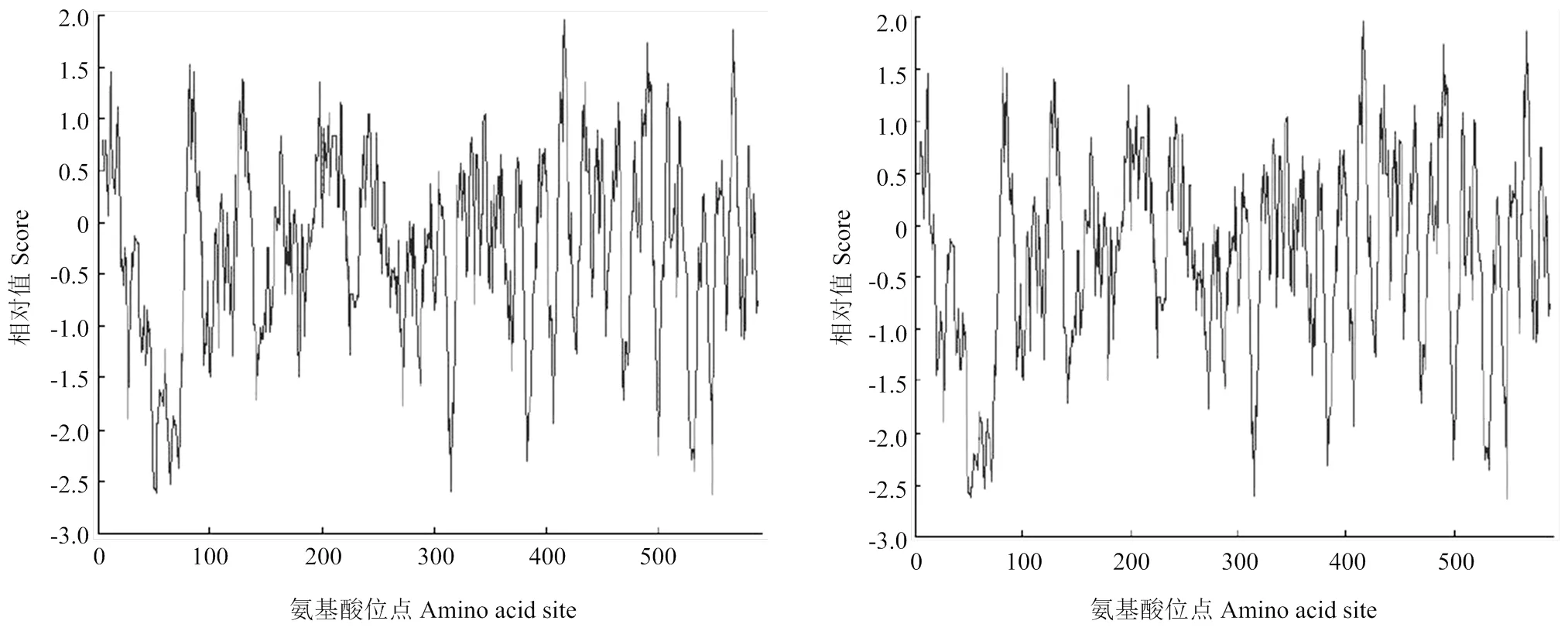
图5 ‘赛雪’和‘津南实芹’AgCCD4氨基酸序列亲水性/疏水性分析
三级结构模型(图6)分析显示,‘津南实芹’‘黄太极’‘紫杆一号’和‘赛雪’中AgCCD4蛋白的三级结构中均包含2个-螺旋,而-折叠的数目有差异。‘赛雪’中AgCCD4包含37个-折叠,而其他3个品种中AgCCD4蛋白-折叠的数量为36个。在含有高类胡萝卜素的胡萝卜中,CCD4蛋白包含38个-折叠、2个-螺旋。在类胡萝卜素含量较低的香蕉(;AMS36849.1)中,CCD4包含40个-折叠和3个-螺旋。结合CCD4的保守结构域分析,除香蕉CCD4蛋白中有一个-螺旋不在保守结构域内外,其他物种中CCD4的-螺旋和-折叠都在保守结构域内。不同物种间CCD4蛋白中-折叠的数量可能影响了蛋白的活性位点,导致对底物的裂解能力不同,进而引起类胡萝卜素含量的差异。

表2 芹菜与其他植物CCD4蛋白氨基酸组成成分及理化性质分析
2.7 芹菜AgCCD4亚细胞定位
采用农杆菌介导的瞬时表达转化方法,进一步研究了绿色荧光蛋白(EGFP)标记的AgCCD4蛋白在烟草叶片表皮细胞中的定位。在瞬时表达AgCCD4-EGFP融合蛋白的烟草叶片叶绿体中,检测到明显的GFP荧光,表明AgCCD4蛋白定位于叶绿体上(图7)。
2.8 芹菜中叶黄素和β-胡萝卜素的含量测定
通过UPLC分别测定4种颜色芹菜根、叶柄和叶片中的类胡萝卜素含量,结果显示芹菜中检测到叶黄素和-胡萝卜素两种类胡萝卜素(图8)。在4种芹菜的根中均未检测到叶黄素和-胡萝卜素。叶片中均含有叶黄素,但含量有显著差异。‘津南实芹’中叶黄素的含量最高,其次为‘赛雪’‘黄太极’和‘紫杆一号’,分别为1 102.58、690.58、450.16和57.12 μg∙g-1DW。叶柄组织中只有‘津南实芹’和‘黄太极’检测到叶黄素,二者中‘津南实芹’叶黄素含量显著高于‘黄太极’,但都显著低于同一品种叶片中叶黄素的积累量(图8-A)。由-胡萝卜素含量分析可知,只在‘津南实芹’的叶柄中检测到241.92 μg∙g-1DW的-胡萝卜素,显著低于叶片中-胡萝卜素的含量。而在叶片组织中,‘津南实芹’-胡萝卜素含量显著高于其他3种芹菜,为504.37 μg∙g-1DW,‘黄太极’和‘赛雪’中-胡萝卜素含量无显著差异,‘紫杆一号’中-胡萝卜素含量最低,仅45.65 μg∙g-1DW(图8-B)。

图6 芹菜(a, b)、胡萝卜(c)和香蕉(d)CCD4蛋白三级结构
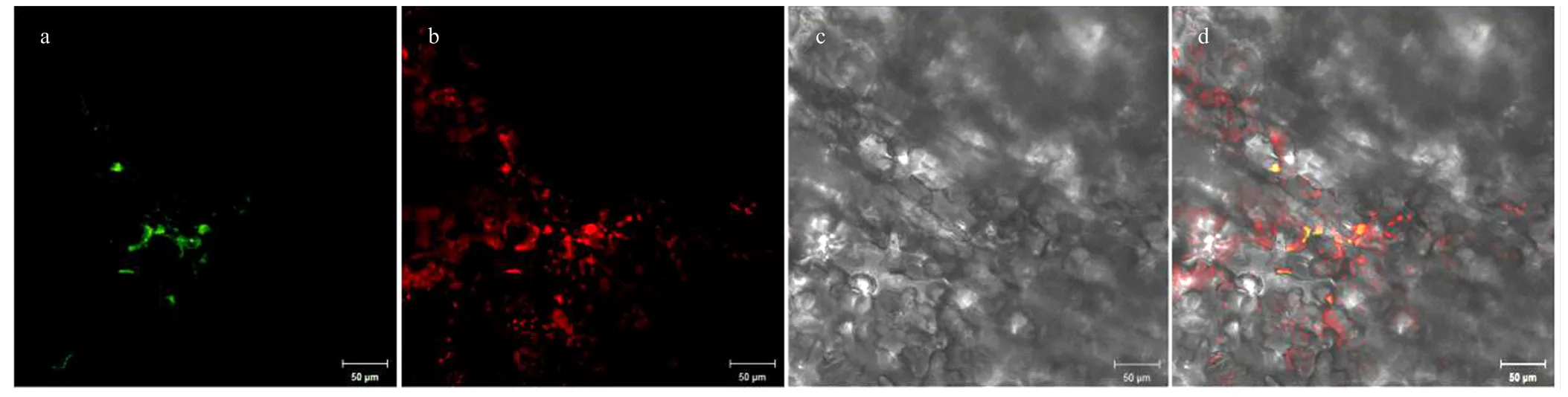
a:GFP荧光;b:叶绿体;c:明场;d:叠加场 a: GFP flouorescence; b: Chloroplast; c: Bright field; d: Merged
2.9 芹菜AgCCD4在不同颜色芹菜中不同组织的表达分析
4种芹菜中,的相对表达量均在叶片中最高,叶柄次之,根中最低(图9)。4种芹菜叶柄中的表达量均无显著性差异。在根中,4种芹菜相对表达量虽也无显著差异,但在‘津南实芹’中相对表达量最高,约为‘赛雪’的2.82倍。在4种芹菜叶片组织中的相对表达量差异最大,‘紫杆一号’和‘赛雪’2个品种中的表达量无显著差异,但均显著高于‘津南实芹’和‘黄太极’,为‘津南实芹’的1.72倍,‘黄太极’的1.43倍。‘黄太极’叶片中相对表达量也高于‘津南实芹’,约为其1.2倍。
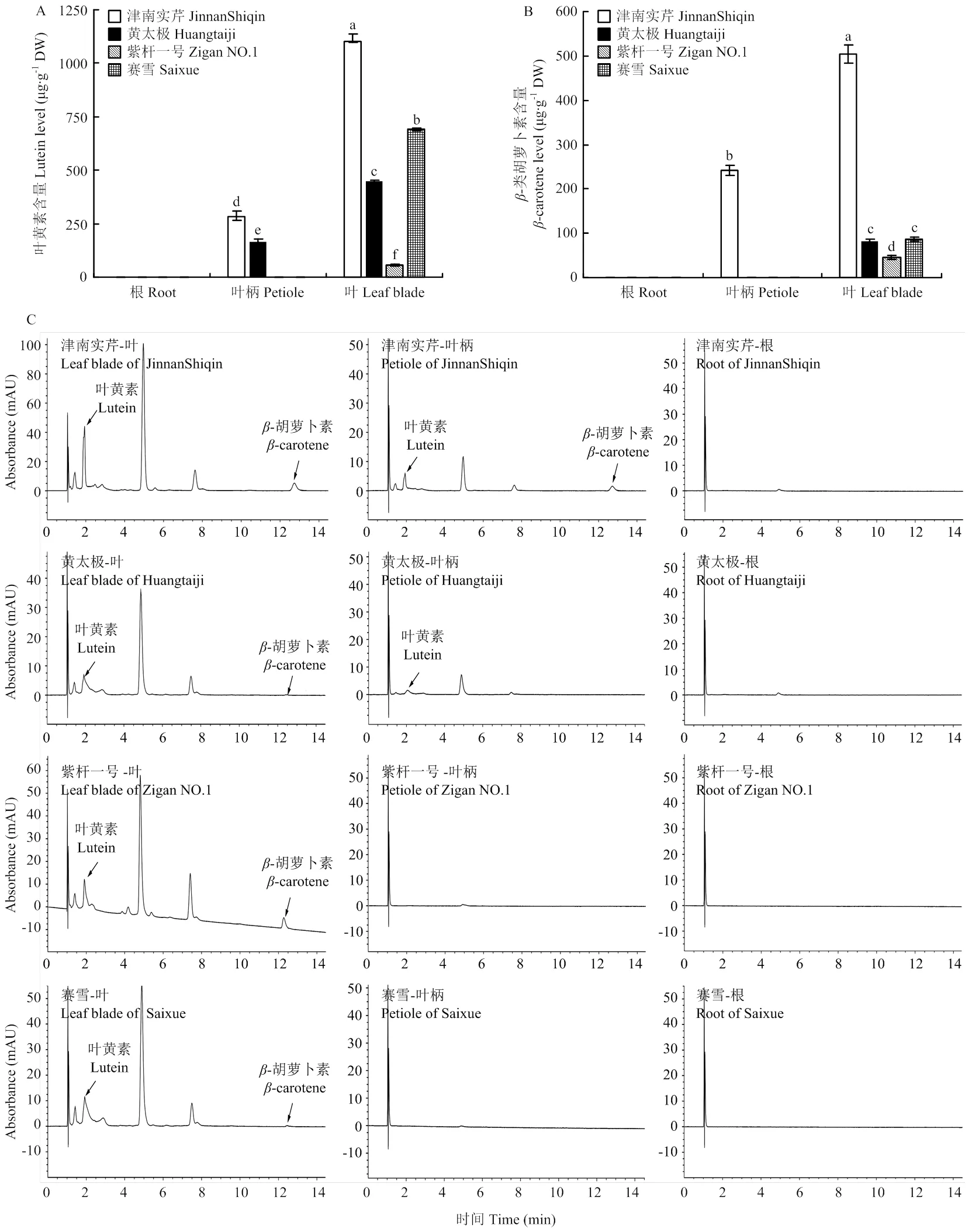
a:叶黄素含量;b:β-胡萝卜素含量;c:UPLC检测的类胡萝卜素含量色谱图

图9 AgCCD4在芹菜叶片、叶柄和根中的表达情况
3 讨论
不同植物中CCD4蛋白编码的氨基酸同源性较高,与其他物种的基因序列长度相似。不同物种中CCD4蛋白三级结构都以-折叠为主,并且都位于基因的保守结构域,只是数量存在差异。‘津南实芹’和‘赛雪’可能由于-折叠数量差异导致蛋白的活性位点不同,进而影响了品种间CCD4蛋白的功能强弱。进化树分析发现与芹菜AgCCD4亲缘关系最近的不是同科植物,这与王赞[28]以及岳远征[29]的研究一致。
类胡萝卜素作为主要的光合色素之一,在植物光收集和免受强光伤害等方面起着重要作用。因此,很多参与类胡萝卜素代谢的关键酶都在叶绿体等质体中发挥作用。编码八氢番茄红素脱氢酶的基因沉默时,叶绿体失去了这种酶的保护作用,导致叶绿素降解,出现光漂白现象[30]。类胡萝卜素裂解双加氧酶作为类胡萝卜素裂解途径中的重要一员,其与叶绿体也有非常密切的联系。小麦()[31]和栀子()[32]编码的蛋白N-端均含有一个叶绿体定位的信号肽。在拟南芥突变体的叶绿体衰老过程中,类胡萝卜素会在植物的质体小球中积累[33]。研究表明CCD家族基因定位在细胞质和质体上[34],本研究通过农杆菌介导的烟草叶片瞬时表达方法证明芹菜AgCCD4定位于叶绿体中。
高等植物的颜色主要受卟啉类、类黄酮类和类胡萝卜素3类物质影响[35],园艺作物成熟常常伴随着类胡萝卜素的偏好性积累,类胡萝卜素种类和含量与园艺植物中水果、蔬菜品质和花卉观赏价值密切相关[36]。植物色素形成具有复杂的分子机制,往往需要多个基因的调控,每个基因的改变都会导致色素含量改变,从而使植物颜色发生变化。辣椒被沉默时,植株叶绿素含量显著下降,果实颜色由绿色变为红色[37]。蝴蝶兰()在矮牵牛花瓣端的高表达增加了二氢杨梅素和飞燕草素的含量,使花瓣颜色从粉红色变为更深的粉红色[38]。在烟草中过量表达激活了与花青素生物合成相关的内源结构基因的表达,提高了烟叶中花青素的浓度,叶片颜色由绿色变为紫红色[39]。CCD可以降低植物体内类胡萝卜素含量,从而影响植物颜色。桃子()中差异表达,黄色突变体中类胡萝卜素含量明显高于对照[40]。根据在白色杜鹃花()及其子代中的表达水平在所有发育阶段均显著高于黄色杜鹃花这一结果推断,的高表达水平是导致子代类胡萝卜素含量降低的主要因素[41]。芹菜依照叶柄颜色的不同,可分为红芹菜、白芹菜、绿芹菜、黄芹菜和紫芹菜等[42]。本研究以‘津南实芹’‘黄太极’‘紫杆一号’和‘赛雪’为材料,通过测定分析类胡萝卜素含量,发现4种芹菜中只在‘津南实芹’和‘黄太极’的叶柄中检测到叶黄素,而在叶柄中-胡萝卜素仅出现在‘津南实芹’中。‘赛雪’和‘紫杆一号’叶柄中没有检测到叶黄素和-胡萝卜素,推测可能是被裂解氧化为其他物质,导致叶柄变为白色,但由于紫色芹菜中花青素的积累,所以呈现紫色[43-44]。‘黄太极’叶柄中只检测到叶黄素,可以推测其叶柄颜色的形成受到叶黄素积累的影响。‘津南实芹’叶柄中不仅含有叶黄素,还有-胡萝卜素,推测其颜色可能是由叶黄素和-胡萝卜素共同作用形成。
CCD亚家族各成员作为类胡萝卜素裂解氧化酶的重要一员,其编码的酶在植物中参与香气物质的形成和色彩呈现,同时也参与特殊成分和植物激素的合成,对植物生长发育有重要的作用[4]。研究表明,CCD亚家族基因在植物不同组织和器官中的表达具有差异性,如藏红花仅在柱头中表达[45],柑橘属在叶中高表达,花、果肉、果皮中表达量低[46]。本研究结果显示,4种芹菜在叶片中表达量都显著高于叶柄和根,也呈现明显的组织表达特异性。从芸薹属植物的花色[47]和桃的果肉颜色[48]调控中可以看出,CCD4与植物中的类胡萝卜素积累密切相关,例如桂花()中的表达量与类胡萝卜素的积累呈负相关[49]。在本研究中,叶片类胡萝卜素含量最高的是‘津南实芹’,其叶片是4种芹菜叶片中最绿的,并且叶脉也呈现绿色。类胡萝卜素含量第二高的‘赛雪’,其叶片颜色是4种芹菜中最浅的,叶脉为白色。其次是叶片与绿芹相比明显偏黄的‘黄太极’。类胡萝卜素含量最低的是‘紫杆一号’,叶片颜色介于绿芹和黄芹之间,但其叶脉为紫色,越接近叶柄处颜色越深。‘津南实芹’中表达量最低,‘黄太极’次之,‘紫杆一号’和‘赛雪’的相对表达水平显著高于其他两种芹菜。可见相对表达量越高,其裂解的类胡萝卜素就越多,植株体内类胡萝卜素积累量就越少。而‘赛雪’中叶黄素含量高于‘黄太极’和‘紫杆一号’,可能是因为其的基因序列差异造成对底物叶黄素的降解能力下降。
类胡萝卜素的重要性已经引起人们的重视,对类胡萝卜素降解途径关键酶尤其是裂解双加氧酶的研究也越来越多。在桂花[49]、石蒜()[29]、万寿菊()[50]、番茄()[51]和烟草[52]等植物中都已克隆出CCD亚家族基因,但在芹菜中的相关研究还比较匮乏。本研究对芹菜CCD亚家族关键基因进行了深入的研究和分析,初步探讨其在调控芹菜类胡萝卜素代谢中的作用,将为进一步研究CCD亚家族基因在参与不同芹菜组织色彩形成中的功能、调控机理提供借鉴和帮助。
4 结论
本研究从4种颜色芹菜中分别克隆获得,其编码的蛋白均含有RPE65保守结构域,其中‘赛雪’的基因序列和其他品种存在差异。亚细胞定位显示AgCCD4定位于叶绿体上。表达量在芹菜不同组织中具有显著差异,在叶片中最高,根中最低。芹菜叶片中,‘紫杆一号’的表达量是‘津南实芹’的1.72倍,‘津南实芹’叶黄素和-胡萝卜素含量分别是‘紫杆一号’的19.3和11.0倍。可见表达量和类胡萝卜素含量呈负相关。植物体中类胡萝卜素的含量和种类影响植株的颜色变化,推测可能通过降解类胡萝卜素来调控植株着色,而基因序列的差异可能会影响对类胡萝卜素降解的能力。
[1] 应初衍. 植物着色色素的代谢. 植物生理学通讯, 1985(6): 1-7, 31.
Ying C Y. Metabolism of pigmented pigments in plants. Plant Physiology Communications, 1985(6): 1-7, 31. (in Chinese)
[2] 由淑贞, 杨洪强. 类胡萝卜素裂解双加氧酶及其生理功能. 西北植物学报, 2008, 28(3): 630-637.
YOU S Z, YANG H Q. Carotenoid cleavage dioxygenases and their physiological function. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(3): 630-637. (in Chinese)
[3] TANAKA Y, SASAKI N, OHMIYA A. Biosynthesis of plant pigments: Anthocyanins, betalains and carotenoids. The Plant Journal, 2008, 54(4): 733-749.
[4] 刘玉成, 张超, 董彬, 赵宏波. 高等植物CCD亚家族基因研究进展. 农业生物技术学报, 2019, 27(4): 720-734.
LIU Y C, ZHANG C, DONG B, ZHAO H B. Advances of CCD subfamily in higher plants. Journal of Agricultural Biotechnology, 2019, 27(4): 720-734. (in Chinese)
[5] 韦艳萍, 庞欣, 刘云飞, 李志邈, 叶青静, 王荣青, 阮美颖, 姚祝平, 周国治, 杨悦俭, 万红建. 植物类胡萝卜素裂解氧化酶研究进展. 核农学报, 2014, 28(11): 2071-2078.
WEI Y P, PANG X, LIU Y F, LI Z M, YE Q J, WANG R Q, RUAN M Y, YAO Z P, ZHOU G Z, YANG Y J, WAN H J. Research progress of carotenoid cleavage oxygenases in plants. Journal of Nuclear Agricultural Sciences, 2014, 28(11): 2071-2078. (in Chinese)
[6] SCHMIDT H, KURTZER R, EISENREICH W, SCHWAB W. The carotenase AtCCD1 fromis a dioxygenase. The Journal of Biological Chemistry, 2006, 281(15): 9845-9851.
[7] VOGEL J T, TAN B C, MCCARTY D R, KLEE H J. The carotenoid cleavage dioxygenase 1 enzyme has broad substrate specificity, cleaving multiple carotenoids at two different bond positions. The Journal of Biological Chemistry, 2008, 283(17): 11364-11373.
[8] OHMIYA A. Carotenoid cleavage dioxygenases and their apocarotenoid products in plants. Plant Biotechnology, 2009, 26(4): 351-358.
[9] AHRAZEM O, TRAPERO A, GÓMEZ M D, RUBIO-MORAGA A, GÓMEZ-GÓMEZ L. Genomic analysis and gene structure of the plant carotenoid dioxygenase 4 family: a deeper study inand its allies. Genomics, 2010, 96(4): 239-250.
[10] FLOSS D S, WALTER M H. Role of carotenoid cleavage dioxygenase 1 (CCD1) in apocarotenoid biogenesis revisited. Plant Signaling & Behavior, 2009, 4(3): 172-175.
[11] UMEHARA M, HANADA A, YOSHIDA S, AKIYAMA K, ARITE T, KAMIYA N T, MAGOME H, KAMIYA Y, SHIRASU K, YONEYAMA K, KYOZUKA J, YAMAGUCHI S. Inhibition of shoot branching by new terpenoid plant hormones. Nature, 2008, 455(7210): 195-200.
[12] RUBIO A, RAMBLA J L, SANTAELLA M, GÓMEZ M D, ORZAEZ D, GRANELL A, GÓMEZ-GÓMEZ L. Cytosolic and plastoglobule- targeted carotenoid dioxygenases fromare both involved in beta-ionone release. The Journal of Biological Chemistry, 2008, 283(36): 24816-24825.
[13] ROTTET S, DEVILLERS J, GLAUSER G, DOUET V, BESAGNI C, KESSLER F. Identification of plastoglobules as a site of carotenoid cleavage. Frontiers in Plant Science, 2016, 7: 1855.
[14] OHMIYA A, KISHIMOTO S, AIDA R, YOSHIOKA S, SUMITOMO K. Carotenoid cleavage dioxygenase () contributes to white color formation in chrysanthemum petals. Plant Physiology, 2006, 142(3): 1193-1201.
[15] CAMPBELL R, DUCREUX L J M, MORRIS W L, MORRIS J A, SUTTLE J C, RAMSAY G, BRYAN G J, HEDLEY P E, TAYLOR M A. The metabolic and developmental roles of carotenoid cleavage dioxygenase4 from potato. Plant Physiology, 2010, 154(2): 656-664.
[16] BABA S A, JAIN D, ABBAS N, ASHRAF N. Overexpression ofcarotenoid cleavage dioxygenase,, inimparts tolerance to dehydration, salt and oxidative stresses by modulating ROS machinery. Journal of Plant Physiology, 2015, 189: 114-125.
[17] LI M Y, HOU X L, WANG F, TAN G F, XU Z S, XIONG A S. Advances in the research of celery, an important Apiaceae vegetable crop. Critical Reviews in Biotechnology, 2018, 38(2): 172-183.
[18] 沈迪, 陈龙正, 陶建平, 刘洁霞, 冯凯, 尹莲, 徐志胜, 熊爱生. 芹菜bZIP转录因子基因的逆境响应分析. 植物生理学报, 2019, 55(12): 1817-1826.
SHEN D, CHEN L Z, TAO J P, LIU J X, FENG K, YIN L, XU Z S, XIONG A S. Stress response analysis of, a bZIP transcription factor gene, inPlant Physiology Journal, 2019, 55(12): 1817-1826. (in Chinese)
[19] 尹莲, 刘洁霞, 陈龙正, 沈迪, 段奥奇, 冯凯, 徐志胜, 熊爱生. 芹菜的克隆与表达模式分析. 园艺学报, 2020, 47(1): 143-152.
YIN L, LIU J X, CHEN L Z, SHEN D, DUAN A Q, FENG K, XU Z S, XIONG A S. Cloning and expression profiles analysis ofgene in. Acta Horticulturae Sinica, 2020, 47(1): 143-152. (in Chinese)
[20] LI M Y, FENG K, HOU X L, JIANG Q, XIONG A S. The genome sequence of celery (L.), an important leaf vegetable crop rich in apigenin in the Apiaceae family. Horticulture Research, 2020, 7(1): 223-253.
[21] FENG K, HOU X L, LI M Y, JIANG Q, XU Z S, LIU J X, XIONG A S. CeleryDB: A genomic database for celery. Database (Oxford), 2018: bay070.
[22] FENG K, LIU J X, XING G M, SUN S, LI S, DUAN A Q, WANG F, LI M Y, XU Z S, XIONG A S. Selection of appropriate reference genes for RT-qPCR analysis under abiotic stress and hormone treatment in celery. PeerJ, 2019, 7: e7925.
[23] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research, 2001, 29(9): e45.
[24] 李静文, 马静, 却枫, 王枫, 徐志胜, 熊爱生. 芹菜中类胡萝卜素合成相关番茄红素ε–环化酶基因的克隆与表达分析. 园艺学报, 2018, 45(2): 341-350.
LI J W, MA J, QUE F, WANG F, XU Z S, XIONG A S. Cloning and expression profiles analysis of carotenoid biosynthesis related genefrom celery. Acta Horticulturae Sinica, 2018, 45(2): 341-350.(in Chinese)
[25] MA J, XU Z S, TAN G F, WANG F, XIONG A S. Distinct transcription profile of genes involved in carotenoid biosynthesis among six different color carrot (L.) cultivars. Acta Biochimica et Biophysica Sinica, 2017, 49(9): 817-826.
[26] LI T, WANG Y H, HUANG Y, LIU J X, XING G M, SUN S, LI S, XU Z S, XIONG A S. A novel plant protein-disulfide isomerase participates in resistance response against the TYLCV in tomato. Planta, 2020, 252(2): 25.
[27] 刘晓丛, 曾丽, 张邀月, 彭勇政, 陶懿伟, 王梦茹. 万寿菊类胡萝卜素裂解双加氧酶基因的克隆与表达分析. 上海交通大学学报(农业科学版), 2018, 36(2): 1-8, 21.
LIU X C, ZENG L, ZHANG Y Y, PENG Y Z, TAO Y W, WANG M R. Cloning and expression analysis of carotenoid cleavage dioxygenase geneinL. Journal of Shanghai Jiao Tong University (Agricultural Science), 2018, 36(2): 1-8, 21. (in Chinese)
[28] 王赞, 岳川, 曹红利, 郭雅玲. 茶树和基因的克隆和表达分析. 西北植物学报, 2018, 38(9): 1605-1612.
WANG Z, YUE C, CAO H L, GUO Y L. Cloning and expression analysis of CsCCD1 and CsCCD4 gene in tea plant(). Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(9): 1605-1612. (in Chinese)
[29] 岳远征, 王晰, 丁文杰, 李娅, 刘家伟, 王良桂. 长筒石蒜类胡萝卜素裂解双加氧酶基因的克隆与表达. 分子植物育种, 2019, 17(3): 796-802.
YUE Y Z, WANG X, DING W J, LI Y, LIU J W, WANG L G. Cloning and expression of carotenoid cleavage dioxygenase 4 gene () in. Molecular Plant Breeding, 2019, 17(3): 796-802. (in Chinese)
[30] 陶静静. 蜡梅八氢番茄红素脱氢酶基因的克隆与表达分析[D]. 重庆: 西南大学, 2013.
TAO J J. Cloning and expression analysis offromLink [D]. Chongqing: Southwest University, 2013. (in Chinese)
[31] 张朋. 小麦和基因克隆与表达分析[D]. 杨凌: 西北农林科技大学, 2016.
ZHANG P. Cloning and expression ofand
[32] 王晓云, 陈蓉, 张恩慧. 栀子类胡萝卜素剪切双加氧酶基因的克隆与原核表达. 生物技术, 2016, 26(1): 34-41.
WANG X Y, CHEN R, ZHANG E H. Cloning and prokaryotic expression of carotenoid cleavage dioxygenase gene 4 fromjasminoid. Biotechnology, 2016, 26(1): 34-41. (in Chinese)
[33] ROTTET S, DEVILLERS J, GLAUSER G, DOUET V, BESAGNI C, KESSLER F. Identification of plastoglobules as a site of carotenoid cleavage. Frontiers in Plant Science, 2016, 7: 1855.
[34] ZHOU Q Q, LI Q C, LI P,ZHANG S T, LIU C, JIN J J, CAO P J, YANG Y X. Carotenoid cleavage dioxygenases: identification, expression, and evolutionary analysis of this gene family in tobacco. International Journal of Molecular Sciences, 2019, 20(22): 5796.
[35] TANAKA Y, SASAKI N, OHMIYA A. Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids. The Plant Journal, 2008, 54(4): 733-749.
[36] TADMOR Y, KING S, LEVI A, DAVIS A, MEIR A, WASSEMAN B, HIRSCHBERG J, LEWINSOHN E. Comparative fruit colouration in watermelon and tomato. Food Research Internationa, 2005, 38(8): 837-841.
[37] WANG S B, TIAN S L, SHAH S N M, PAN B G, DIAO W P, GONG Z H. Cloning and characterization of thegene related to chlorophyll in pepper (L.) under fruit shade stress. Frontiers in Plant Science, 2015, 6: 850.
[38] QI Y Y, LOU Q A, QUAN Y H, LIU Y L, WANG Y J. Flower-specific expression of theflavonoid 3', 5'-hydoxylase modifies flower color pigmentation inand. Plant Cell, Tissue and Organ Culture (PCTOC), 2013, 115(2): 263-273.
[39] GAO J M, SUN X M, ZONG Y A, YANG S P, WANG L H, LIU B L. Functional MYB transcription factor geneis associated with anthocyanin biosynthesis inL. BMC Plant Biology, 2020, 20(1): 247.
[40] WEN L, WANG Y Q, DENG Q X, HONG M, SHI S, HE S S, HUANG Y, ZHANG H, PAN C P, YANG Z W, CHI Z H, YANG Y M. Identifying a carotenoid cleavage dioxygenase () gene controlling yellow/white fruit flesh color of “piqiutao” (white fruit flesh) and its mutant (yellow fruit flesh). Plant Molecular Biology Reporter, 2020, 38(4): 513-520.
[41] URESHINO K, NAKAYAMA M, MIYAJIMA I. Contribution made by the carotenoid cleavage dioxygenase 4 gene to yellow colour fade inpetals. Euphytica, 2016, 207(2): 401-417.
[42] TAN G F, MA J, ZHANG X Y, XU Z S, XIONG A S. AgFNS overexpression increase apigenin and decrease anthocyanins in petioles of transgenic celery. Plant Science, 2017, 263: 31-38.
[43] FENG K, XU Z S, LIU J X, LI J W, WANG F, XIONG A S. Isolation, purification, and characterization of AgUCGalT1, a galactosyltransferase involved in anthocyanin galactosylation in purple celery (L.). Planta, 2018, 247(6): 1363-1375.
[44] 谭国飞, 王枫, 马静, 张馨月, 熊爱生. 紫色与非紫色芹菜花青素和芹菜素含量及合成基因表达分析. 园艺学报, 2017, 44(7): 1327-1334.
TAN G F, WANG F, MA J, ZHANG X Y, XIONG A S. Analysis of anthocyanin and apigenin contents and the expression profiles of biosynthesis-related genes in the purple and non-purple varieties of celery. Acta Horticulturae Sinica, 2017, 44(7): 1327-1334.(in Chinese)
[45] RUBIO A, RAMBLA J L, SANTAELLA M, GÓMEZ M D, ORZAEZ D, GRANELL A, GÓMEZ-GÓMEZ L. Cytosolic and plastoglobule- targeted carotenoid dioxygenases fromare both involved in beta-ionone release. The Journal of Biological Chemistry, 2008, 283(36): 24816-24825.
[46] ZHENG X J, XIE Z Z, ZHU K J, XU Q A, DENG X X, PAN Z Y. Isolation and characterization of carotenoid cleavage dioxygenase 4 genes from differentspecies. Molecular Genetics and Genomics, 2015, 290(4): 1589-1603.
[47] ZHANG B, LIU C, WANG Y Q, YAO X A, WANG F, WU J S, KING G J, LIU K D. Disruption of a CAROTENOID CLEAVAGE DIOXYGENASE 4 gene converts flower colour from white to yellow inspecies. The New Phytologist, 2015, 206(4): 1513-1526.
[48] BRANDI F, BAR E, MOURGUES F, HORVÁTH G, TURCSI E, GIULIANO G, LIVERANI A, TARTARINI S, LEWINSOHN E, ROSATI C. Study of ‘Redhaven’ peach and its white-fleshed mutant suggests a key role of CCD4 carotenoid dioxygenase in carotenoid and norisoprenoid volatile metabolism. BMC Plant Biology, 2011, 11: 24.
[49] 曾祥玲. 桂花TPS和CCD功能分析及其对花瓣色香形成的影响研究[D]. 武汉: 华中农业大学, 2016.
ZENG X L. Research of TPS and CCD function analysis and their influence on petal color and scent inLour [D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese)
[50] 刘晓丛, 曾丽, 刘国锋, 彭勇政, 陶懿伟, 张邀月, 王梦茹. 万寿菊类胡萝卜素裂解双加氧酶基因. 中国农业科学, 2017, 50(10): 1930-1940.
LIU X C, ZENG L, LIU G F, PENG Y Z, TAO Y W, ZHANG Y Y, WANG M R. Cloning and expression analysis of carotenoid cleavage dioxygenase 1 () gene inL.. Scientia Agricultura Sinica, 2017, 50(10): 1930-1940. (in Chinese)
[51] 田芳, 姚兆群, 陈美秀, 徐瑛, 赵思峰. 番茄独脚金内酯合成关键基因、RNA沉默载体的构建. 湖北农业科学, 2016, 55(21): 5668-5671.
TIAN F, YAO Z Q, CHEN M X, XU Y, ZHAO S F. Construction of strigolactones key genes,of tomato RNA silencing expression vector. Hubei Agricultural Sciences, 2016, 55(21): 5668-5671. (in Chinese)
[52] GAO J P, ZHANG T, XU B X, JIA L, XIAO B G,LIU H, LIU L J, YAN H, XIA Q Y. CRISPR/Cas9-Mediated mutagenesis of carotenoid cleavage dioxygenase 8 () in tobacco affects shoot and root architecture. International Journal of Molecular Sciences, 2018, 19(4): 1062.
The Carotenoid Cleavage Dioxygenases GeneRegulates the Pigmentation of Celery Tissues with Different Colors
WANG Hao, YIN Lian, LIU JieXia, JIA LiLi, Ding Xu, SHEN Di, FENG Kai, XU ZhiSheng, XIONG AiSheng
College of Horticulture, Nanjing Agricultural University/State Key Laboratory of Crop Genetics and Germplasm Enhancement/Key Laboratory of Biology and Germplasm Enhancement of Horticultural Crops in East China, Ministry of Agriculture and Rural Affairs, Nanjing 210095
【】The genotype and relative expression level of carotenoid cleavage dioxygenases genegene on carotenoids accumulation in celery tissues were preliminarily analyzed combined with the corresponding carotenoids level, which laid a foundation for further study on the roles of CCD subfamily genes in the pigmentation of different colored celery tissues. 【】The CCD family gene,, was obtained by homology search from genome of celery, and cloned from celery cvs. Jinnan Shiqin, Huangtaiji, Zigan NO.1, and Saixue, respectively. The composition of amino acids, physicochemical properties, genetic relationship, and spatial structure of proteins were analyzed by bioinformatics. The conservative domain and secondary structure were predicted and the tertiary structure model was established. Real-time quantitative PCR (RT-qPCR) was used to detect the expression levels of-carotene of leaf blades, petioles, and roots of celery were determined by ultra-performance liquid chromatography (UPLC). The subcellular localization of AgCCD4 protein in tobacco epidermal cells was performed by using-mediated transient expression system. 【】Sequence analysis results showed thatcontained an open reading frame (ORF) with the length of 1 779 bp, encoding 592 amino acids. A total of 18 nucleotides and 9 amino acids sites ofdiffered in the Saixue and other three celery varieties. The relative molecular weights of AgCCD4 from Saixue and other three celeries were 65.07 and 65.12 kD, and the theoreticalwere 6.03 and 5.95, respectively. Phylogenetic analysis demonstrated that the CCD4 in celery had the closest genetic relationship with sunflower and lettuce from Compositae family. The secondary structure of AgCCD4 contained multiple α helices and random coils, and the tertiary structure was mainly composed ofstrands. Lutein and-carotene were not detected in celery roots. The contents of lutein and-carotene in the leaf blades were the highest in Jinnan Shiqin (1 102.58 μg∙g-1DW and 241.92 μg∙g-1DW, resptectivey), whereas the lowest in Zigan NO.1 (57.12 μg∙g-1DW and 45.65 μg∙g-1DW, respectively). In petioles,-carotene was detected only in Huangtaiji, lutein only existed in Jinnan Shiqin and Huangtaiji. The expression level ofwas highest in celery leaf blades and lowest in roots, respectively. In leaf blades, the relative expression levels of【】In this study,gene was cloned from four celery varieties respectively, while the gene sequence of Saixue was different with other three varieties. AgCCD4 protein contained a RPE65 conserved domain. The expression ofwas remarkably varied in different celery tissues and was negatively correlated with the carotenoids content. The content and types of carotenoids affected the plants’ color, andmight regulate the pigmentation of celery tissues by degrading carotenoids.
; carotenoid cleavage dioxygenasesgene;subcellular localization; gene expression; carotenoids

10.3864/j.issn.0578-1752.2021.15.012
2020-09-09;
2020-12-18
江苏省农业自主创新资金项目(CX(18)2007)、江苏高校优势学科建设项目(PAPD)
王昊,E-mail:2019104071@njau.edu.cn。通信作者熊爱生,E-mail:xiongaisheng@njau.edu.cn
(责任编辑 赵伶俐)

