高效液相色谱法测定番木瓜中的草酸
周 昉,马丽艳,2*
(1.农业农村部农产品质量监督检验测试中心(北京),北京 100083;2.中国农业大学食品科学与营养工程学院,北京 100083)
番木瓜(Carica papayaL.)是番木瓜科(Caricaceae)番木瓜属植物,起源于热带美洲,主产于巴西、墨西哥、印度等国家,我国广东、广西、福建、台湾等地均有栽培[1]。番木瓜营养较高,富含糖类、蛋白质、粗纤维、维生素等多种营养成分,以及钙、磷、钾、铁等无机矿质元素外,还含有番木瓜碱、凝乳酶、木瓜蛋白酶、胡萝卜素等多种活性物质,具有抗炎、抑菌、护肝、降脂、抗癌等药理活性[2-6]。番木瓜除了可加工为木瓜籽油、酒、醋和果汁等外,还因含有大量香气成分而成为高档日化用品的天然香料原料,具有较高的经济价值[2,5,7]。现代医学研究证实,番木瓜的果实、叶、种子(籽)、树皮、根和花等不同部位均有特定的药理功效[8-11]。研究表明,番木瓜不同部位对不同类型癌症具有良好的预防或治疗效果[4-6,12]。
草酸又名乙二酸,是最简单的二元酸,广泛存在于植物源食品、肉类以及真菌中,多以可溶态的草酸钠、草酸钾和难溶态的草酸钙、草酸铁和草酸镁的形式存在。不同科属植物的草酸含量差异很大,同一植物不同部位(如茎、叶和种子)的草酸含量差异也很大。从环境毒理学和食品营养学的角度看,草酸是一种环境毒素和抗营养因子,长期食用草酸含量高的蔬菜、水果容易引发关节炎、低血钙、膀胱结石和肾结石等疾病[13-17]。目前关于水果中草酸含量的报道主要集中在草莓、梨、苹果、桃、橘子、菠萝、枇杷和西瓜中,如朱岩等[18]测定了草莓中草酸的含量,其含量为0.094%~0.153%,张晋芬等[19]、郝蔚霞[20]和郭柏坤等[21]研究了不同水果中草酸的含量,草莓、水晶梨、富士苹果、油桃中分别为1.137 mg/g、0.307 mg/g、0.358 mg/g 和0.242 mg/g[19],橘子和苹果为261.24 mg/kg 和469.07 mg/kg[20],菠萝、枇杷和西瓜为5.693 mg/kg、0.465 mg/kg 和0.182 mg/kg[21]。番木瓜中草酸含量鲜见报道,也没有相关测定标准。为了解番木瓜中草酸的含量,给消费者合理膳食提供参考,建立一个操作简单快速、结果准确、回收率高、检出限低的检测方法十分必要。目前草酸的测定方法主要有滴定法、比色法、原子吸收法、离子色谱法和色谱分析法等[17-26]。传统的滴定法、比色法和原子吸收法存在操作繁琐、耗时、重复性差、灵敏度低、回收率差等缺点,而色谱法灵敏度高、重复性好、操作简便快捷,检测限和回收率等指标均优于传统方法,因此本文建立了一种用高效液相色谱法测定番木瓜中草酸的方法。
1 材料与方法
1.1 材料与试剂
番木瓜,购自超市和农贸市场。
甲醇,色谱纯,购自北京百灵威科技有限公司;辛醇、磷酸、氢氧化钠,色谱纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
Agilent 1260 高效液相色谱仪(紫外检测器),安捷伦科技有限公司;IKA T25 高速组织匀浆机,北京德泉兴业商贸有限公司;MilliQ 超纯水机,北京德泉兴业商贸有限公司;HC-3018 离心机,安徽中科中佳科学仪器有限公司;pH 计,上海精密科学仪器厂。
1.3 提取
称取木瓜鲜样10.00 g(精确到0.01 g)于200 mL 高脚烧杯中,加入70 mL 0.2%磷酸水溶液(以下简称磷酸溶液),并加入1~2 滴辛醇,于8000r/min 下匀浆提取2min,将提取液转入100 mL 容量瓶中,再用20 mL 磷酸溶液少量多次洗涤高脚烧杯,洗涤液全部转入100 mL 容量瓶中,定容,摇匀。取25 mL 处理后的样品液于50 mL 离心管中,9 000 r/min 离心5 min,取上清液待净化。
准确移取5 mL 上清液,用1 mol/L NaOH 溶液调pH至6.0~6.5,转至事先用5 mL 甲醇和5 mL 水预活化的SAX 固相萃取柱中,控制流速在1~2 mL/min,弃去流出液。用5 mL 水淋洗净化柱,再用8 mL、2%磷酸-甲醇溶液洗脱,控制流速在1~2 mL/min,收集洗脱液于100 mL鸡心瓶中,在45 ℃下减压蒸发至近干,用磷酸溶液溶解残渣,转入5 mL 容量瓶中定容,过0.22 μm 滤膜,待测定。
1.4 色谱条件
色谱柱:Waters symmetry C18 柱(4.6 mm×250 mm、5 μm);流动相:A 为0.2%磷酸水溶液;B 为甲醇;梯度洗脱程序为1% B 保持8 min,9 min 变为80% B,保持5 min,15 min 变为1%B,保持15 min;检测波长:210 nm;柱温:30 ℃;流速:0.7 mL/min;进样量:20 μL。
1.5 方法学验证
1.5.1 标准溶液配制
准确称取草酸标准品100.0 mg,加水溶解并定容至100 mL,配置成浓度为1 000 μg/mL 标准储备液。取1 mL标准储备液,用水定容至10 mL,配成浓度为100 μg/mL的标准中间液。准确吸取一定体积的标准中间液,配制成浓度分别为0.5、1.0、2.0、5.0、10.0、20.0、50.0 μg/mL 的标准工作液。
1.5.2 检出限与定量限
对样品溶液稀释,按3 倍信噪比(S/N)和10 倍信噪比(S/N)计算检出限和定量限,并通过添加回收实验确定方法的定量限。
1.5.3 回收率和精密度
称取样品10.00 g,加入草酸的标准溶液,使加标浓度分别为10.0、50.0、100.0 mg/kg,按所建立的方法进行提取、测定,并计算样品的回收率。
1.6 数据处理
所有样品处理至少重复3 次,数据以“平均值±标准差”的形式表示,采用Excel 2013 软件进行统计分析和绘图,并做显著性分析。
2 结果与分析
2.1 番木瓜中草酸提取方法的确定
2.1.1 提取溶液的优化
植物体内的草酸主要以游离态形式存在,通过比较国内外文献,实验选择了水[20]、0.5 mol/L HCl 溶液[17]、80%乙醇水溶液和0.2%磷酸水溶液4 种溶液作为提取溶液进行优化,结果见表1。
从表1 可以看出,以水、0.5 mol/L HCl 溶液、80%乙醇为提取溶剂时,草酸含量无明显差异;以0.2%磷酸水溶液作为提取溶剂时,提取效率最高,因此实验选用0.2%磷酸水溶液作为提取溶剂。
2.1.2 提取方式的优化
以0.2%磷酸水溶液作为提取溶剂,比较了涡旋提取、超声提取、振荡提取、匀浆提取4 种提取方式的提取效果,结果见图1。
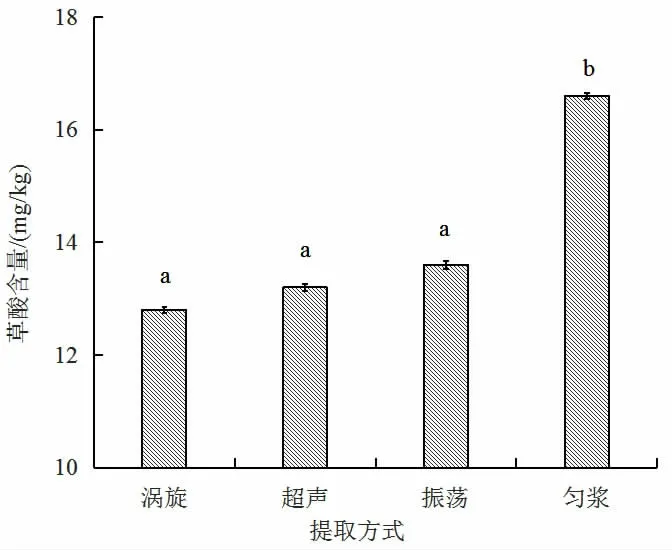
图1 不同提取方式对番木瓜中草酸提取效果的影响Fig.1 Effect of extraction methods on the extraction efficiency of oxalic acid from papaya
如图1 所示,涡旋、超声和振荡三种提取方式的提取效果无明显差异,但均与匀浆提取有明显差异,匀浆提取的效果最高。因此本实验选用匀浆提取作为提取方式,提取时为避免泡沫过多,可在提取前加几滴辛醇。
2.1.3 提取时间的优化
以0.2%磷酸水溶液为提取液,料液比为1∶5,采用匀浆提取方式,比较不同提取时间(1、2、3、4 min)的提取效果,结果见图2。
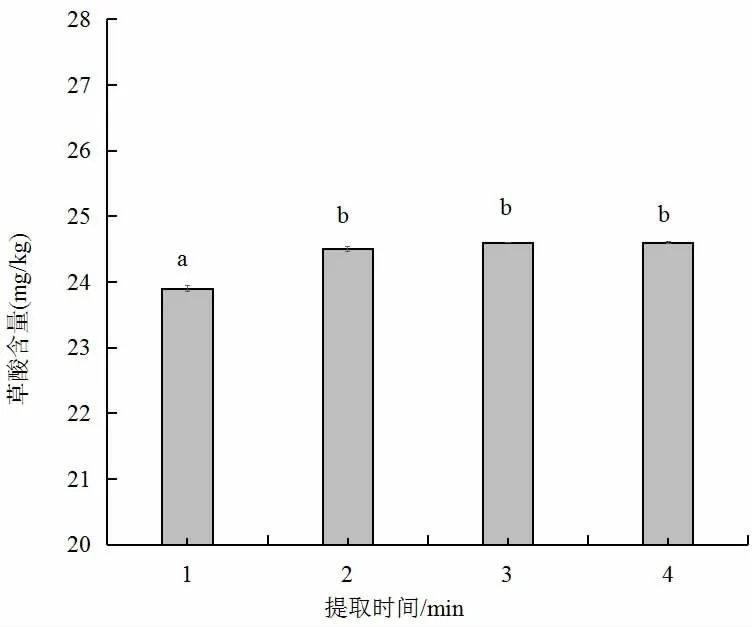
图2 不同提取时间对番木瓜中草酸提取效果的影响Fig.2 Effect of different extraction time on oxalic acid extraction from papaya
如图2 所示,提取1 min 时,草酸的含量最低,与其他提取时间无明显差异,提取时间为2、3、4 min 时,不同时间点的提取效果无明显差异。因此,确定实验提取时间为2 min。
2.1.4 料液比的优化
以0.2%磷酸水溶液为提取液,采用匀浆提取2 min的方式,分别比较了不同料液比(1∶4、1∶5、1∶6、1∶7和1∶8)对番木瓜中草酸提取效率的影响,结果见图3。
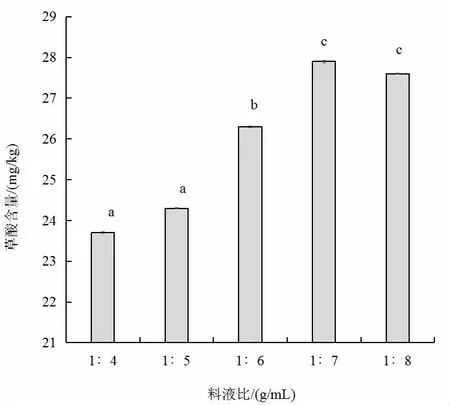
图3 不同料液比对番木瓜中草酸提取效果的影响Fig.3 Effect of liquid-to-solid ratio on oxalic acid extraction from papaya
如图3 所示,当料液比为1∶4、1∶5、1∶6 和1∶7时,随着料液比的增加,样品的提取效率逐渐增加,当料液比提高至1∶8 时,样品提取效率与料液比为1∶7 时稍有减少,表明料液比达到1∶7 就能将样品中的草酸提取完全,洗涤更充分,样品损失更小,因此确定料液比为1∶7。
2.1.5 净化条件的优化
草酸分子的最大吸收波长在紫外区,很多化合物在紫外区有吸收,如样品提取后直接上机分析,会干扰草酸的测定,不能准确积分。为了减少基质对检测的影响,提高草酸的响应值,实验采用固相萃取柱(SPE)进行净化处理。根据草酸的性质,实验选择了强阴离子交换柱SAX,并对SAX 的净化过程进行了优化。
(1)上柱液pH 值的优化
用NaOH 将上柱液的pH 调至3.0~8.0 后进行净化,分析结果见图4。
由图4 可以看出,上柱液pH 值在4.0 和6.0~6.5 左右时草酸的含量较高。SAX 柱为强阴离子交换柱,为使化合物最大程度离子化,样品基质的pH 应该高于该化合物的pKa 至少两个pH 单位。草酸属于二元酸,解离常数分别为pKa1=1.23 和pKa2=4.19,因此在pH 为4.0 和pH 为6.0~6.5 时上样效果最好。为保障草酸分子的充分解离及操作的可行性,实验中上柱液的pH 值控制在6.0~6.5。
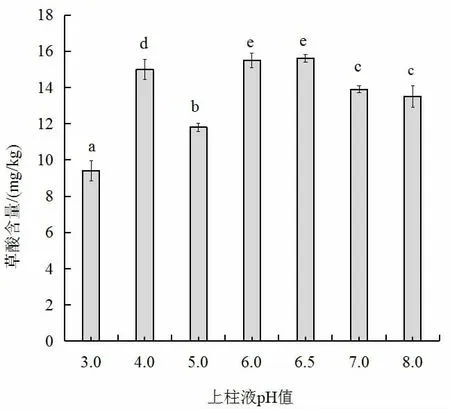
图4 上样液pH 对番木瓜中草酸提取效果的影响Fig.4 Effects of pH of the solution on oxalic acid extraction from papaya
(2)洗脱液的优化
用离子交换柱净化时,洗脱液的pH 对柱回收影响较大。实验用加标回收的方式进行,提取液上柱后,用5 mL水淋洗,再分别以1.5%、1.8%、2.0%、2.2%磷酸-甲醇溶液作为洗脱液洗脱,洗脱体积为10 mL。经对比,2.0%磷酸-甲醇溶液作为洗脱液时回收率最高,因此确定2.0%磷酸-甲醇溶液作为洗脱液。
(3)洗脱体积的优化
用0.2%磷酸提取液配制10 μg/mL 标液草酸标液100 mL,取5 mL 用1 mol/L NaOH 调至pH 6.0~6.5,加入活化后的SAX 柱上,用5 mL 水作淋洗液,以2.0%磷酸-甲醇溶液作为洗脱液,洗脱体积分别为5、6、7、8、9、10 mL,洗脱液旋转蒸发至近干后定容至5 mL,过膜测定,比较洗脱液体积对柱回收的影响,结果见图5。
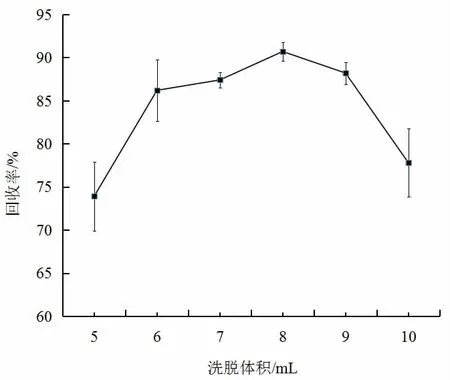
图5 洗脱液体积对回收率的影响Fig.5 Effects of elution volume on recoveries
由图5 可以看出,随着洗脱体积的增加,柱回收先增加再降低,洗脱液用量在6~9 mL 之间时,柱回收率都在85%以上,继续增加到10 mL 时,柱回收率反而明显下降,而在8 mL 时柱回收率最好,因此实验选择用8 mL 2.0%磷酸-甲醇溶液作为洗脱液。提取液经过SAX 柱净化后,明显地降低了基质对样品的干扰(见图6),提高了检测方法的准确性。
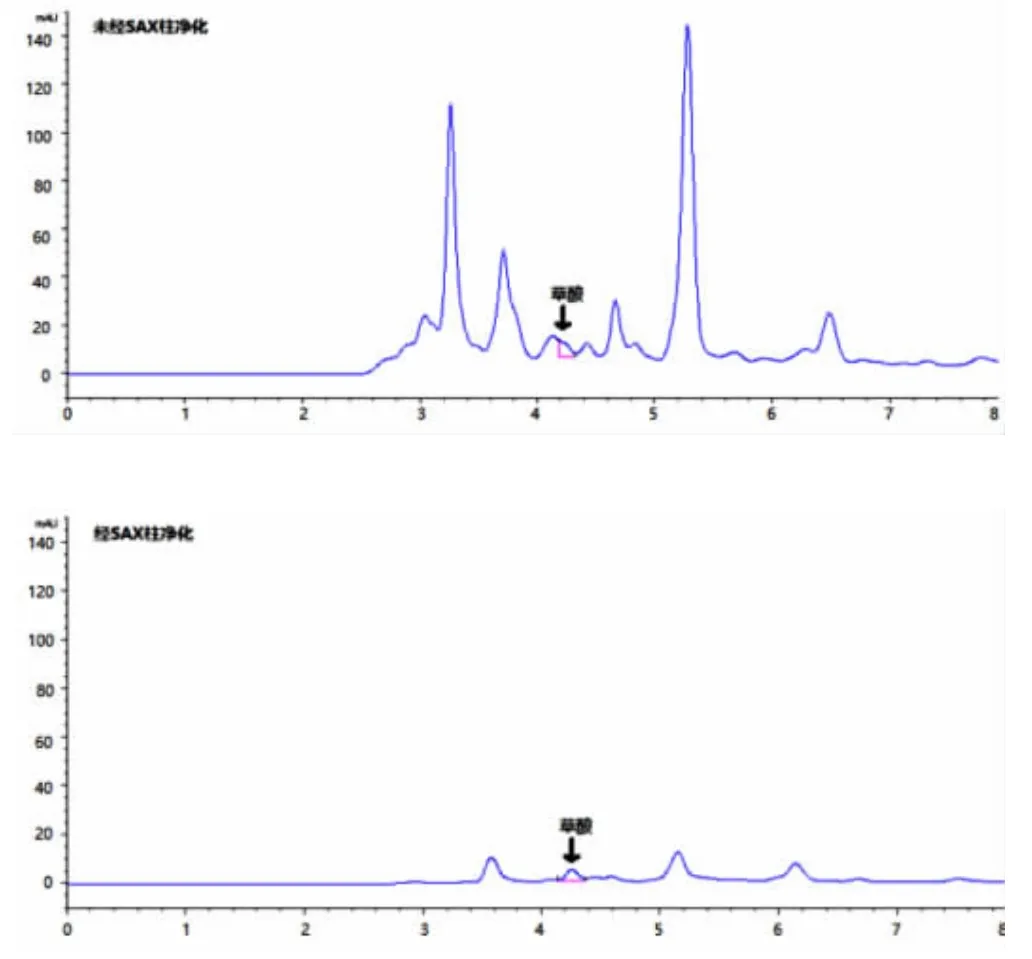
图6 净化前后样品色谱图Fig.6 Chromatograms of samples before and after purification
2.2 色谱条件的优化
2.2.1 检测波长的选择
对浓度为100 μg/mL 的草酸溶液进行紫外光谱扫描,发现最大波长出现在200 nm 处,但是在200 nm 时流动相基线波动较大,影响检测的灵敏度,而把检测波长调整为210 nm 时,基线平稳且草酸响应值高,更利于草酸的检测,因此选择210 nm 作为检测波长。
2.2.2 流动相的选择
实验比较了0.5%KH2PO4-0.5 mmol/L 四丁基硫酸氢铵水溶液、0.2%磷酸二氢铵溶液、0.2%磷酸水溶液三种流动相体系对草酸响应值及分离效果的影响。0.5%KH2PO4-0.5 mmol/L 四丁基硫酸氢铵的水溶液做流动相时,由于引入了离子对试剂,增加了色谱柱平衡时间,同时可能会与色谱柱填料中的基团结合而导致对其他化合物造成影响,且对草酸的分离效果并无明显改善。而用0.2%磷酸水溶液与0.2%磷酸二氢铵溶液为流动相时,分离效果相当,考虑用磷酸配制流动相更为简便,因此选择0.2%磷酸水溶液作为流动相。
2.2.3 流动相pH 值的选择
由于草酸在C18 柱上不易保留,出峰时间极短,实验发现,偏酸性的流动相能够适度增加草酸在色谱柱的保留,延长出峰时间。实验比较了0.1%磷酸水溶液(pH 2.2)、0.2%磷酸水溶液(pH 2.0)、1.0 %磷酸水溶液(pH 1.5)、2.2%磷酸水溶液(pH 1.0)作为流动相时对草酸的分离效果。结果发现,流动相pH 值为2.2 和1.0 时,草酸不能与杂质峰分离;流动相pH 值为1.5 和2.0 时,草酸能从杂质峰中分离出来,其中流动相pH 值为1.5 时分离效果最佳,但考虑到普通C18 柱对酸的耐受pH 值在2.0 以上,长期使用低pH 流动相,色谱柱难以长时间耐受,会缩短色谱柱使用寿命,因此最终选用pH 2.0 的0.2%磷酸水溶液作为流动相,既可以满足草酸分离的要求,又可最大程度对色谱柱进行保护。
2.3 线性范围及检出限
将标准工作液注入高效液相色谱仪中进行分析,以草酸浓度为横坐标,峰面积为纵坐标,绘制标准曲线。结果表明在0.5~50.0 μg/mL 范围内线性良好,线性方程为y=20.349x-8.558 6,R2=0.999 7。以3 倍信噪比计算,草酸的检出限为0.3 mg/kg;以10 倍信噪比计算,草酸的定量限为1.0 mg/kg。
2.4 回收率和精密度
以某一番木瓜样品为空白,分别添加草酸标准溶液,使添加量分别为10.0、50.0、100.0 mg/kg,按实验建立的方法进行提取、测定,番木瓜样品回收率和精密度测定结果见表2(见上页)。从表中可以看出,该方法的回收率为88.6%~90.5%,精密度为3.1%~5.8%。
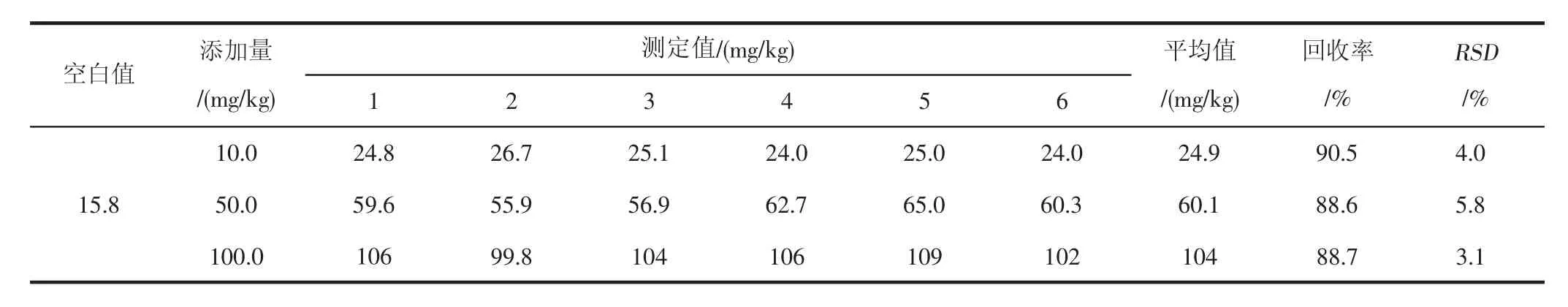
表2 番木瓜样品回收率和精密度(n=6)Table 2 The recovery and precision of papaya samples(n=6)
2.5 番木瓜中草酸含量测定
关于番木瓜中草酸含量的测定目前鲜有报道。实验对购自市场上的12 个番木瓜样品进行了测定,草酸的含量在17.2~69.0 mg/kg 之间,不同番木瓜样品的草酸含量不同,这可能与番木瓜的品种、成熟度及贮藏时间有关。为了解番木瓜不同部位草酸的含量,实验分别选取番木瓜的皮、外层肉(从皮内侧到距皮1.5 cm 处果肉)、内层肉(从距皮1.5 cm 至果核内部的果肉)和籽等4 个部位进行了测定,结果见表3。
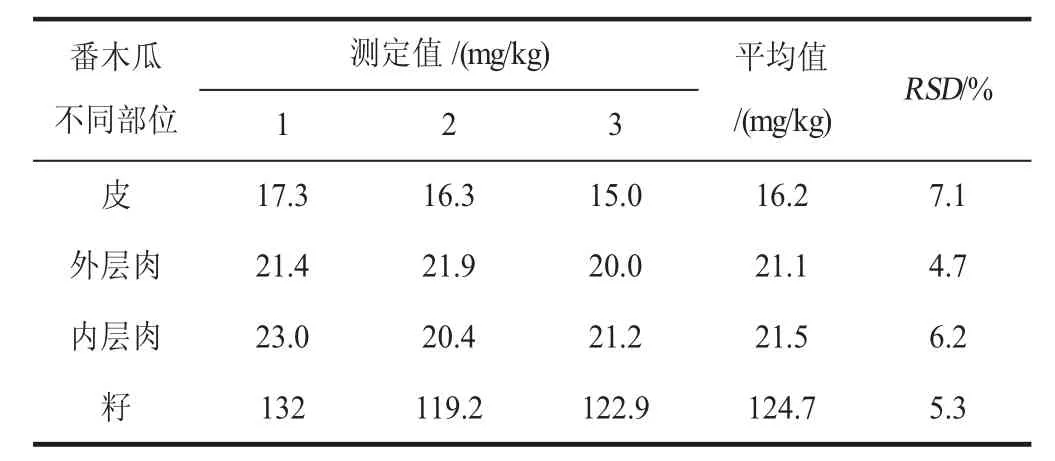
表3 番木瓜不同部位草酸含量(n=3)Table 3 Content of oxalic acid in different part of papaya(n=3)
从表3 中可以看出,番木瓜中各部位的草酸含量总体呈现从外到内(即从表皮到果肉再到籽)逐渐增加的趋势。其中皮含量最低,外层肉和内层肉均比皮稍高,但两者差别不大,而籽中草酸的含量最高,约为皮含量的10 倍。通常情况下,消费者只食用番木瓜果肉部分,果肉中草酸的含量相对较低,正常食用番木瓜不会因摄入草酸过量对身体产生影响。
3 结论
本方法以番木瓜为材料,建立并优化了番木瓜中草酸的高效液相色谱检测方法。最终确定以0.2%磷酸水溶液为提取溶剂,料液比为1∶7,采用匀浆提取方式辅助提取效果最优。番木瓜提取液经SAX 柱净化后可明显降低基质干扰,提高草酸定量的准确性。实验还发现,不同番木瓜样品中草酸含量为17.2~69.0 mg/kg,籽中草酸含量最高,其次为果肉,而果皮中草酸含量最低,正常食用番木瓜不会对消费者健康产生影响。

