3 天持续静脉泵注重组人血管内皮抑制素联合方案治疗实体瘤的不良反应观察与分析
宋佶芳,彭红,彭兴巧,吴秀丽,蹇丹,蒲瑜,罗皓,赵亮,陈骞,钟力,王东,刘芳静,冯燕
陆军军医大学大坪医院肿瘤科,重庆 400042
重组人血管内皮抑制素源于对内源性血管内皮抑素结构的改造,2006 年被批准上市。它是中国第一个批准的,拥有自主知识产权的抗血管生成类药物,适用于治疗初治或复治的Ⅲ/Ⅳ期非小细胞肺癌。给药方式:在一个治疗周期中,每天7.5 mg/m,静脉滴注3~4 h,连续给药14 天,休息1周,再继续下一个周期治疗。重组人血管内皮抑制素Ⅳ期临床研究结果和临床实践中医师的处方体验均提示重组人血管内皮抑制素是一款安全性好的抗血管生成药物。不足之处是由于住院静脉滴注所需时间太长,方便性和依从性较差。自2013 年以来,相继开展了两项重组人血管内皮抑制素泵注给药的Ⅰ期临床研究;在Ⅰ期研究的基础上开展了多项重组人血管内皮抑制素7 天泵注和5 天泵注的临床研究。重组人血管内皮抑制素持续静脉泵注给药方式改善了临床使用方便性和患者的依从性;疗效和安全性结果与重组人血管内皮抑制素14 天静脉滴注给药相比无显著性差异。随着大型医院对肿瘤住院患者的病床周转要求越来越高,重组人血管内皮抑制素210 mg、3 天内通过持续静脉泵注给药将更切合实际。通过文献检索,尚未发现重组人血管内皮抑制素3 天泵注给药的安全性报道。为此,本研究设计了不良反应观察与记录表格,对接受重组人血管内皮抑制素3 天持续泵注治疗期间的不良反应进行观察与记录,通过对数据进行分析小结,为临床更安全地使用重组人血管内皮抑制素提供参考建议。
1 对象与方法
1.1 研究对象
选取2019 年3 月至2020 年5 月在陆军军医大学大坪医院肿瘤科接受3 天持续静脉泵注重组人血管内皮抑制素治疗的127 例实体瘤患者为研究对象。纳入标准:①年龄18~80 岁;②经组织学或细胞学证实为晚期或转移性实体肿瘤;③东部肿瘤协作组体力状态评分为0~1 分;④预期生存期≥3 个月;⑤主要器官功能在治疗前7 天内符合标准。排除标准:①已知对重组人血管内皮抑制素或抗体制剂所含任何组分有超敏反应;②原有严重心脏病;③既往接受血管内皮生长抑制剂类靶向药物治疗;④入组前28 天内接受了重大外科治疗、切开活检或明显创伤性损伤;⑤影像学显示肿瘤已侵犯重要血管或在后续研究期间肿瘤极有可能侵袭重要血管而引起致命大出血;⑥存在任何出血迹象或病史;⑦在入组前4 周内,出现任何出血或出血≥3 级,存在未愈合创口、溃疡或骨折;⑧6个月内发生过动/静脉血栓事件;⑨伴随其他严重疾病。127 例患者中,男83 例,女44 例;年龄﹤55岁37 例,≥55 岁90 例;合并高血压19 例,合并心脏病6 例;有吸烟史60 例;肿瘤分型:肺鳞状细胞癌20 例,肺腺癌89 例,其他18 例;肿瘤分期:Ⅰ~Ⅱ期3 例,Ⅲ期23 例,Ⅳ期100 例,未分期1 例。本研究经医院伦理委员会审核通过,所有患者均对本研究知情并签署知情同意书。
1.2 治疗方法
纳入研究的患者均接受重组人血管内皮抑制素3 天持续静脉泵注治疗。接受治疗的方案包括4种类型:①单用重组人血管内皮抑制素;②重组人血管内皮抑制素联合化疗;③重组人血管内皮抑制素联合程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)单抗;④重组人血管内皮抑制素联合化疗+PD-1 单抗。
1.2.1 重组人血管内皮抑制素 采用全自动电子注药泵(泵头1 个+泵囊,泵囊总容量250 ml)。重组人血管内皮抑制素210 mg(42 ml)与生理盐水210 ml 充分融合后,加入到注药泵泵囊中。设置注液速度,泵囊液以3.5 ml/h 的速度通过静脉输液通路每天连续24 h 持续输入患者体内。252 ml 泵注液72 h 输注结束。每个治疗周期为21~28 天,泵注重组人血管内皮抑制素在第1~3 天进行,每21 天重复1 次,用药至疾病进展或不可耐受的不良反应发生。
1.2.2 化疗 不同的患者所接受的联合化疗方案不同,所涉及的化疗药物包括:顺铂、奈达铂、卡铂、培美曲塞、紫杉醇、白蛋白紫杉醇、吉西他滨、依托泊苷和吡柔比星。化疗每个治疗周期为21天,每21 天重复1 次,最多6 个周期。
1.2.3 PD-1 单抗 在治疗过程中,患者可选择的PD-1 单抗包括:帕博利珠单抗、信迪利单抗、卡瑞利珠单抗。剂量及用药方法按药品说明书执行,用药至疾病进展或不可耐受的不良反应发生。
1.3 观察指标
纳入指标包括:人口学及基线特征;治疗相关信息;症状、体征及实验室检查数据。所有不良反应及其分级根据观察期发生的最高级别进行统计。
1.4 评价标准
在3 天持续泵注重组人血管内皮抑制素治疗期和随访期内进行安全性观察。基于通用不良事件术语标准(common terminology criteria adverse events,CTCAE)5.0 版,制作不良反应观察表格,对所发生的不良反应进行记录和评估分级,对医学干预措施及转归进行记录,对不良反应与治疗药物的相关性进行评判。对于已发生的不良反应将随访至其恢复到正常或基线水平。
1.5 统计学方法
计数资料以例数及率(%)进行描述性统计分析。
2 结果
2.1 治疗相关信息
127 例接受重组人血管内皮抑制素3 天持续泵注联合方案治疗的患者中,92 例(72.44%)接受重组人血管内皮抑制素联合化疗方案,26 例(20.47%)接受重组人血管内皮抑制素联合化疗+PD-1 单抗方案,4 例(3.15%)接受重组人血管内皮抑制素单药方案,5 例(3.94%)接受重组人血管内皮抑制素联合PD-1 单抗方案。完成2 个、3 个、4个、5 个、6 个、6 个以上周期治疗的患者比例分别为:27.56%(35 例)、8.66%(11 例)、18.11%(23 例)、7.87%(10 例)、7.09%(9 例)和30.71%(39 例)。在治疗期间,出于预防性和治疗性目的接受伴随药物治疗:止吐药物(96.06%)、激素(79.53%)、升白细胞/血小板药物(4.72%)。
2.2 不良反应发生情况
纳入不良反应观察的127 例患者中,共68 例患者发生了不良反应,总体不良反应发生率为53.54%(68/127),在发生不良反应的68 例患者中,部分患者合并发生了多个不良反应。其中,血液学不良反应发生率为21.26%(27 例),其中白细胞减少3.94%(5 例),血小板减少2.36%(3 例),贫血14.96%(19 例);非血液学不良反应发生率为59.06%(75 例),其中心肌酶谱异常3.15%(4 例),心悸1.57%(2 例),出血3.15%(4 例),转氨酶异常22.05%(28 例),肾功能异常6.30%(8 例),凝血功能异常4.72%(6 例),恶心/呕吐2.36%(3 例),乏力4.72%(6 例),深静脉血栓3.15%(4 例),皮疹3.94%(5 例),便秘2.36%(3 例),心律失常和心功能下降均为0.79%(各1 例)。3 级血液学不良反应发生率为2.36%(3 例),2 级和3 级转氨酶异常发生率分别为7.87%(10 例)和1.57%(2 例)。(表1、表2)
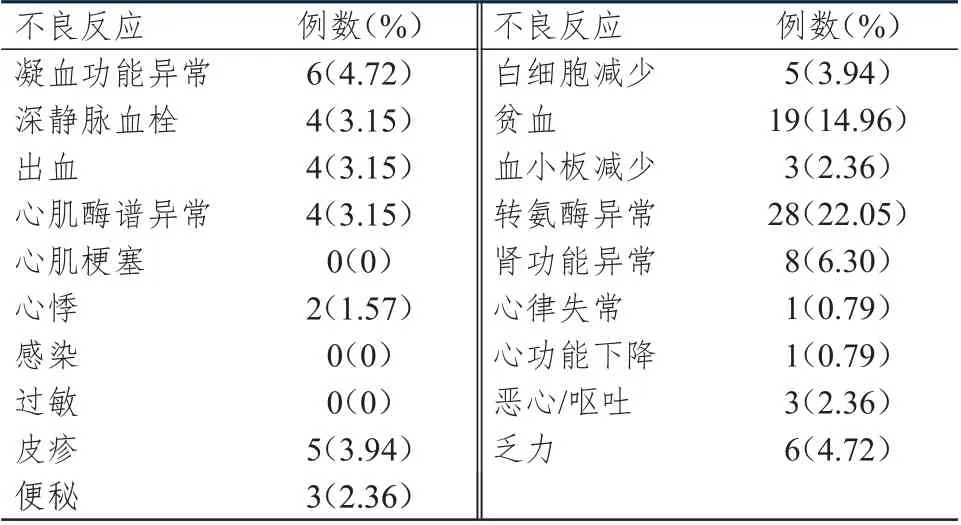
表1 重组人血管内皮抑制素3 天泵注联合方案不良反应发生情况(n=127)
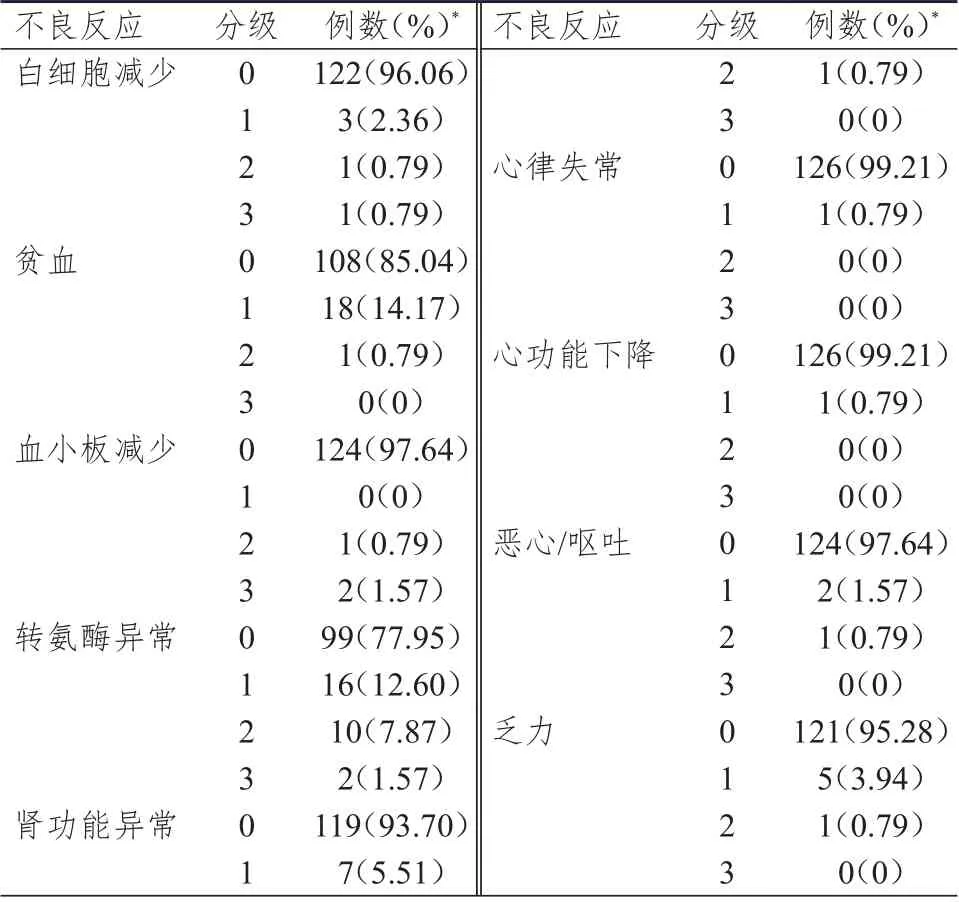
表2 重组人血管内皮抑制素3 天泵注联合方案不良反应分级(n=127)
治疗期间,28 例(22.05%)患者发生转氨酶异常。治疗前,28 例患者中有4 例(14.29%)存在1 级转氨酶异常;治疗前,2 例患者存在肝转移,但基线时转氨酶均正常,在治疗期间另有2 例患者发生肝转移,相对应的转氨酶异常分级为1 级。
3 讨论
就机制而言,重组人血管内皮抑制素与抗血管生成药物中的单靶点药物和多靶点药物不同。单靶点药物贝伐珠单抗,与血管内皮生长因子(vascular endothelial growth factor,VEGF)结合,阻断VEGF 的促新生血管生成作用。临床使用中表现出的不良反应包括高血压、出血、血栓形成和蛋白尿。多靶点的抗血管生成药物如安罗替尼所表现出来的不良反应除上述四大合并症外,还会出现一些机制上难以解释的不良反应,如血尿、手足综合征。重组人血管内皮抑制素在临床使用过程中所表现出的不良反应与上述有所不同。在剂量探索性的Ⅰ期临床研究中,以静脉滴注方式给药,单药剂量至210 mg/m时,该剂量组有1 例出现心脏不良反应,表现为窦性心律不齐;在重组人血管内皮抑制素多次给药剂量试验中,30 mg/m剂量组有1 例出现阵发性室上性心动过速。静脉泵注重组人血管内皮抑制素联合改良奥沙利铂+亚叶酸钙+5-氟尿嘧啶(FOLFOX6)方案一线治疗晚期结直肠癌的Ⅰ期临床研究中,每天15 mg/m剂量组中有1 例发生Ⅲ度室性早搏。Ⅰ期研究的结果提示心律失常可能是重组人血管内皮抑制素的剂量限制性不良反应。重组人血管内皮抑制素上市后开展的Ⅳ期临床研究纳入2725 例受试者,重组人血管内皮抑制素给药方式为每天7.5 mg/m,静脉滴注3~4 h,连续给药14天。安全性数据显示心律失常的发生率为14.8%,其中被判定为与重组人血管内皮抑制素相关的心律失常发生率为0.7%。在重组人血管内皮抑制素静脉泵注(7 天泵注、5 天泵注)临床研究中,安全性结果总体与重组人血管内皮抑制素静脉滴注给药的Ⅲ期和Ⅳ期临床研究结果相似。临床实践中,也观察到重组人血管内皮抑制素是一个安全性好的抗血管生成药物。
纳入本研究的127 例患者中,85.83%为晚期肺癌患者;92.91%接受重组人血管内皮抑制素联合化疗或重组人血管内皮抑制素联合化疗+PD-1 方案。因此,将来自本研究的安全性观察结果与重组人血管内皮抑制素Ⅲ期和Ⅳ期的研究结果进行比较。白细胞减少在重组人血管内皮抑制素3天泵注、重组人血管内皮抑制素Ⅳ期研究和重组人血管内皮抑制素Ⅲ期研究中的发生率分别为3.94%、75.30%和52.45%,血小板减少分别为2.36%、36.10%和15.60%,心律失常分别为0.79%、14.80%和6.44%,转氨酶异常分别为22.05%、8.00%和6.80%。在重组人血管内皮抑制素3 天泵注研究中血液学不良反应发生率明显偏低,与血常规检查数据收集和记录中仅注重收集重组人血管内皮抑制素3 天泵注给药前的检查数据有关。心律失常发生率也较低,这可能反映心律失常与接受重组人血管内皮抑制素治疗的个体因素有关。重组人血管内皮抑制素的Ⅰ期研究数据显示重组人血管内皮抑制素在人体内的代谢存在很大的差异,导致接受同等剂量重组人血管内皮抑制素的个体血液中的浓度存在较大的差异。可能会表现为在小样本研究中心律失常发生率偏低,而在大样本研究中心律失常发生率偏高。本研究安全性分析中最引起关注的是转氨酶异常发生率明显偏高。数据显示,转氨酶异常发生率为22.05%,2 级和3 级转氨酶异常发生率分别为7.87%和1.57%。对28 例存在转氨酶异常患者治疗前的肝功能状态、初治与复治状态、肝转移情况以及治疗过程中肝转移发生情况进行分析,难以用这些因素解释本研究所观察到的转氨酶异常高发生率。查阅代表性的PD-1 单药及联合化疗治疗肺癌的临床研究报告显示,帕博利珠单抗单药治疗晚期肺癌的研 究(KEYNOTE- 010、KEYNOTE- 024 和KEYNOTE-042)中,没有报道转氨酶异常的数据;帕博利珠单抗联合化疗治疗晚期肺癌的研究(KEYNOTE-189 和KEYNOTE-407)中,仅报道免疫相关性肝炎的发生率分别为1.2%和1.8%。本研究中所呈现出的非预期性转氨酶异常高发生率是否与3天持续静脉泵注重组人血管内皮抑制素的用法与用量有关还需要进一步验证。
综上所述,本研究是一项重点观察重组人血管内皮抑制素3 天持续静脉泵注期间不良反应发生情况的观察性研究。样本量较少,数据采集和质量控制并没有完全按照药物临床试验管理规范执行,不排除呈现数据与实际发生情况存在偏差的可能性。通过本研究所获得的以下几点启示对临床安全使用3 天持续静脉泵注重组人血管内皮抑制素和指导今后相关临床与机制研究具有借鉴作用:①心律失常可能是一种个体相关事件,尽管发生率低,但在使用3 天持续静脉泵注重组人血管内皮抑制素期间仍然需要予以重视;②转氨酶异常发生率非预期增高需要在大样本的临床研究中进一步予以观察和证实。

