复杂的与量有关的离子方程式书写归类例析
甘肃省高台县第一中学 石兴龙 734300
离子方程式书写是历年高考的热点之一,而复杂的与量有关离子方程式正确书写,对学生综合分析能力要求较高.答题中多数学生反映难度大,不易掌握.现以近几年部分高考题为例,进行归类解析小结,以让学生更好掌握.
指导学生练习书写反应物不同用量的离子方程式,较好方法是采用“设1 法”,即将不足量或少量反应物配平系数设定为“1”,再去判定另一种足量的反应物配平系数,拆写成离子方程式,对比判断,以提高准确率.
1 已知用量的离子方程式书写
1.1 酸性气体与可溶性碱反应的离子方程式书写
例1 下列离子方程式不正确的是


碱溶液与酸性气体反应有时通过计算用量书写离子方程式如:在100mL 浓度为3mol·L-1的NaOH 溶液中,通入标况下4.48L的CO2气体;在100mL 浓度为2mol·L-1的Ba(OH)2溶液中,通入标况下6.72L的CO2气体(不考虑气体在水中的溶解).分析碱与不足量、足量酸性气体反应,判断产物,再写用量比复杂的离子方程式. 计算反应物用量

小结:碱溶液与少量酸性气体(CO2、SO2、SO3、H2S)反应生成正盐,酸性气体过量生成酸式盐.
1.2 弱酸盐溶液与酸性气体反应的离子方程式书写
例2 下列指定反应书写的离子方程式正确的是


小结:弱酸盐溶液与少量酸性气体(CO2、SO2、SO3、H2S 等)反应生成正盐,过量生成酸式盐,离子方程式写法同碱溶液与酸性气体反应相似;但要具体分析酸性气体、参加反应物质的性质;注意弱酸根发生水解反应,H2O不要漏写.
1.3 弱酸酸式盐与强碱溶液反应的离子方程式
例3 下列表示对应化学反应的离子方程式是否正确

解析B:NaHCO3溶液中加入少量、足量

2 未知用量的离子方程式书写
2.1 多元弱酸盐与强酸溶液反应的离子方程式书写
例4 (2014 上海20 题)向等物质的量浓度的NaOH 和Na2CO3的混合溶液中加入稀盐酸. 下列离子方程式与事实不相符的是:()

2.2 酸与碱溶液反应的离子方程式书写
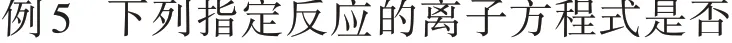
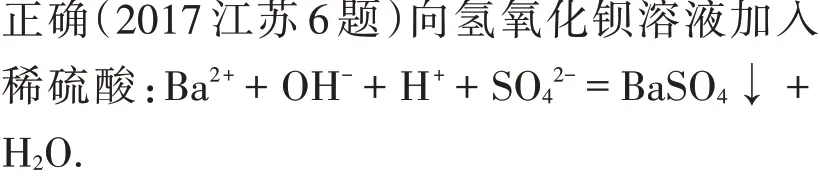

小结:酸与碱反应离子方程式书写时注意反应的物质的量比,当计量数相同时,才能约去;强酸酸式盐溶液中完全电离,拆写成离子,与弱酸盐或碱反应,表现强酸性.
2.3 根据加入顺序或反应现象判断用量,书写离子方程式


小结:两种试剂相互加入时若现象不同,不用其它试剂,根据加入顺序判断药品试剂.若没有明确说明用量,一般药品在试管或小烧杯为足量或过量,在滴管被滴加为少量.
3 反应物物质浓度、用量,氧化性、还原性不同反应的离子方程式书写
例7 能正确表示下列反应的离子反应方程式的是
A.(2019 天津2 题)氧化亚铁溶于稀HNO3:FeO+2H+=Fe2++H2O;
B.(2019海南11题)向FeBr2溶液中通入过 量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;


小结:注意对比分析反应物浓度和性质、用量,判断氧化、还原产物及反应进行的程度;应用氧化性、还原性强弱顺序,强先弱后规律,判断氧化、还原反应发生的先后,书写时注意检查是否守恒.
4 参加反应物质用量、浓度、溶解性不同的反应离子方程式书写
例8 下列指定的离子方程式正确的是



5 离子方程式意义的理解应用

解析:对比写出反应物不同用量比的离子方程式,符合其意义即可.


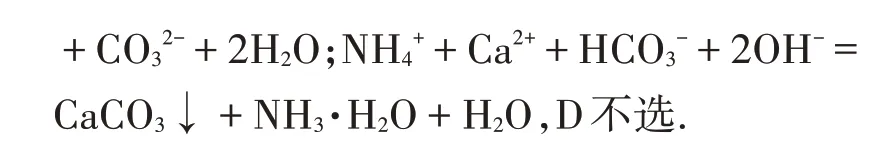
小结:此类题目难度增大,解答时对比写出反应物不同用量比的离子方程式,有一种符合即可;若反应中没有反应物量的限制,通常以酸碱完全中和或完全沉淀为依据确定反应计量系数.
复杂的与量有关离子方程式书写时注意题目隐含条件,分析参加反应物质的浓度、性质差异;对比反应物不同用量、反应现象,判断反应进行的程度和生成产物,仔细拆写;掌握规律方法,突破难点,平时多练习,提高准确率.

