乳腺癌组织中黑色素瘤相关抗原-As的表达及临床意义
李凤莲,王玉新,杜丽新,霍立刚,刘俊芳,桑梅香,李书清
(1.河北省衡水市第五人民医院检验科,河北 衡水 053000;2.河北医科大学第四医院科研中心免疫室,河北 石家庄050011;3.河北省衡水市人民医院,河北 衡水 053000)
0 引言
现今乳腺癌是国内外女性的疾病杀手之一[1],尽管治疗手段多样化[2],其危害性依然强大。近年来,肿瘤相关抗原的研究已经成为肿瘤免疫治疗研究的热点。作为癌/睾丸抗原家族成员之一的MAGE,由于其表达特性以及对肿瘤病理指标变化的影响,为临床免疫治疗效果提供参考。本研究采用免疫组织化学法研究在乳腺癌组织及相应乳腺正常组织中MAGE-A 家族 (包括 MAGE-A1、-A2、-A3、-A4、-A6、-A10和-A12,以下简称为MAGE-As)的表达;分析了MAGE-As蛋白与乳腺癌患者的临床病理学指标之间的相关性,为临床乳腺癌治疗提供理论依据及参考。
1 资料与方法
1.1 临床资料
选择衡水市第五人民医院2018年至2019年住院患者110名女性患者,患者诊断方法采用现今常用的经典经针吸细胞学或冰冻病理切片法,年龄34~76岁,其排除标准:未进行化疗、放疗和内分泌治疗。患者基本情况:<55岁者60例,≥55岁者50例 。肿瘤大小:≤2 cm3的患者量为13例,>5cm3的患者量为75例,在上述两者之间的患者量为22例。根据国际抗癌联盟UICC的乳腺癌分期标准对乳腺癌患者进行分期:I期,Ⅱ期,Ⅲ期的人数分别为24例,69例,17例;组织学分期,I,II级,Ⅲ级级患者数量依次为28例,68例,14例; ER呈阳性及阴性患者分别有70例,40例; PR阳性及阴性患者分别有69例,41例;临床病理学检测显示: HER-2是阳性(+++)47例,HER-2阴性(-)者63例; VEGF阳性及阴性分别有99例,11例;抑癌基因P53阳性者及PR阴性者依次为46例, 64例。腋淋巴结转移患者54例,腋淋巴结未转移患者56例。
1.2 实验材料
乳腺癌组织的收集:离体半小时内的新鲜的组织,正常乳腺组织的收集:距乳腺癌组织大于5 cm的福尔马林溶液(10%)固定,石蜡包埋。
1.3 实验方法
采用免疫组织化学链霉菌抗生物素蛋白-过氧化酶法 (streptavidin peroxdase conjugated method,S-P),试剂盒来源是北京中杉生物技术有限公司,操作步骤完全依照说明书进行。鼠抗人MAGE-A(6C1)单克隆抗体(Abcam公司)1:200稀释。阳性对照是人的正常睾丸组织,阴性对照是乳腺的正常组织。
1.4 统计学处理
所有数据应用SPSS 20.0统计分析,采用卡方检验及Spearsman检验进行相关数据的分析,P<0.05为差异具有统计学意义。
2 结果
2.1 判定标准
将组织标本放在光学显微镜下进行观察,随机选取计数细胞大于2000个的高倍镜视野20个,对这20个视野进行综合判断分析,得出细胞阳性率及其染色强度。
本实验的病理判断标准如下:MAGE-As的阳性病理分级主要依据显微观察范围内的阳性细胞数目及细胞内细颗粒颜色判断。细胞质/细胞核内有棕黄色细颗粒,阳性细胞的数目少于25%,标记为MAGE-As(-);阳性细胞的数目约26%~50%,细胞内颗粒颜色呈淡黄色标记为(+);阳性细胞数约51%~75%,细胞内颗粒颜色呈棕黄色,标记为(++);阳性细胞数占76%-100%,细胞内颗粒颜色呈棕色,以上为(+++)。

图1 正常组织MAGE-As蛋白的表达(包含MAGE-A1、-A2、-A3、-A4、-A6、-A10、-A12)
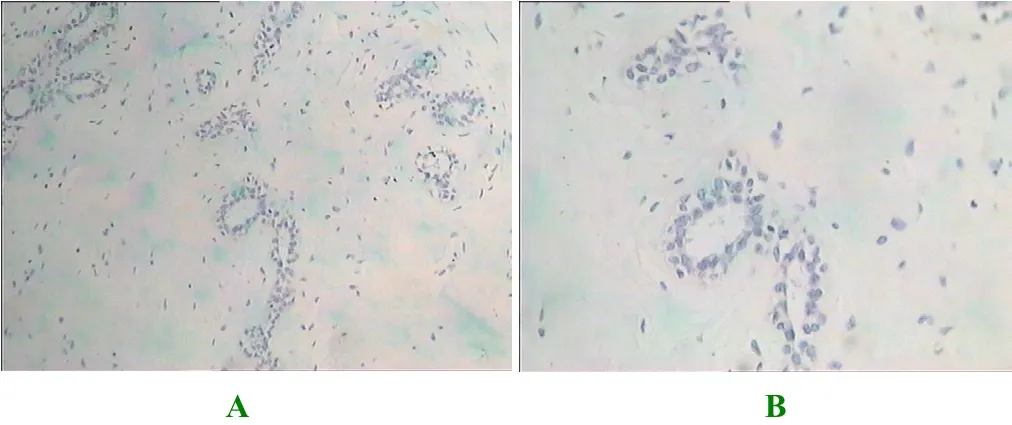
图2 正常组织MAGE-As蛋白的表达

图3 MAGE-As 在乳腺癌组织中的阴性表达
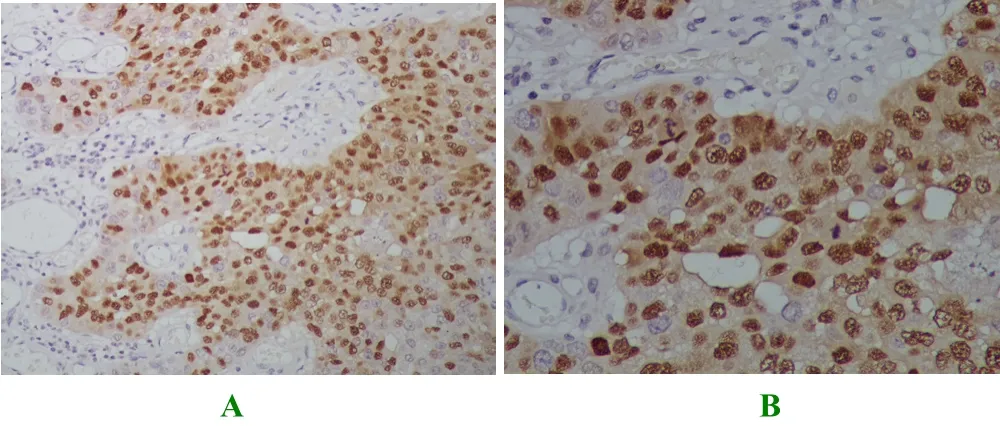
图4 MAGE-As 在乳腺癌组织中的阳性表达
2.2 MAGE-As在乳腺癌和相应癌旁正常组织中的表达
研究表明:通过对110例患者的癌旁正常乳腺组织研究可知,所有正常乳腺组织均未发现MAGE-As的蛋白表达,有48例患者组织的MAGE-As蛋白表达呈阳性,即阳性率为43.6%,结果提示MAGE-As是肿瘤特异性抗原,见表1。
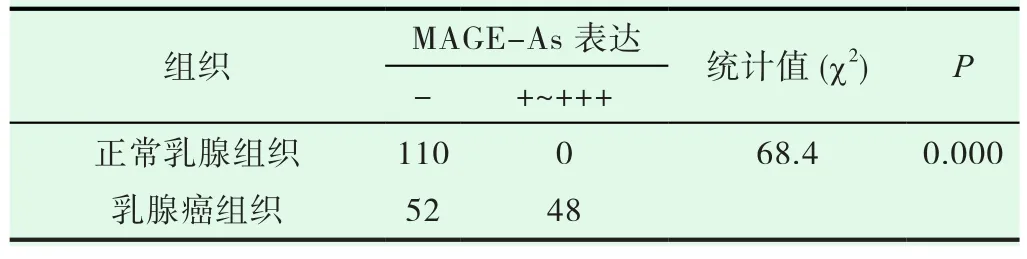
表1 MAGE-As在乳腺癌和相应癌旁正常组织中的表达
2.3 MAGE-As蛋白的表达与乳腺癌患者临床病理学指标之间的相关性
见表2。
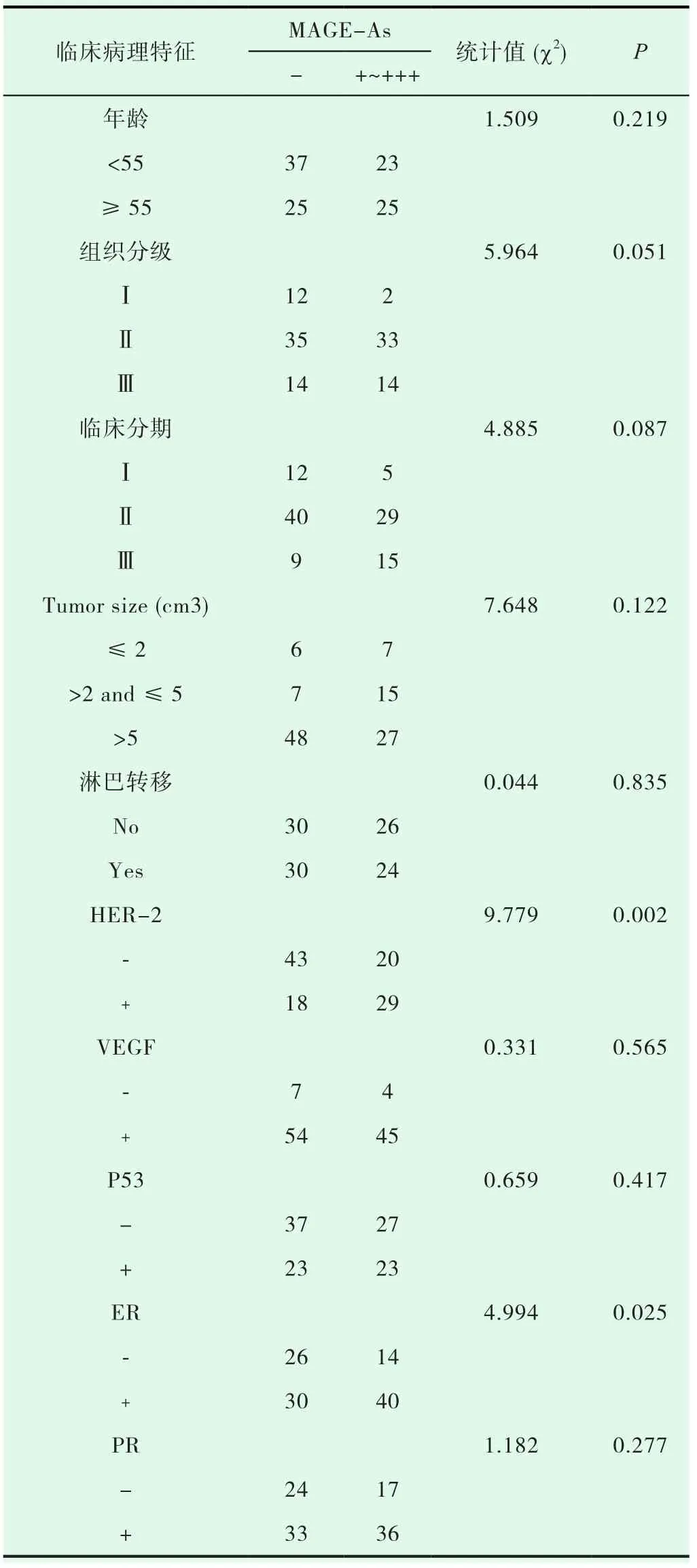
表2 MAGE-As蛋白表达与乳腺癌临床病理学指标的相关性
在110例乳腺癌患者的组织中,HER-2表达阴性患者63 例 (-~++),、阳性患者 47 例 (+++);MAGE-As表达阳性的患者在HER-2表达阴性者中所占的比例为31.7%(20/63);MAGE-As表达阳性的患者在HER-2表达阳性者中所占的比例为占61.7%(29/47),明显高于HER-2表达阴性组 (χ2=9.779,P=0.002)。MAGE-As蛋白的表达与 HER-2 及ER的表达呈正相关。
ER研究结果表明: ER表达呈阴性的患者有40例(-~++),其中 MAGE-As表达呈阳性占 35.0%(14/40),ER 表达呈阳性(+++)的患者有70例,其中MAGE-As表达呈阳性的患者占57.1%(40/70),明显高于ER表达的阴性组(χ2=4.994,P=0.025)。
除此之外,MAGE-As蛋白的表达与乳腺癌患者的其它临床参数均无明显相关性 (P>0.05),如 VEGF(χ2=0.565,P=0.331),P53(χ2=0.659,P=0.417)、乳腺癌患者年龄 (χ2=1.509,P=0.219),PR 状态 (χ2=1.182,P=0.0277)、临床分期 (χ2=4.885,P=0.087)、肿瘤大小 (χ2=7.648,P=0.122)、组织学分级 (χ2=5.96,P=0.051)、淋巴结转移 (χ2=0.044,P=0.835)。
3 讨论
乳腺癌属于异质性疾病中的一种,是女性最常见且最恐惧的恶性肿瘤之一。乳腺癌的发生与多种因素有关,如年龄、避孕药、饮酒、焦虑、病毒感染等因素,针对乳腺癌形成可能有关的因素,结合肿瘤免疫学和分子生物学的综合研究,现今最乳腺癌进行治疗的方法主要是以肿瘤特异性抗原为基础的进行的治疗,该治疗方法具有无创伤、特异性强等优点。对一些复发、晚期和转移肿瘤具有较好的疗效。
MAGE-A家族成员存在同源结构域,制备对MAGE-A家族所有成员都起作用的特异性的抗体难以实现,因此限制了该家族成员蛋白水平的研究[3,4]。本研究利用MAGEA(6C1)抗体,由于其可与MAGE-As发生交叉反应,可同时检测。乳腺癌组织及其癌旁正常组织中的MAGE-As蛋白的表达研究表明:MAGE-As蛋白在110例乳腺癌组织中阳性率为43.6%(P<0.05),MAGE-As蛋白在非乳腺癌的正常组织不表达,说明MAGE-As蛋白是乳腺癌组织的特异性抗原。
MAGE-As蛋白表达与乳腺癌患者临床一般特征(包含年龄、VEGF、肿瘤大小、PR状态、淋巴转移、病理类型、P53、临床分期、组织学分级等)研究表明:两者均无显著关系。乳腺癌患者中HER-2呈阳性者MAGE-As的表达率61.7%(29/47),明显高于 HER-2 呈阴性组 41.3%(26/63)(χ2=9.779,P=0.002),该统计结果可得出以下结论:MAGE-As与HER-2具有相关性,并且是呈正相关。Kufer等人研究显示[5,6,7]HER-2的表达呈阳性会对乳腺癌患者的预后产生不良影响,MAGE-As与HER-2又是呈彼高此高的正相关,分析MAGE-As蛋白的高表达同样对乳腺癌患者的预后产生不良影响,可能是其预后不良的重要标志。
分析ER阳性的乳腺癌患者MAGE-As蛋白的表达,结果表明,此类患者MAGE-As蛋白的阳性表达率为57.1%(40/70),明 显 高 于 ER 阴 性 患 者 35.0%(14/40)(χ2=4.994,P=0.025)。MAGE-As蛋白在乳腺癌组织中高表达可推测MAGE-As蛋白可作为乳腺癌治疗的参考指标之一。
重组蛋白MAGE可作为免疫原产生的抗体,可与MAGE-A12、MAGE-A1-A4,MAGE -A10、MAGE-A6发 生 反 应,推测可研究MAGE-As的多价疫苗。另外,肿瘤中抗原表位的呈递具有HLA型别的限制,CTA的表达不均质,仅仅应用CTA免疫疗法不理想,应该依据受体患者及肿瘤个体特异性,设计包含多类型表位的CTA多价疫苗。

