达格列净通过Nrf2/Keap1信号通路对成人1型糖尿病患者血糖波动及尿酸的影响
谢环,陈海滨,宋俊华,张沥,李岚
1型糖尿病(type 1 diabetes mellitus,T1DM)是一种由于自发性糖尿病酮症酸中毒(DKA)或者胰岛素绝对缺乏引发的自身免疫性疾病[1]。目前,临床上主要应用胰岛素对T1DM进行治疗。但是,进行多次的胰岛素泵持续性皮下输注或直接皮下注射胰岛素,对胰岛素分泌的生理模式模拟作用较差[2]。因此,对于长期胰岛素治疗者,大都存在低血糖或血糖波动的现象。血糖波动可以引发机体产生炎性因子和氧化应激反应,进而造成动脉粥样硬化和内皮功能障碍的发展[3-4]。故寻找新的药物以有效减少血糖波动显得尤为重要。另外,有研究显示,某些降糖药物可以通过Nrf2/Keap1信号通路影响糖、尿酸的代谢和生成[5]。达格列净是一种钠—葡萄糖协同转运蛋白2抑制剂(SGLT2i),可以有效地降低血糖、血脂,减轻体质量,被美国食品药品监督管理局(FDA)批准用于T1DM和T2DM治疗[6]。有研究显示,达格列净在治疗1型糖尿病和2型糖尿病方面,具有相似的药效学和药代动力学,可用于T1DM的辅助治疗,有效防止患者血糖波动和体质量增加[7]。但目前临床上关于其对T1DM患者血糖波动的研究相对较少。现观察达格列净通过Nrf2/Keap1信号通路对成人1型糖尿病患者血糖波动及尿酸的影响,为其临床诊治提供参考,报道如下。
1 资料与方法
1.1 一般资料 选择2019年1月—2020年12月长沙市第四医院/湖南师范大学附属长沙医院内分泌科收治成人1型糖尿病患者66例作为研究对象,男30例,女36例,年龄18~38(30.21±2.61)岁;按照随机数字表法分为对照组和观察组各33例,所有患者均无相关家族遗传史。本研究经医院医学伦理委员会批准(审批号:CSSDSYY-LLSC-KYXM-2020-02-09),患者及家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①符合美国糖尿病学会制定的关于T1DM的诊断标准[8];②近3个月未使用SGLT2i者。(2)排除标准:①合并严重胃肠道及肝肾疾病者;②反复尿道及生殖道感染者;③合并糖尿病急性并发症者;④合并严重心脑血管疾病者;⑤合并急性酮症酸中毒等代谢性疾病者;⑥妊娠期、哺乳期患者;⑦对本研究药物过敏者;⑧依从性差,中途退出者。
1.3 治疗方法 2组患者均给予运动干预和饮食指导,对照组另予胰岛素每日4次强化注射治疗方案:门冬胰岛素[诺和诺德(中国)制药有限公司]+赖脯胰岛素(礼来苏州制药有限公司)+甘精胰岛素(Sanofi-Aventis Deutschland GmbH)+地特胰岛素(丹麦诺和诺德公司),起始剂量为0.5 U/kg,其中50%为基础量,剩余50%平均分配于三餐前剂量皮下注射。观察组患者在对照组治疗的基础上加达格列净(阿斯利康制药有限公司)10 mg/次口服,1次/d。血糖控制目标为餐后2 h血糖(2 h PG)<10 mmol/L,空腹血糖(FPG)<7 mmol/L,治疗时根据血糖结果对治疗方案进行调整,2组均治疗3个月。
1.4 观察指标与方法
1.4.1 血清Nrf2、Keap1水平测定:于患者治疗前后,清晨8:00抽取空腹静脉血5 ml,离心取上清,-80℃保存备用。采用酶联免疫吸附法对血清Nrf2、Keap1水平进行测定,试剂盒购于上海联迈生物工程有限公司,操作方法严格按照说明书执行。
1.4.2 血糖及胰岛细胞功能测定:(1)动态血糖监测,治疗前后采用动态血糖仪(Northridge;美敦力公司生产)对皮下组织间液葡萄糖浓度进行检测,5 min监测1次,获得72 h血糖波动图谱。①血糖标准差(SDBG)及平均水平(MBG):24 h内所有测定血糖值的离散程度及全天血糖的平均水平;②平均血糖波动幅度(MAGE):去除所有幅度未超过一定阈值的血糖波动后,根据第一个有效波动方向对血糖波动幅度进行计算,进而得到平均值;③最大血糖波动幅度(LAGE):最低和最高血糖值的差值。(2)胰岛β细胞功能测定:治疗前和治疗后3个月抽取患者空腹肘静脉血5 ml,离心取血清,-20℃保存待测。采用全自动生化分析系统[日立7600型,日立仪器(上海)有限公司]测定尿酸(UA),全自动电化学发光免疫分析仪(Architect i2000SR型,雅培)测定餐后2 h C肽(2 h C-P)、空腹C肽(FC-P)。胰岛素水平采用放射免疫法进行测定,试剂盒购于上海生物制备所,操作方法严格按照说明书执行。
1.4.3 不良反应发生情况:观察记录2组患者治疗期间的低血糖、生殖道感染及肝肾功能异常等并发症发生率。
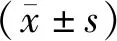
2 结 果
2.1 2组临床资料比较 2组患者在性别、年龄、病程、BMI、FPG、HbA1c空腹C肽等方面比较差异无统计学意义(P>0.05),具有可比性,见表1。
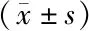
表1 对照组与观察组T1DM患者临床资料比较
2.2 2组治疗前后血清Nrf2、Keap1水平比较 与治疗前比较,治疗3个月后2组患者血清Nrf2、Keap1水平均明显降低,且观察组降低较对照组更明显(P<0.01),见表2。

表2 对照组与观察组T1DM患者治疗前后血清Nrf2、Keap1水平比较
2.3 2组治疗前后动态血糖监测比较 与治疗前比较,治疗3个月后2组患者MAGE、SDBG、MBG及LAGE值均明显降低,且观察组降低较对照组更明显(P<0.01),见表3。
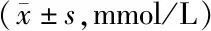
表3 对照组与观察组T1DM患者治疗前后动态血糖监测结果比较
2.4 2组治疗前后胰岛β细胞功能比较 与治疗前比较,2组患者治疗3个月后FC-P、2 hC-P明显升高,UA和每日胰岛素值明显降低,且观察组变化幅度较对照组更明显(P<0.01),见表4。
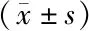
表4 对照组与观察组T1DM患者治疗前后胰岛β细胞功能比较
2.5 2组不良反应发生情况比较 对照组患者发生低血糖3例和生殖道感染1例,观察组发生低血糖2例和生殖道感染1例,均无酮症不良反应发生,2组患者不良反应发生率比较差异无统计学意义(12.12% vs.9.09%,χ2=1.065,P=0.613)。
3 讨 论
糖尿病的主要临床特征是血糖波动和慢性高血糖,血糖波动在血管并发症预防和糖尿病控制方面发挥着重要的作用。有研究显示,全球糖尿病治疗措施均是尽可能地对血糖因素进行控制,包含血糖波动、餐后血糖和空腹血糖水平、HbA1c[9-11]。在T1DM患者的整个治疗过程中,由于出现体质量增加和低血糖等不良反应,限制了胰岛素的使用,进而造成血糖控制困难。为了避免上述风险的出现,研究不同作用机制的药物对T1DM进行治疗刻不容缓[12]。本研究中使用的达格列净是一种新型的SGLT2i降糖药物,其降糖机制与胰岛素的分泌关联性相对较小,而是通过对葡萄糖重吸收进行抑制,增加尿糖的排泄,进而起到降低血糖的效果,低血糖的发生风险较低[13-14]。另外,其还可以同时对肠道SGLT1功能进行抑制,可有效降低餐后血糖,达到稳定血糖的目的[15]。
血糖动态监测可提供可靠、全面、连续的全天血糖信息;通过对血糖波动趋势的分析研究,可检测出时段低血糖和高血糖。而本研究中使用的MAGE、SDBG、MBG及LAGE值是临床公认的血糖波动指标[16-17],能为血糖动态监测提供有益的借鉴。本研究中观察组患者治疗3个月后,MAGE、SDBG、MBG及LAGE值降低非常显著,提示达格列净可以更好地控制T1DM的血糖波动,有助于减少相关并发症的发生,改善预后。本研究中观察组患者治疗3个月后,FC-P、2hC-P明显升高,每日胰岛素值明显降低,提示达格列净可以降低胰岛素用量,改善胰岛β细胞功能。这是由于达格列净可以通过促进葡糖激酶合成、肠降血糖素分泌等途径对胰岛β细胞功能进行保护。另外,其还可快速降低和稳定血糖水平,降低胰岛细胞负荷,从而改善胰岛β细胞功能[18]。相关研究显示,高尿酸血症和糖尿病的发生、发展均与氧化应激反应呈现一定程度的关系,其中Nrf2是机体抗氧化的重要因子,是一种在炎性反应和氧化应激条件下对失调进行调节的转录因子,而Keap1又对Nrf2的活性进行调控[19-20]。在正常细胞中,Nrf2 被Keap1同源二聚体捕获后,相关蛋白酶体可对其进行降解,使其失活;在氧化应激反应中,产生一定的亲电子,并将其直接引入到Keap1的半胱氨酸中,对其构象进行改变。这种修饰促使Nrf2和Keap1之间的相互作用而发生失活,之后发生核转位反应,激活相应的靶基因,进而发挥作用[21-22]。本研究结果显示,观察组患者治疗后血清Nrf2、Keap1及UA值明显降低,提示达格列净可通过Nrf2/Keap1信号通路,有效改善T1DM患者氧化应激反应,降低尿酸水平。
综上所述,达格列净治疗成人1型糖尿病,可有效优化血糖控制,改善胰岛β细胞功能,降低血清Nrf2、Keap1及尿酸水平,改善机体氧化应激反应,安全性高,具有一定的临床应用价值。
利益冲突:所有作者声明无利益冲突
作者贡献声明
谢环、陈海滨:设计研究方案,实施研究过程,论文撰写;宋俊华:图表设计,整理资料;张沥:资料搜集整理,论文修改,查找文献及参考书籍;李岚:进行统计学分析

