负载血管生成素1的聚乳酸羟基乙酸-聚乙二醇纳米微粒促进大鼠心肌梗死后心肌修复
方 涛,杨婉浠,李 昕,丛志成,张沛宗,祁 泉,宋 兵*
(兰州大学 1.第一临床医学院;2.第一医院 心血管外科,甘肃 兰州 730000)
心肌梗死(myocardial infarction,MI)是造成人类死亡的常见原因之一,每年大约导致730 万人死亡[1]。在过去的几十年间,尽管对其的诊疗取得了长足进展,但仍造成54%的患者在发病5 年内死亡[2]。治疗性血管新生是通过将外源性血管生长因子植入到缺血组织中以达到缺血组织重新获得血液供应的目的。血管生成素1(angiopoietin1,Ang1)不但可以促进活性血管的生成,也能抑制内皮细胞的凋亡。但其应用仍受到多种因素的制约:1)Ang1难于提取、制备、应用;2)Ang1半衰期短,难于维持足够的局部血药浓度;3)持续注射,会产生较大副作用[3]。
PLGA-PEG能够有效增加小分子蛋白的稳定性,提高其生物利用度,是一种较好的药物载体,特别适用于蛋白质等药物的注射治疗[4]。基于此,本研究通过将PLGA-PEG和Ang1偶联,进行心肌梗死周围局部注射,改善心肌梗死大鼠心脏功能,为其以后的临床应用提供更多的实验依据。
1 材料与方法
1.1 材料
重组人血管生成素1和血管生成素1酶联免疫吸附试剂盒(ELISA)均(R&D Systems公司);PLGA(济南岱罡生物工程有限公司);PEG(JenKem科技公司);磷酸缓冲盐溶液(PBS)(甘肃华谱生物科技有限公司);CD31一抗(上海允麦生物科技有限公司);α-SMA(上海信帆生物科研所);Fluor® 594 荧光二抗和Fluor® 488 荧光二抗(Abcam公司);TUNEL细胞凋亡检测试剂盒(北京盛科博源生物科技有限公司)。年龄6~8周SPF级雄性SD大鼠(体质量200~250 g)中科院兰州兽研所实验动物,许可证号:SCSK(甘2015-0001)。本研究中所有程序均符合“实验动物护理和使用指南”(国家卫生研究院,第85-23号出版物,修订版),并在兰州大学动物使用委员会监督下进行。
1.2 方法
1.2.1 纳米微粒的制作及物理表征:用双乳液法制备了Ang1的PLGA-PEG纳米微粒[5]。并使用Philips CM120透射电子显微镜检测粒径和形态,通过Elisa法检测其包封率(包封率%=纳米微粒中Ang1的测得量/制备载药纳米粒时Ang1的加入量×100%)以及体外释放过程。
1.2.2 大鼠的分组及处理:复制大鼠心肌梗死模型[6]。1 周后彩超检测心脏,将大鼠随机分组:模型组(心肌梗死周围区域注射100 μL PBS溶液)(n=8)、Ang-1组[注射含Ang1的PBS溶液(100 μL,25 ng/μL)](n=8)、Ang1-PLGA-PEG组[注射100 μL纳米微粒混悬液,约含(1.61±0.05)μg Ang1](n=9),注射深度约3 mm。于4 周后收集超声心动图数据,并分析。然后,处死大鼠并收取心脏组织。用4%甲醛灌注心脏20 min,用PBS漂洗约10 min。然后将心脏样品进行固定、包埋并切片。
1.2.3 Masson染色检测组织增生:在镜下观察纤维结缔组织增生情况,并且使用Image J软件测量以下数据:心室壁厚度(mm)、隔膜厚度(mm)、瘢痕厚度(mm)、左室腔面积(mm2)和整个左室面积(mm2)。每个参数测量进行3 次。然后,计算每个参数的平均值。纤维结缔组织可根据增生情况分为4 级[7]。相对瘢痕厚度:瘢痕壁的平均厚度值与未受影响的心室壁的平均厚度值的比例。梗死扩张指数:(左室腔面积/整个左室面积)/相对瘢痕厚度[8]。
1.2.4 免疫荧光染色检测血管新生:先使用CD31和α-SMA抗体进行血管染色,然后在滴加相应的Fluor® 594 荧光二抗和Fluor® 488 荧光二抗。在荧光显微镜下通过α-SMA和CD31阳性来识别梗死周边区域的小动脉和毛细血管形成情况并拍照,随机选择8个图像,并计算1 mm2内小动脉和毛细血管数量的平均值。以α-SMA阳性的血管数量相对于血管的总数量来计算成熟指数[9]。使用Image J软件进行所有测量。
1.2.5 TUNEL染色检测细胞凋亡:使用TUNEL细胞凋亡检测试剂盒检测心肌细胞凋亡。在荧光显微镜下随机选择5个视野中凋亡细胞核和总细胞核,使用Image J软件计算TUNEL阳性细胞核和总细胞核数目。TUNEL阳性细胞核的百分比定义为凋亡细胞核数与细胞核总数的比值[10]。
1.3 统计学分析
2 结果
2.1 纳米微粒检测
经检测,确定制备的纳米微粒的平均大小为180 nm,Ang1在微粒中的包封率为64.3%±2.4%[即为每毫克纳米颗粒包含(321.5±1.1)ng的Ang1]。Ang1-PLGA-PEG纳米微粒在前3 d释放了46.3%的Ang1,前10 d释放了73.9%,在随后的时间,Ang1的释放速率减慢直到第30天(图1)。

图1 Ang1-PLGA-PEG 纳米微粒中Ang1的体外释放曲线Fig 1 In vitro released profiles of angiopoietin 1
2.2 彩超检查心脏
注射后4 周:与模型组和Ang1组相比,Ang1-PLGA-PEG组左室射血分数(left ventricular ejection fraction,LVEF)明显增大,且左室缩短率(left ventricular fractional shortening,LVFS)也增加;而左室收缩末期内径(left ventricular internal diameter at end-systole,LVIDs)减小,同样左室舒张末期内径(left ventricular internal diameter at end-diastole,LVIDd)也有类似的趋势(图2)。
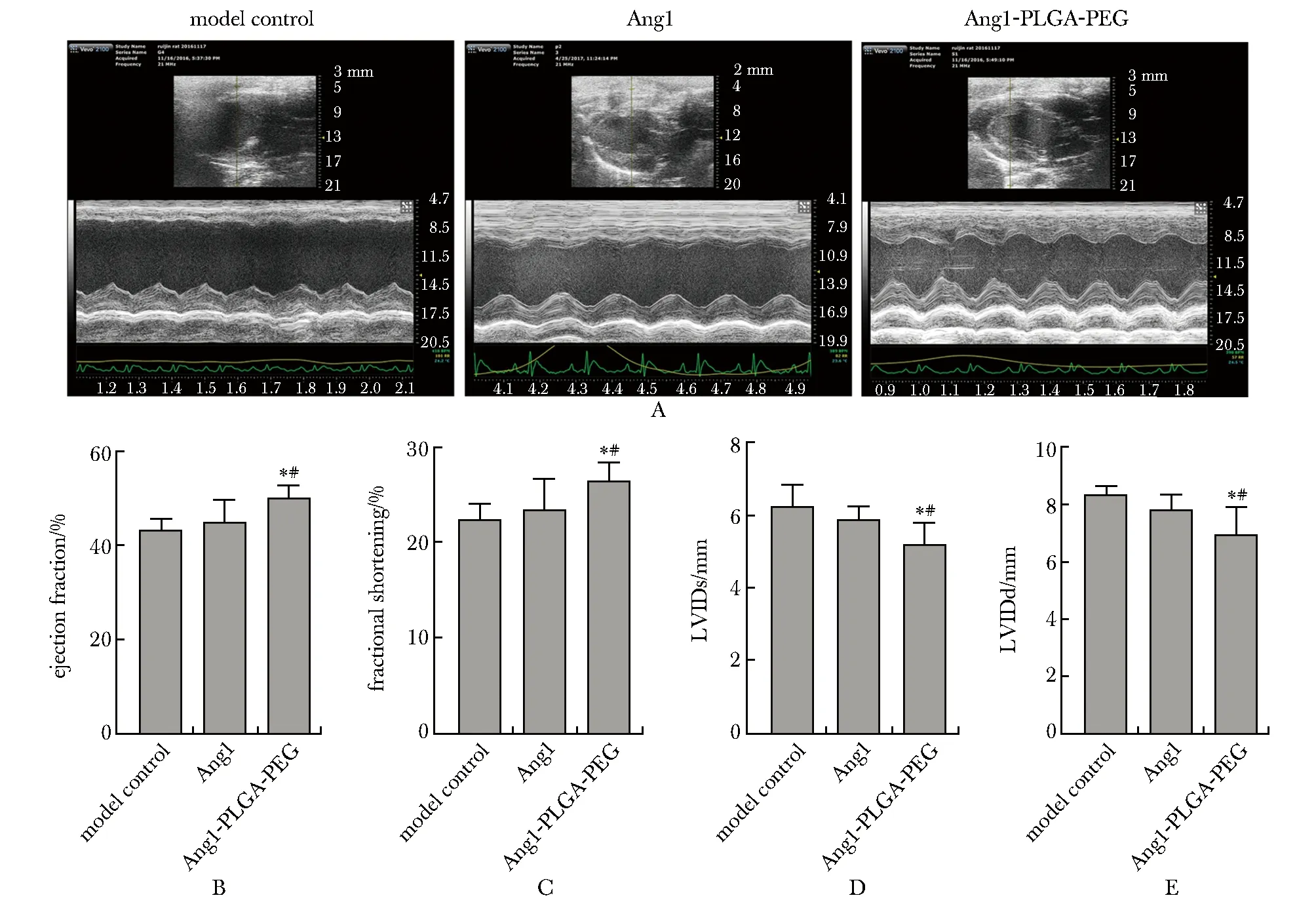
A.representative echocardiographic images from each group;B.the left ventricular ejection fraction(LVEF);C.left ventricular fractional shortening(LVFS);D.left ventricular internal diameter at end-systole(LVIDs);E.left ventricular internal diameter at end-diastole(LVIDd)was assessed via two-dimensional echocardiography;*P<0.05 compared with the model control group;#P<0.05 compared with Ang1 group;Ang1-PLGA-PEG.angiopoietin1 loaded in PLGA-PEG NPs图2 超声心动图评估Fig 2 Echocardiographic
2.3 Masson染色检测瘢痕组织增生
与模型组和Ang1组相比,Ang1-PLGA-PEG组相对瘢痕厚度显著增加,梗死扩张指数明显减小(图3);且纤维结缔组织增生情况较低(表1)。可见模型组和Ang1组梗死部位形成大量的纤维结缔组织,可见较少的心肌肌纤维组织,梗死部位的周边纤维结缔组织与心肌组织之间紧密相间分布,梗死壁厚度较小。Ang1-PLGA-PEG组梗死部位形成少量的纤维结缔组织,可见较多的心肌肌纤维组织,梗死部位的周边心肌组织和纤维结缔组织稀疏相间,梗死壁厚度较大。
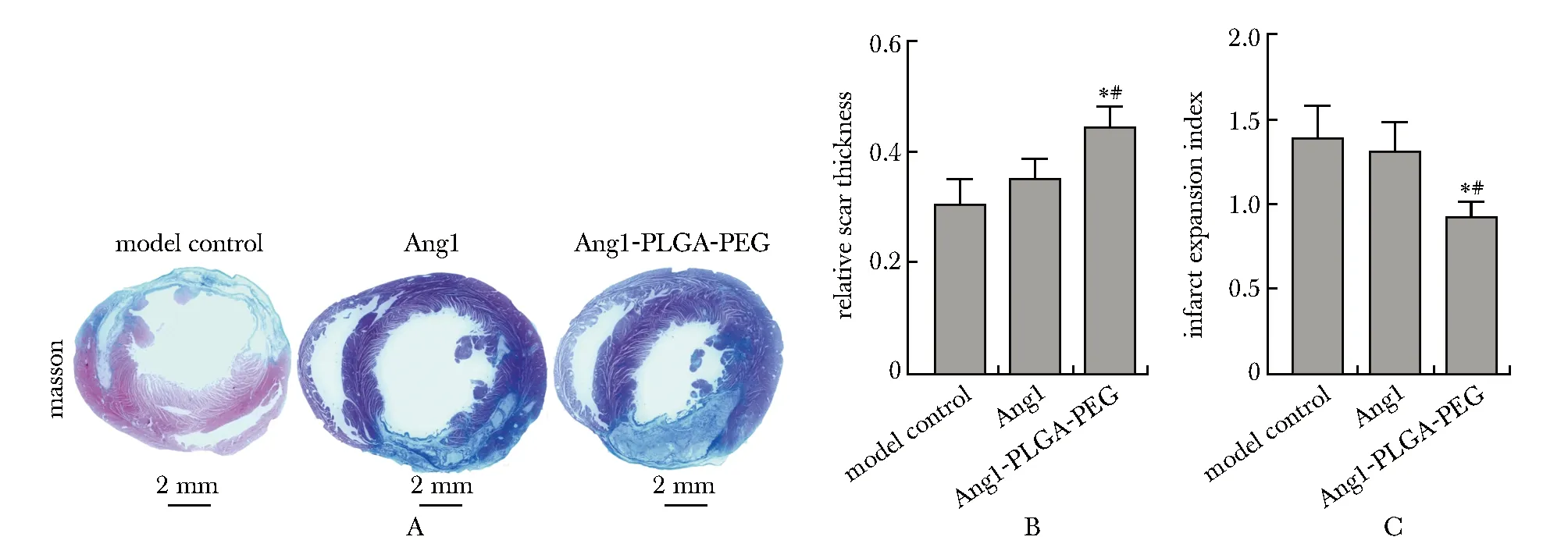
A.representative Masson’s trichrome staining,scale bars=2 mm;B.quantification of the relative scar thickness;C.infarct expansion index based on Masson’s trichrome staining;*P<0.05 compared with the model control group;#P<0.05 compared with Ang1 group;Ang1-PLGA-PEG.angiopoietin1 loaded in PLGA-PEG NPs图3 Masson染色检测瘢痕组织增生Fig 3 Scar tissue hyperplasia was detected by Morphological
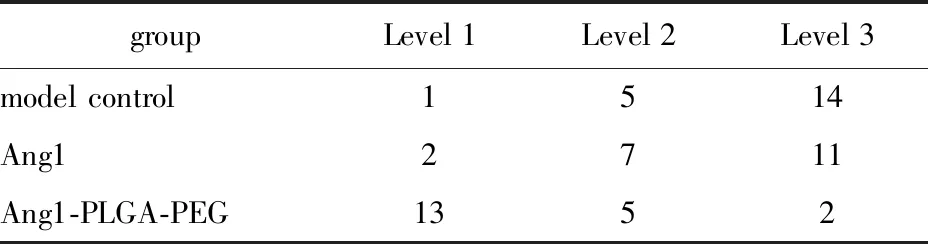
表1 梗死中心部位纤维结缔组织增生情况table 1 Proliferation of fibrosis in central area of myocardial infarction (×40,n=8)
2.4 免疫荧光染色检测细胞凋亡和血管形成
与模型组和Ang1组相比,Ang1-PLGA-PEG组血管形成较多且血管成熟指数更高(图4);而凋亡细胞数量显著减少(图5)。
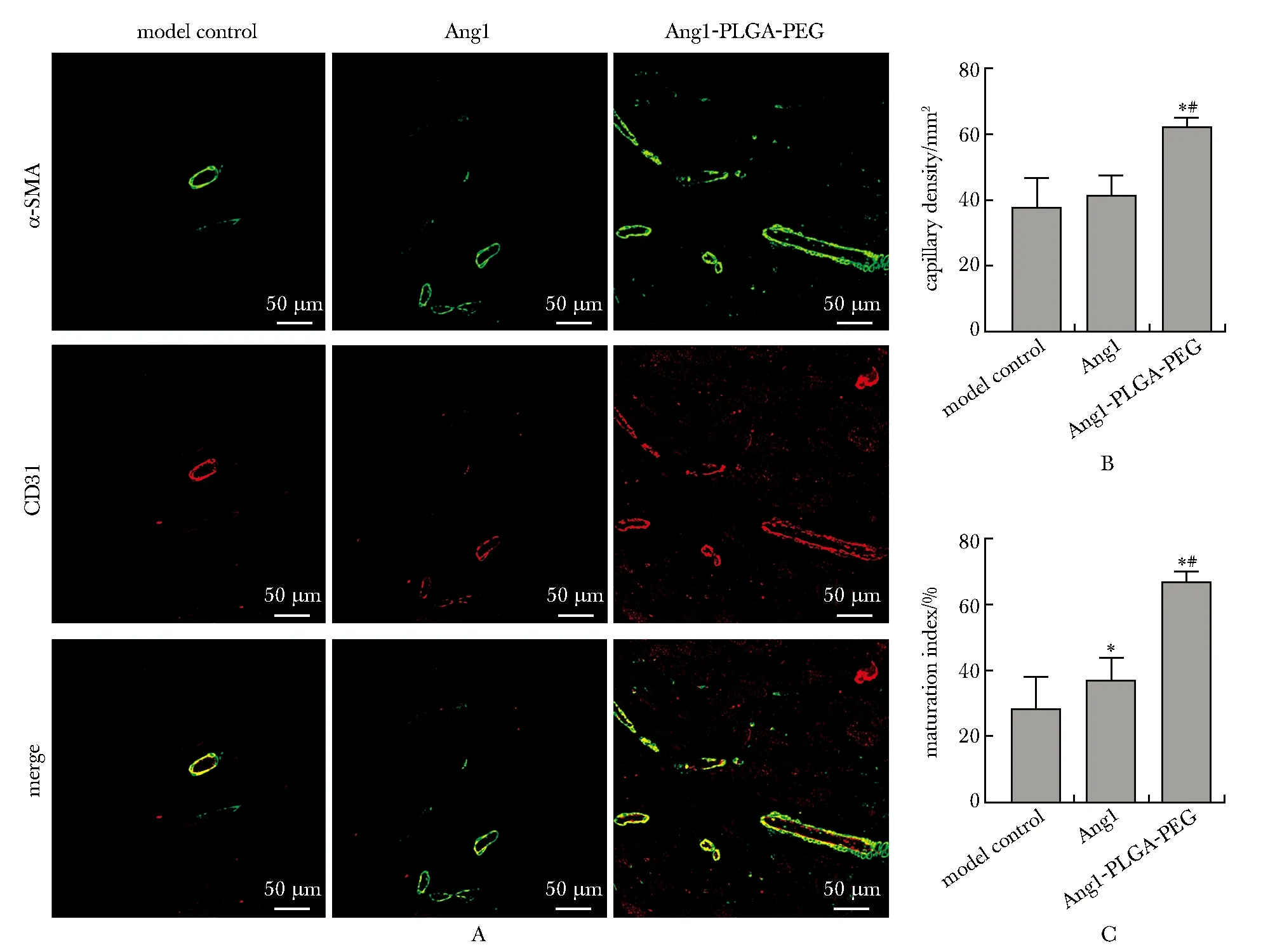
A.representative immunohistochemical staining of blood vessel in the peri-infarct myocardial tissue;CD31(red)and α-SMA (green)staining for the blood vessels;scale bars=50 μm;B.quantification of the capillary density;C.maturation index;*P<0.05 compared with the model control group;#P<0.05 compared with Ang1 group;Ang1-PLGA-PEG.angiopoietin1 loaded in PLGA-PEG NPs图4 血管形成的免疫荧光染色Fig 4 Immunofluorescence assessment of the
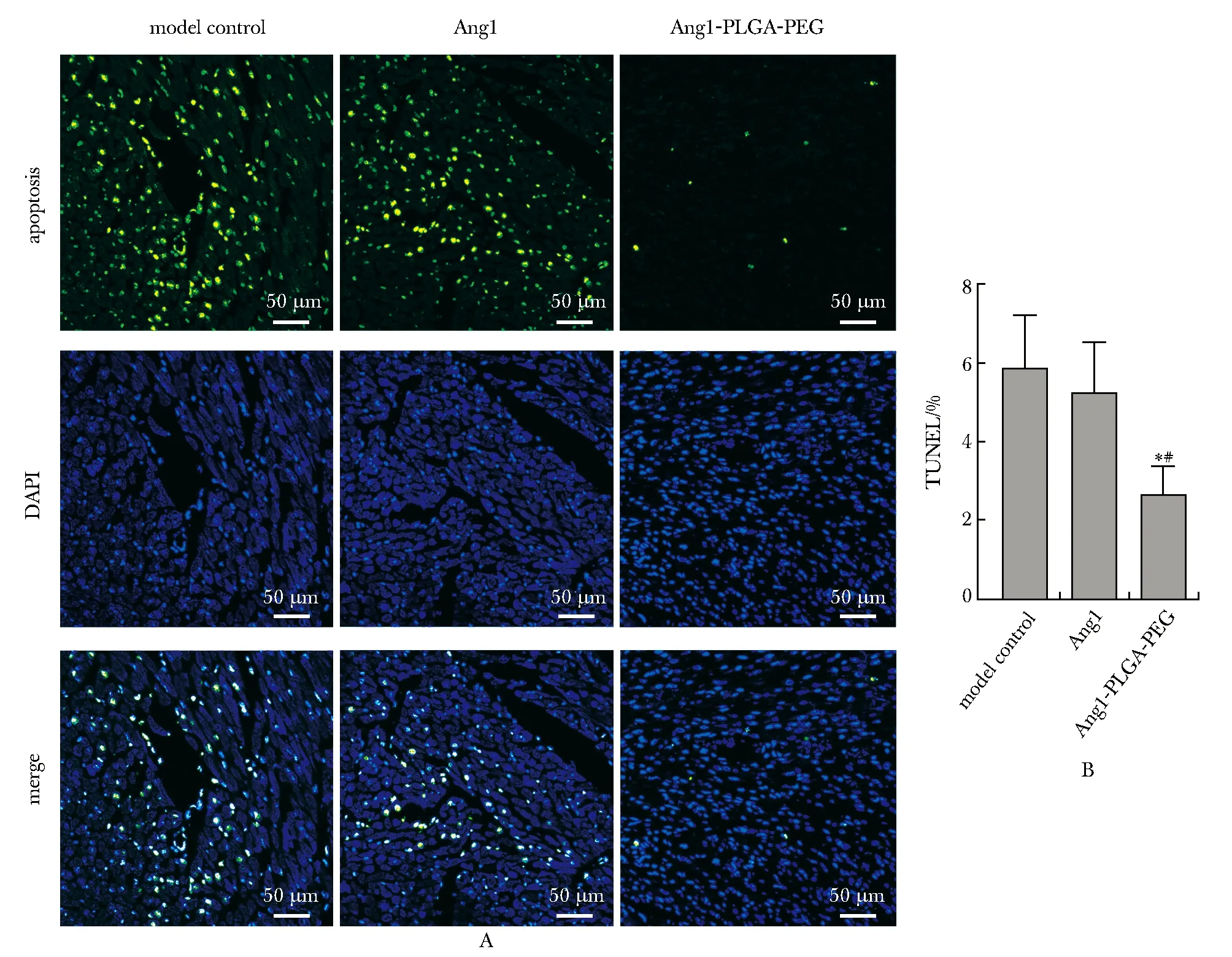
A.representative photomicrographs of TUNEL staining (green)and DAPI(blue)staining for the PEG-PLGA-Ang1 nanoparticles group,angiopoietin1 group,normal model control group in peri-infarct region,scale bars=50 μm;B.quantification of the percentage of TUNEL-positive nuclei;*P<0.05 compared with the model control group;#P<0.05 compared with Ang1 group;Ang1-PLGA-PEG.angiopoietin1 loaded in PLGA-PEG NPs图5 TUNEL检测心肌细胞凋亡Fig 5 Cardiomyocyte apoptosis was detected by
3 讨论
目前,心肌梗死的主要治疗方式有:溶栓、冠状动脉搭桥、支架植入等。尽管患者病死率已显著下降,生存率不断提高,但仍有部分患者经治疗后亦发生心力衰竭。局部注射促血管生成活性蛋白或干细胞改善梗死部位血液供应为一种新兴的治疗策略[11-12]。众所周知,Ang1是一种重要的促血管生成活性蛋白,在血管生成过程中具有重要作用。将Ang1搭载到PLGA-PEG纳米微粒中,使其缓慢、持续释放具有生物学活性的Ang1,以克服其半衰期短的局限性。
虽然Ang1组和Ang1-PLGA-PEG组在治疗后4周均增加了新生血管密度,但后者的程度明显更高,这种作用可能归因于Ang1与PLGA-PEG纳米微粒结合后,在同等剂量下能够长久、持续的作用于组织细胞。相对于Ang1组来说,Ang1-PLGA-PEG组不仅促进新生血管,而且诱导血管的成熟Ang1-PLGA-PEG组血管成熟指数高于Ang1以及单纯模型组。
TUNEL染色结果表明:Ang1-PLGA-PEG组仅有少量细胞凋亡,已经有效抑制心肌细胞凋亡。但Ang1组与模型组具有相似程度的大量细胞凋亡,可能Ang1组药物抑制细胞凋亡仅维持数分钟或数小时,这仍需要进一步验证。另外,诱导血管新生能够挽救受损的缺血组织并启动自我修复途径[13]。Ang1-PLGA-PEG纳米微粒诱导梗死心肌周围组织中血管密度及血管成熟度增加将减轻周围区域的局部缺血,通过向梗死区域输送更多的营养及氧气,这也增大其抑制细胞凋亡的效能。
心肌细胞凋亡后,纤维结缔组织增生以替代原有的心肌组织,导致心室病理性重塑的发生。Masson染色结果显示相对于其他两组,Ang1-PLGA-PEG纳米微粒可以有效减弱心室病理重塑。而且,病理性重塑会导致心肌组织中小动脉的减少,会加重组织缺血导致更多的心肌细胞凋亡这一恶性循环的发生。
心肌修复的目的在于恢复心脏功能,心脏彩超结果表明Ang1组与Ang1-PLGA-PEG组尽管在治疗4 周后都显示出LVEF增大、LVIDs及LVIDd减小,但以Ang1-PLGA-PEG组左室功能改善更加明显,更加有效防止左室功能恶化。
综上所述,Ang1-PLGA-PEG纳米微粒用于心肌梗死后局部心肌内注射,可以诱导血管形成、抑制心肌细胞凋亡及减轻心脏不良重塑从而改善心肌梗死后的心脏功能,对受损心脏起到一定程度的治疗和保护作用,为其临床应用增加了实验依据。

