circ_0005379通过调控miR-17-5p/酰基辅酶A氧化酶1轴抑制口腔鳞状细胞癌的发展进程
周海霞 王璐瑶 陈帅 王丹丹 方政
郑州大学第一附属医院口腔医学中心,郑州450052
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是常见的头颈部肿瘤之一,具有较高的发病率和死亡率。目前,OSCC的治疗取得了较大进步,但患者5年生存率依然较低。研究[1]表明,OSCC细胞的增殖、凋亡、迁移和侵袭在OSCC发生发展过程中起关键作用。因此,深入探讨OSCC发生发展的分子机制,可为该疾病的靶向治疗提供新途径。
环状RNA(circular RNA,circRNA)是一类在哺乳动物体内广泛存在的非编码RNA,其可作为微小RNA(microRNA,miRNA)“海绵体”吸附miRNA进而调控靶基因的表达,在肿瘤的发生发展中起重要作用[2]。研究[3-4]已表明,circ_102459、circ_043621和circ_PVT1等多种circRNA参与OSCC的发生发展过程,可作为OSCC治疗的分子靶点。circ_0005379是近年来新发现的一种circRNA,其对OSCC细胞恶性生物学行为的影响及机制还未明确。生物信息学软件预测显示,circ_0005379可能是miR-17-5p的“海绵体”,酰基辅酶A氧化酶1(acyl-CoA oxidase 1,ACOX1)可能是miR-17-5p的靶基因。研究[5]显示,放射线照射可促进OSCC细胞系OC3表达miR-17-5p,抑制miR-17-5p表达增强了OC3细胞的放射敏感性。ACOX1是脂肪细胞内与脂肪酸氧化相关的酶,与肿瘤发生发展密切相关。ACOX1在OSCC组织中表达降低,过表达ACOX1可抑制OSCC细胞的迁移和侵袭能力[6]。miR-17-5p能否靶向调控ACOX1表达影响OSCC细胞的恶性生物学行为也还未知。本研究检测了OSCC组织中circ_0005379、miR-17-5p和ACOX1蛋白表达水平,并以OSCC细胞SCC15为研究对象,miR-17-5p/ACOX1轴为切入点,观察了过表达circ_0005379对OSCC细胞增殖、凋亡、迁移和侵袭的影响及其调控机制,以期为OSCC的靶向分子治疗提供新途径。
1 材料和方法
1.1 临床资料
选取2017年1月—2018年12月于郑州大学第一附属医院口腔医学中心行手术治疗的51例OSCC患者为研究对象,其中男性29例,女性22例,平均年龄(58.34±7.95)岁。TNM分期Ⅰ和Ⅱ期23例,Ⅲ和Ⅳ期28例;高分化15例,中分化18例,低分化18例;淋巴结转移19例,未转移32例。对应癌旁组织为对照,病理检测未发现癌细胞。所有患者术前未进行放疗、化疗等治疗。研究经医院伦理委员会批准同意,患者或家属自愿签署知情同意书。
1.2 细胞和实验试剂
OSCC细胞系SCC15(中国科学院上海细胞库);正常口腔黏膜细胞HOK-16A(广州吉妮欧生物科技有限公司);胎牛血清(fetal bovine serum,FBS)、RPMI 1640培养基、四甲基噻唑蓝(methyl thiazolyl tetrazolium,MTT)、胰蛋白酶、LipofectamineTM2000试剂盒、二喹啉甲酸(bicinchoninicacid,BCA)蛋白检测试剂盒、膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡试剂盒和双荧光素酶活性检测试剂盒(北京索莱宝科技有限公司);逆转录试剂盒和聚合酶链反应(polymerase chain reaction,PCR)试剂盒(深圳晶美生物工程有限公司);Trizol试剂(Invitrogen公司,美国);鼠抗人ACOX1、上皮性钙黏附蛋白(E-cadherin)、β连环素(β-catenin)、Snail单克隆抗体(Abcam公司,美国);circ_0005379过表达载体(circ_0005379)、空载体(Vehicle)、miR-17-5p模拟物(mimics)、模拟对照序列(miRNC)(广州锐博生物科技有限公司);免疫组化试剂盒(福州迈新生物技术开发有限公司);PCR引物由上海生工生物工程有限公司设计并合成。
1.3 方法
1.3.1 细胞培养 用含10%FBS的RPMI 1640培养基培养SCC15细胞,培养箱环境:37℃、5%CO2、湿度97%。每2~3 d更换1次新鲜培养基。待细胞融合至80%时,吸弃培养基,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗细胞,0.25%胰蛋白酶消化,以1∶3比例进行传代培养。
1.3.2 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测基因表达 Trizol试剂提取组织或细胞中总RNA,微量核酸仪检测RNA的纯度和浓度。定量后,参照逆转录试剂盒说明书,将RNA逆转录为cDNA。逆转录总反应体系20μL,反应条件:42℃15 min,95℃3 min。然后以cDNA为模板进行RT-qPCR扩增,反应体系25μL,反应条件:95℃预变性60 s,95℃变性60 s,56℃退火30 s,72℃延伸30 s,共36次循环。引物序列如下。circ_0005379上游引物序列:5’-GCCCATACCTTTATCCACTC-3’,下游引物序列:5’-GTCAACATTCCAGTCTCTTCCT-3’;miR-17-5p上游引物序列:5’-TGCGGCAAAGTGCTTACAGTG-3’,下游引物序列:5’-CCAGTGCAGGGTCCGAGGT-3’;磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)上游引物序列:5’-ACATCGCTCAGACACCATGG-3’,下游引物序列:5’-GTAGTTGAGGTCAATGAAGGG-3’;U6上游引物序列:5’-TGCGGGTGCTCGCTTCGGCAGG-3’,下游引物序列:5’-CC AGTGCAGGGTCCGAGGT-3’。circ_0005379以GAPDH为内参,miR-17-5p以U6为内参,2-ΔΔCt法计算circ_0005379、miR-17-5p的相对表达水平。
1.3.3 细胞转染 对数增殖期的SCC15细胞接种于6孔板中,待细胞融合至60%时,更换不含FBS培养基。参照LipofectamineTM2000试剂盒说明书,分别将circ_0005379(circ_0005379组)、Vehicle(Vehicle组)、miR-17-5p mimics(miR-17-5p组)、miR-NC(miR-NC组)、circ_0005379与miR-17-5p(circ_0005379+miR-17-5p组)、circ_0005379与mi-R-NC(circ_0005379+miR-NC组)转染至细胞。转染48 h后,收集细胞用于后续实验。
1.3.4 MTT检测 细胞增殖转染后的各组细胞以每孔5×103个接种于96孔板中,每组设置3个复孔。培养箱中分别培养24、48和72 h后,每孔加入20μL浓度为5 g·L-1的MTT。继续孵育4 h后,吸弃培养基,加入150μL二甲基亚砜,振荡混匀,于酶标仪490 nm处测定定光密度(optical density,OD)值。实验重复3次,取平均值。
1.3.5 流式细胞术检测细胞凋亡 转染后的各组细胞以每孔2.5×104个接种于24孔板中,每组设置3个复孔。培养48 h后,胰蛋白酶消化,PBS清洗细胞。参照Annexin V-FITC/PI试剂盒说明书,取1.0×106个细胞,加入500μL结合缓冲液,使用移液器轻轻吹打,混悬细胞。加入10μL Annexin VFITC,涡旋混匀,室温避光反应10 min。加入5μL PI,涡旋混匀,室温避光反应5 min。涡旋混匀后上流式细胞仪检测细胞凋亡。
1.3.6 Transwell检测细胞的迁移和侵袭能力 转染后的各组细胞,调整浓度为每毫升5×104个。细胞迁移实验:Transwell上室加入100μL细胞悬液,下室加入500μL含FBS的培养基。培养48 h后,吸弃培养基,取出小室,PBS冲洗2次,棉签擦去上室上层细胞,小室置于4%甲醛中固定30 min。PBS冲洗,置于0.4%结晶紫溶液中染色15 min,PBS清洗至无染料残留。风干后,显微镜观察,随机选取5个视野计数。细胞侵袭实验:Transwell上室铺Matrigel基质胶,自然晾干后加入100μL细胞悬液,后续操作与细胞迁移实验相同。
1.3.7 Western blot法检测细胞中ACOX1、E-cadherin、β-catenin和Snail蛋白表达 细胞培养48 h后,RIPA试剂提取细胞中总蛋白,BCA蛋白试剂盒检测蛋白浓度。蛋白定量后取适量蛋白溶液于EP管中,100℃煮沸5 min,然后以每孔30μg蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳。电泳后,转至聚偏乙烯二氟膜,并置于5%脱脂奶粉中封闭2 h。洗膜后,分别置于ACOX1(1∶500)、Ecadherin(1∶1 000)、β-catenin(1∶500)、Snail(1∶500)和GAPDH(1∶1 000)抗体孵育液中,4℃孵育过夜。TBST洗膜后,置于加入辣根过氧化酶标记二抗(1∶2 000)孵育液中,37℃孵育1 h。洗膜后,加入电化学发光(electrochemiluminescence,ECL)显影液,避光显影后凝胶成像系统曝光拍照。以GAPDH为内参,Image J软件分析目的蛋白条带灰度值。
1.3.8 双荧光素酶报告基因实验 Starbase生物信息学软件预测显示,miR-17-5p与circ_0005379、ACOX1 3’UTR均存在连续的结合位点。PCR分别扩增circ_0005379、ACOX1与miR-17-5p的结合片段,并克隆至pmirGLO载体上,获得circ_0005379野生型质粒(circ_0005379-WT)及ACOX1野生型质粒(ACOX1-3’UTR-WT)。利用基因突变技术将结合位点突变后,获得circ_0005379突变型质粒(circ_0005379-MUT)及ACOX1突变型质粒(ACOX1-3’UTR-MUT)。然后采用LipofectamineTM2000试剂盒分别将野生型和突变型质粒与miR-17-5p mimics、miR-NC共转染至细胞。转染48 h后,收集细胞。参照双荧光素酶活性检测试剂盒操作说明,检测荧光素酶活性,结果以荧光虫活性/海肾荧光强度比值表示各组的荧光素酶活性。
1.3.9 裸鼠移植瘤实验 取对数生长期的SCC15细胞,转染circ_0005379稳定表达的慢病毒载体(circ_0005379组)和携带无义序列的慢病毒载体(Vehicle组),将2组细胞接种至裸鼠后腿皮下。自观察到肉眼可见的肿瘤时,每周用游标卡尺测量瘤体的长径(a)和短径(b),瘤体体积计算公式为:瘤体体积=a×b2/2。5周后,脱颈椎处死裸鼠,剥离肿瘤,PBS清洗后,滤纸吸干水分,称重。RT-qPCR检测肿瘤组织中circ_0005379和miR-17-5p表达水平,Western blot检测肿瘤组织中ACOX1蛋白表达水平,方法同1.3.2和1.3.7。
1.3.10 免疫组织化学染色检测异种移植肿瘤组织中ACOX1蛋白表达 移植瘤标本经4%甲醛固定,常规石蜡包埋后切片(厚度4μm)。常规脱蜡,苏木精-伊红(hematoxylin-eosin,HE)染色后,进行免疫组化染色。高压修复,0.3%过氧化氢封闭内源性过氧化物酶,ACOX1一抗浓度为1∶150,4℃过夜。二抗37℃孵育20 min,二氨基联苯胺(diaminobenzidine,DAB)显色,复染脱水透明中性树胶封片。结果判断:肿瘤细胞核出现黄色颗粒为ACOX1阳性。
1.4 统计学分析
利用SPSS 22.0软件对实验结果进行分析。符合正态分布的计量资料以均数±标准差表示。2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 circ_0005379在OSCC组织及细胞中的表达
与癌旁正常组织比较,OSCC组织中circ_0005379表达降低(P<0.05)(图1左)。与HOK-16A细胞比较,SCC15细胞中circ_0005379表达降低(P<0.05)(图1右)。
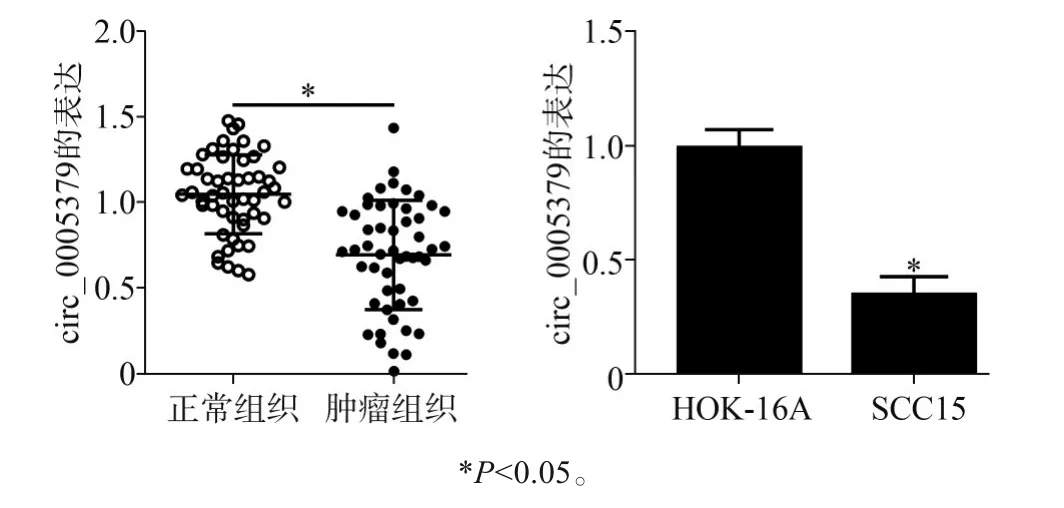
图1 circ_0005379在OSCC组织(左)及细胞系(右)中的表达Fig 1 The expression of circ_0005379 in OSCC tissues(left)and cell lines(right)
2.2 过表达circ_0005379对SCC15细胞增殖、凋亡、迁移和侵袭的影响
与Vehicle组比较,circ_0005379组细胞中circ_0005379表达升高(P<0.05),表明过表达circ_0005379的SCC15细胞构建成功。与Vehicle组比较,circ_0005379组细胞活性、迁移和侵袭细胞数及β-catenin和Snail蛋白表达降低(P<0.05),凋亡率和E-cadherin蛋白表达升高(P<0.05)(图2)。
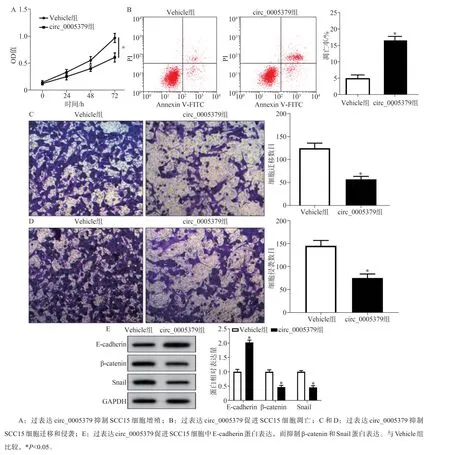
图2 过表达circ_0005379对SCC15细胞增殖、凋亡、迁移和侵袭的影响Fig 2 Theeffect of overexpression of circ_0005379 on theproliferation,apoptosis,migration and invasion of SCC15 cells
2.3 circ_0005379靶向结合并调控miR-17-5p表达
Starbase生物信息学软件预测结果显示,circ_0005379与miR-17-5p核苷酸序列存在连续的结合位点。双荧光素酶报告基因实验结果显示,miR-17-5p与circ_0005379-WT共转染后的SCC15细胞荧光素酶活性降低(P<0.05),而与circ_0005379-MUT共转染后SCC15细胞荧光素酶活性无显著变化(P>0.05)(图3A)。与癌旁组织比较,OSCC组织中miR-17-5p表达升高(P<0.05)(图3B)。与HOK-16A细胞比较,SCC15细胞中miR-17-5p表达升高(P<0.05)(图3C)。与Vehicle组比较,circ_0005379组细胞中miR-17-5p表达水平降低(P<0.05)(图3D)。
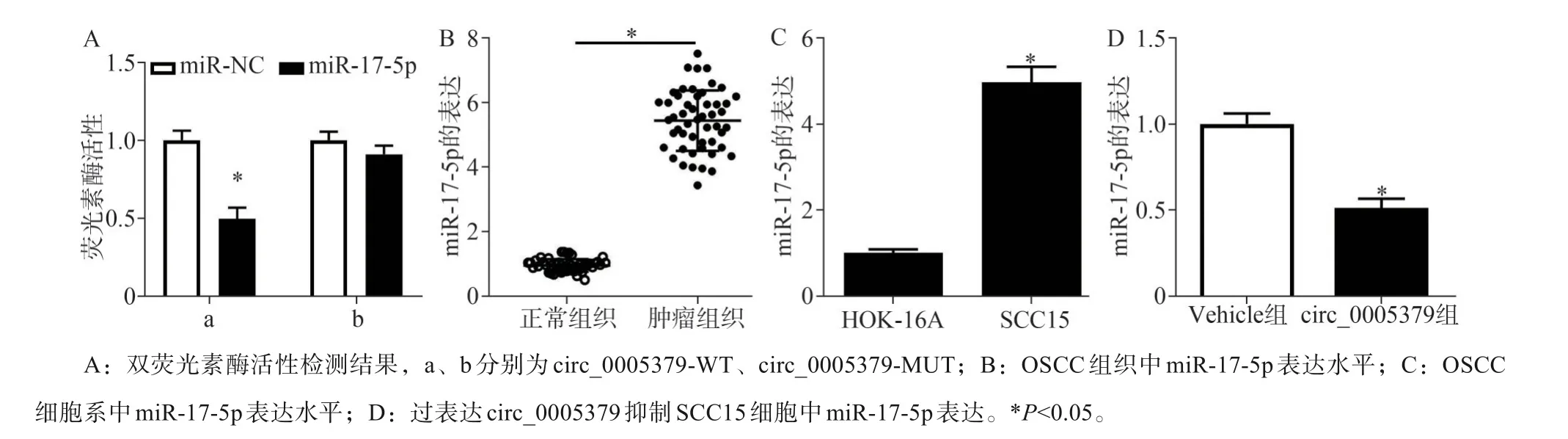
图3 circ_0005379靶向结合并调控miR-17-5p表达Fig 3 circ_0005379 targets and regulates the expression of miR-17-5p
2.4 过表达miR-17-5p逆转过表达circ_0005379对SCC15细胞增殖、凋亡、迁移和侵袭的影响
与miR-NC组比较,miR-17-5p组SCC15细胞中miR-17-5p表达水平升高(P<0.05)(图4)。与circ_0005379+miR-NC组比较,circ_0005379+miR-17-5p组SCC15细胞活性、迁移和侵袭细胞数及β-catenin和Snail蛋白表达水平升高(P<0.05),凋亡率和E-cadherin蛋白表达水平降低(P<0.05)(图4)。
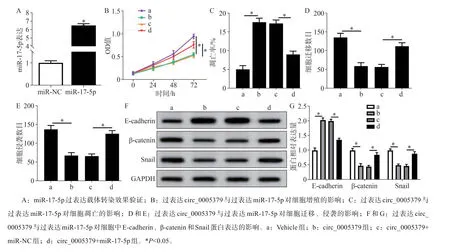
图4 过表达miR-17-5p逆转过表达circ_0005379对细胞增殖、凋亡、迁移和侵袭的影响Fig 4 Overexpression of miR-17-5p reverses the effect of overexpression of circ_0005379 on the proliferation,apoptosis,migration and invasion of SCC15 cells
2.5 miR-17-5p靶向调控ACOX1表达
Starbase生物信息学软件预测结果显示,miR-17-5p与ACOX1的3’UTR存在连续结合位点(图5A)。双荧光素酶报告基因实验结果显示,miR-17-5p与ACOX1-3’UTR-WT共转染后细胞荧光素酶活性降低(P<0.05),而与ACOX1-3’UTR-MUT共转染后的SCC15细胞荧光素酶活性无显著变化(P>0.05)(图5B)。与癌旁组织比较,OSCC组织中ACOX1蛋白表达降低(P<0.05)(图5C)。与HOK-16A细胞比较,SCC15细胞中ACOX1蛋白表达降低(P<0.05)(图5D)。与miR-NC组比较,miR-17-5p组SCC15细胞中ACOX1蛋白表达降低(P<0.05)(图5E)。与Vehicle组比较,circ_00053-79组细胞中ACOX1蛋白表达升高(P<0.05);与circ_0005379+miR-NC组比较,circ_0005379+miR-17-5p组SCC15细胞中ACOX1蛋白表达降低(P<0.05)(图5F)。

图5 miR-17-5p靶向并负调控ACOX1表达Fig 5 miR-17-5p targetsand negatively regulatestheexpression of ACOX1
2.6 裸鼠移植瘤实验结果
与Vehicle组比较,circ_0005379组肿瘤体积和重量降低(P<0.05),肿瘤组织中circ_0005379和ACOX1蛋白表达水平升高(P<0.05),miR-17-5p表达水平降低(P<0.05)(图6)。免疫组织化学染色显示,ACOX1在circ_0005379过表达的异种移植肿瘤组织中表达升高(P<0.05)(图6)。

图6 过表达circ_0005379抑制裸鼠移植瘤生长Fig 6 Overexpression of circ_0005379 inhibits thegrowth of transplanted tumors in nudemice
3 讨论
circRNA呈闭合环状结构,具有高度的保守性和稳定性,在肿瘤等多种疾病中异常表达,有望成为新的诊断及预测肿瘤发生发展的生物标志物[7]。目前,已报道有多种circRNA在OSCC中异常表达,参与OSCC发生发展。Zhu等[8]研究显示,circ_100533在OSCC组织和细胞系中表达降低,其作为miRNA海绵与miR-933结合上调GNAS表达,进而抑制OSCC细胞增殖、迁移,并促进细胞凋亡,可能是OSCC诊断生物标志物和有效治疗靶标。Gao等[9]研究显示,OSCC组织和细胞系中circ_PKD2表达降低,circ_PKD2过表达其作为miR-204-3p的海绵上调腺瘤性息肉病大肠杆菌2(APC2)表达,抑制OSCC细胞增殖、迁移和侵袭,诱导细胞凋亡和细胞周期停滞,可作为OSCC的新型治疗靶点。circ_0005379是近年来新发现的一种circRNA,其在OSCC中的作用机制还未明确。本研究显示,circ_0005379在OSCC组织和细胞系中表达降低,过表达circ_0005379可降低OSCC细胞的增殖、迁移和侵袭能力,并诱导细胞凋亡,与相关研究[10]结果一致,提示circ_0005379可能作为抑癌基因抑制OSCC的发展进程,是OSCC治疗的潜在靶点。
circRNA可作为竞争性内源RNA(ceRNA)的组成部分,抑制miRNA的活性,从而调控靶基因转录、翻译等功能[11]。生物信息学软件预测显示,circ_0005379可能是miR-17-5p的海绵,通过吸附miR-17-5p调控其表达。研究[12-14]显示,miR-17-5p在结直肠癌、鼻咽癌、多发性骨髓瘤等肿瘤中表达升高,下调其表达可抑制肿瘤细胞的恶性生物学行为。为了进一步探讨过表达circ_0005379发挥抗OSCC作用的机制,本研究通过双荧光素酶报告基因实验和RNA免疫共沉淀实验证实了circ_0005379在OSCC细胞中可与miR-17-5p结合,且过表达circ_0005379后,OSCC细胞中miR-17-5p表达水平降低,说明circ_0005379可吸附miR-17-5p并下调其表达,这也与circ_0005379在OSCC组织和细胞中呈低表达,而miR-17-5p呈高表达的结果一致。本研究还显示,过表达miR-17-5p可逆转过表达circ_0005379对OSCC细胞增殖、迁移和侵袭的抑制作用及凋亡诱导作用,提示过表达circ_0005379通过下调细胞中miR-17-5p表达来发挥抗OSCC作用。
ACOX1参与脂肪酸氧化,是过氧化物酶体脂肪酸-β氧化第一步脱氢反应的限速酶。研究[15-16]已表明,ACOX1在乳腺癌和胰腺导管腺癌等肿瘤中表达降低,参与肿瘤发生发展。本研究显示,OSCC组织和细胞系中ACOX1呈低表达,提示ACOX1可能作为抑癌基因参与该疾病的发生发展。生物信息学软件预测显示,ACOX1可能是miR-17-5p的靶基因。本研究通过双荧光素酶报告基因实验和RNA免疫共沉淀实验证实了miR-17-5p可与ACOX1靶向结合。此外,过表达miR-17-5p可降低OSCC细胞中ACOX1蛋白表达,证实了miR-17-5p靶向负调控ACOX1表达。本研究还显示,沉默circ_0005379表达可降低OSCC细胞中ACOX1蛋白表达,进一步说明circ_0005379通过竞争性吸附miR-17-5p上调ACOX1表达来抑制OSCC细胞恶性生物学行为,发挥抗OSCC作用。通过皮下注射稳定过表达circ_0005379的OSCC细胞建立裸鼠移植瘤模型,结果显示,过表达circ_0005379可抑制裸鼠肿瘤生长,且肿瘤组织中miR-17-5p表达水平降低,而ACOX1蛋白表达水平升高,提示circ_0005379通过吸附miR-17-5p而上调ACOX1表达抑制裸鼠肿瘤生长。
综上所述,circ_0005379在OSCC组织和细胞中呈低表达,其可能通过竞争性吸附miR-17-5p进而促进ACOX1表达来降低OSCC细胞的增殖、迁移和侵袭,并诱导细胞凋亡及抑制肿瘤生长,其可能是OSCC治疗的分子靶点。
利益冲突声明:作者声明本文无利益冲突。

