蒿本内酯介导PI3K/AKT/mTOR信号通路对脑缺血再灌注损伤大鼠的神经保护机制研究
崔江波,杨静,王培福,张绿明,韩柏林,杜继臣
(1.北京大学航天临床医学院;2.航天中心医院神经内科,北京 100049)
脑缺血指的是大脑血流量不足以满足新陈代谢需求,进而导致脑缺氧、脑组织死亡、脑梗死或缺血性脑卒中的现象[1]。脑缺血是一种发病率和死亡率高的常见病,与脑血管病有关,缺血性脑血管病占总脑血管病的70%[2]。尽管脑缺血后血液再灌注对于减轻脑功能障碍和脑损伤至关重要,但有时也会加重脑损伤[3]。因此,脑缺血再灌注损伤的防治在缺血性脑血管病的治疗中有着十分重要的意义。然而,脑缺血再灌注损伤的确切发病机制尚不清楚。研究[4]表明缺血性脑损伤涉及多种因素,包括细胞凋亡、酸中毒、离子失衡、兴奋性毒性、氧化应激以及炎症等。此外,包括磷酸肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白质丝氨酸苏氨酸激酶(protein-serine-threonine kinase,Akt)/哺乳动物的雷帕霉素(mammalian target of rapamycin,mTOR)信号通路在内的多种信号通路也参与了脑缺血再灌注损伤的发病机制[5]。蒿本内酯是我国传统中药当归和川芎的生物活性成分,可改善血液循环及调节免疫[6]。另有报道[7]表明,蒿本内酯具有明显的抗炎作用,对脑缺血再灌注损伤起神经保护作用。基于此,本研究拟建立脑缺血再灌注损伤大鼠模型,通过基于PI3K/Akt/mTOR信号通路分析蒿本内酯对脑缺血再灌注损伤神经保护作用的具体机制,旨在为脑缺血再灌注损伤临床治疗提供可靠根据。
1 材料与方法
1.1 实验动物
健康、清洁级别的SD雄性大鼠由斯贝福(北京)生物技术有限公司提供,体重为230~250 g,许可证号:SCXK(京)2019-0010。大鼠均适应性喂养于标准实验室中,温度控制为(21±2)℃,相对湿度控制为(50±5)%,给予12 h光处理/暗处理交替,使大鼠自由摄食、饮水。
1.2 药品与试剂
蒿本内酯(成都普瑞法科技开发有限公司,纯度>98%);PI3K抑制剂LY294002(美国MCE公司,货号HY-10108);组织蛋白裂解液、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);10%水合氯醛、4%多聚甲醛、TUNEL细胞凋亡试剂盒(北京鼎国生物制品公司);反转录试剂盒、SYBR溶液(TaKaRa,货号分别为:RR047A、DRR420A);兔抗大鼠PI3K、Akt、p-PI3K、p-Akt、mTOR、p-mTOR一抗(美国CST公司,货号分别为:4249、4691、17366、4060、2983、5536);HRP标记的羊抗兔IgG二抗(北京博尔迈生物技术有限公司)。
1.3 方法
1.3.1 大鼠局灶性脑缺血(middle cerebral arteryocclusion,MCAO)再灌注损伤模型制备 采用改良大脑中动脉线栓法制作大鼠MCAO再灌注损伤模型[8]。首先,腹腔注射10%的水合氯醛(3 mL/kg),使得大鼠麻醉,麻醉72 h;接着将大鼠仰卧位固定,将其颈部毛发剪除干净,于颈部旁正中线作切口,使其颌下腺体钝性分离,并分离出右侧颈总动脉和分支颈外动脉、颈内动脉,缝合分支颈外动脉,用血管夹夹闭颈内动脉,并用显微剪在颈总动脉主干上剪出一个小口,插入鱼线线栓,取出血管夹,将线栓向里推进,直到标记点时遇到阻力则停下,此时线栓头端已通过大脑中动脉根部,可阻塞右侧大脑中动脉血流;剪断线栓,还原颌下腺,缝合皮肤,使用有生理盐水的纱布覆盖切口;待大鼠脑缺血2 h后,将缝合线剪开,并缓慢将线栓取出,扎紧结扎线,使其大鼠右侧大脑中动脉血流恢复2 h,进而实现脑缺血再灌注,缝合皮肤,观察大鼠直至其麻醉清醒后,将其放回鼠笼。参照神经行为学评分[8]对建模后的大鼠进行评估,评分1~3分表示建模成功。将建模成功的大鼠随机分为4组:假手术组、模型组、蒿本内酯组和蒿本内酯+PI3K抑制剂LY294002组,每组各10只。脑缺血再灌注后1 h,蒿本内酯组予以蒿本内酯(20 mg/kg)静脉注射,蒿本内酯+LY294002组予以蒿本内酯(20 mg/kg)+LY294002(20 nM/mL)静脉注射,假手术组和模型组予以等量生理盐水,持续7 d。
1.3.2 神经行为学评分 末次给药24 h后,对各组大鼠进行神经行为学评分。正常,无神经功能损伤记为0分;左前爪无法完全舒展,轻度受损记为1分;行走时往对侧转圈,中度损伤记为2分;行走时往对侧倾倒,记为3分;无法自发行走,丧失意识记为4分。
1.3.3 脑梗死体积测定 采用10%的水合氯醛(3 mL/kg)对各组大鼠进行腹腔注射,将其胸部皮肤剪开,暴露其心脏,夹闭下腔静脉,将大鼠右心耳剪开,断头取脑;取脑组织切成2 mm切片,并置入2%的TTC中,放入37 ℃恒温箱中,30 min后取出置入4%的多聚甲醛中,固定,24 h后拍照,并使用Image pro软件对大鼠脑梗死体积进行测定[9]。
1.3.4 TUNEL法 取脑组织固定24 h,脱水,进行石蜡包埋;常规脱蜡,滴加50 μL无DNase蛋白酶K(20 μg/mL),放入37 ℃恒温箱中孵育30 min,PBS清洗3次,各5 min;加入50 μL的TUNEL检测仪,放入37 ℃恒温箱中孵育60 min,PBS清洗3次,各5 min;使用抗荧光淬灭封片液在显微镜下进行观察,计算TUNEL阳性细胞数。
1.3.5 RT-PCR检测凋亡相关因子表达 取各组大鼠脑组织彻底匀浆,加入1 mL Trizol溶液,设置离心机参数为4 ℃、12 000 rpm,离心5 min;取上清,加入300 μL氯仿,室温静置5 min,4 ℃、12 000 rpm条件下离心15 min;取上清,加入等体积异丙醇,室温静置10 min,4 ℃、12 000 rpm条件下离心10 min;弃上清,留下白色沉淀,加入1 mL的75%的乙醇洗涤沉淀,4 ℃、12 000 rpm条件下离心5 min,弃上清,风干沉淀;加入20 μL的DEPC水,得到RNA样品,于酶标仪上测定260/280比值;反转录得到cDNA,设计引物,进行RT-PCR扩增,扩增条件为:95 ℃,5 min,预变性;95 ℃,15 s,变性,60 ℃,30 s,延伸,40个循环。以GAPDH为内参,运用2-ΔΔCt法计算各组大鼠凋亡相关因子mRNA相对表达量。各引物序列如下,GAPDH:上游引物5’-GGA GCG AGA TCC CTC CAA AAT-3’,下游引物5’-GGC TGT TGT CAT ACT TCT CAT GG-3’,扩增片段大小为204bp;Bcl2:上游引物5’-AGG ATT GTG GCC TTC TTT GA-3’,下游引物5’-CAG ATG CCG GTT CAG GTA CT-3’,扩增片段大小为171bp;Bax:上游引物5’-GCT GGA CAC TGG ACT TCC TC-3’,下游引物5’-ACT CCA GCC ACA AAG ATG GT-3’,扩增片段大小为bp195;caspase3:上游引物5’-TGC CAG AAG ATA CCA GTG GA-3’,下游引物5’-TGA CTG GAT GAA CCA TGA CC-3’,扩增片段大小为228 bp。
1.3.6 Western blot检测凋亡相关因子和PI3K/Akt/mTOR信号通路蛋白表达 取各组大鼠脑组织彻底匀浆,加入组织裂解缓冲液裂解组织,设置离心机参数为4 ℃、15 000 rpm,离心15 min,提取各组大鼠脑组织总蛋白,并采用BCA法测定脑组织蛋白浓度;进行Western blot蛋白检测,配制分离胶和浓缩胶,开始电泳,根据蛋白大小切取相应的胶,并裁剪相应大小的PVDF膜,以三明治方式组装,采用100 V、90 min进行转膜,封闭,加入用抗体稀释液稀释过的一抗[Bcl2(1∶500)、Bax(1∶500)、caspase3(1∶500)、PI3K(1∶500)、AKT(1∶500)、mTOR(1∶2 000)、p-PI3K(1∶500)、p-AKT(1∶500)、p-mTOR(1∶4 000)、GAPDH(1∶1 000)]置于4 ℃孵育过夜、加入用抗体稀释液稀释过的二抗[HRP标记的羊抗兔IgG(1∶2 000)]置于室温杂交90 min,向膜上滴加适量ECL化学发光液进行显色,于曝光仪中成像,并使用Image J软件分析所扫描的图像,具体操作步骤为:将所得条带图像转换成灰度图像,再将条带变成亮色,背景变成暗区,沿目标条带边缘画线,并将目标条带圈起,重复3次,取3次平均数,进而得到目标条带的平均灰度值。
1.4 统计学分析
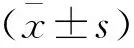
2 结果
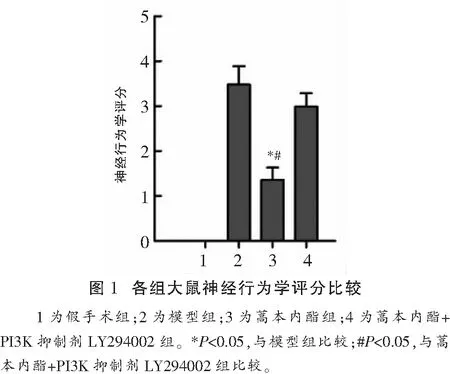
2.1 蒿本内酯对大鼠脑缺血再灌注损伤后神经行为学的影响
假手术组神经元细胞无损伤,未见明显神经行为学异常,神经行为学评分为0分,蒿本内酯组神经行为学评分[(1.36±0.27)分]低于模型组和蒿本内酯+PI3K抑制剂LY294002组[(3.48±0.41)分、(2.99±0.30)分](t=13.656,P<0.001;t=12.771,P<0.001)。见图1。
2.2 蒿本内酯对大鼠脑缺血再灌注损伤后脑梗死体积的影响
TTC染色显示,蒿本内酯组脑梗死体积比值[(15.96±2.01)%]低于模型组和蒿本内酯+PI3K抑制剂LY294002组[(47.53±3.48)%、(42.68±3.67)%](t=24.842,P<0.001;t=20.193,P<0.001)。见图2。
2.3 蒿本内酯对大鼠脑缺血再灌注损伤后细胞凋亡的影响
光镜下可见模型组有大量TUNEL阳性细胞,细胞核呈棕黄色,核细胞固缩,蒿本内酯组大鼠海马半缺血区细胞凋亡明显改善,其阳性细胞数低于模型组和蒿本内酯+PI3K抑制剂LY294002组(t=17.287,P<0.001;t=14.093,P<0.001)。见图3。
2.4 蒿本内酯对大鼠脑缺血再灌注损伤后脑组织中凋亡相关因子表达的影响
RT-PCR结果显示,蒿本内酯组大鼠脑组织中凋亡相关因子Bcl2mRNA水平高于模型组和蒿本内酯+PI3K抑制剂LY294002组(t=4.824,P<0.001;t=3.239,P=0.005),Bax、caspase3 mRNA水平低于模型组和蒿本内酯+PI3K抑制剂LY294002组(t=28.315,P<0.001;t=23.973,P<0.001;t=30.631,P<0.001;t=38.625,P<0.001);Western blot结果显示,蒿本内酯组大鼠脑组织中凋亡相关因子Bcl2蛋白表达高于模型组和蒿本内酯+PI3K抑制剂LY294002组(t=14.406,P<0.001;t=10.304,P<0.001),Bax、caspase3蛋白表达低于模型组和蒿本内酯+PI3K抑制剂LY294002组(t=6.667,P<0.001;t=7.060,P<0.001;t=13.739,P<0.001;t=13.953,P<0.001)。见图4。
2.5 蒿本内酯对大鼠脑缺血再灌注损伤后脑组织中PI3K/AKT/mTOR信号通路的影响
Western blot结果显示,蒿本内酯组大鼠脑组织中p-PI3K、p-AKT、p-mTOR蛋白表达高于模型组和蒿本内酯+PI3K抑制剂LY294002组(t=12.067,P<0.001;t=11.315,P<0.001;t=14.977,P<0.001;t=17.834,P<0.001;t=6.396,P<0.001;t=5.918,P<0.001)。见图5。
3 讨论
缺血性脑血管病是一种由脑血管血流不足引起的疾病,是一种致残性和致命性的疾病,男性死亡率高于女性[9]。在缺血性脑血管病的治疗中,缺血区域血流重建或血供增强是缺血性脑组织修复的关键,但同时也存在再灌注损伤的问题[10]。因此,迫切需要寻找新的治疗方法以保护患者神经功能,改善缺血性脑血管病患者预后。不断有研究从细胞和分子水平上阐明了脑缺血再灌注损伤的发病机制,包括氧自由基的大量产生、炎症损伤、自噬以及细胞凋亡等,这都将有助于寻找新的治疗方法[11]。
蒿本内酯是从中草药当归和川芎中分离出来的生物活性成分,具有明显的抗炎、镇痛功效,被广泛用于治疗心脑血管疾病[12]。有研究[13]显示,蒿本内酯可改善线粒体功能,恢复突触结构,改善APP/PS1转基因小鼠记忆功能障碍,可作为一种潜在的抗痴呆药物。本研究发现,蒿本内酯可显著改善脑缺血再灌注损伤大鼠神经行为学评分和脑梗死体积比值,表明蒿本内酯对脑缺血再灌注损伤大鼠具有较好的保护作用。细胞凋亡是一种基因控制的自主细胞死亡过程,也称为生理条件下的程序性细胞死亡,是维持内环境稳定的机制之一[14]。Qian等[15]表明,神经元细胞凋亡是脑缺血再灌注后继发性神经元死亡的基本形式。本研究发现,蒿本内酯组细胞凋亡阳性细胞数低于模型组和蒿本内酯+PI3K抑制剂LY294002组,凋亡相关因子Bcl2 mRNA蛋白表达高于模型组和蒿本内酯+PI3K抑制剂LY294002组,Bax、caspase3 mRNA和蛋白表达低于模型组和蒿本内酯+PI3K抑制剂LY294002组,表明蒿本内酯可有效抑制脑缺血再灌注损伤大鼠神经细胞凋亡,减轻神经损伤。蒿本内酯在脑缺血再灌注损伤中具有抗凋亡活性,抑制神经元凋亡可能是蒿本内酯保护脑缺血再灌注损伤大鼠神经功能的机制之一。
PI3K/Akt/mTOR在信号通路中起着至关重要的作用,参与了细胞代谢、生长、增殖和存活的调控[16]。PI3K活化之后,可磷酸化下游Akt和p-Akt,激活mTOR,最终调节细胞存活、增殖、分化和迁移[17]。Zhu等[18]指出,PI3K/Akt/mTOR信号通路可对缺血缺氧性脑损伤患儿发挥神经保护作用。本研究发现,蒿本内酯处理后大鼠脑组织中p-PI3K、p-AKT、p-mTOR蛋白表达明显上调,而予以PI3K抑制剂LY294002处理后,p-PI3K、p-AKT、p-mTOR蛋白表达明显下调,表明蒿本内酯对脑缺血再灌注损伤大鼠的神经保护作用可能是通过激活PI3K/Akt/mTOR信号通路而抑制神经元细胞凋亡。Tu等[19]也表明,PI3K/Akt/mTOR信号通路的激活可发挥对脑缺血再灌注损伤原代海马神经元的保护作用。同样,Yu等[20]研究也显示,提高Akt和mTOR磷酸化水平可抑制脑缺血再灌注损伤大鼠神经细胞凋亡,而使用LY294002阻断PI3K后,可明显降低Akt和mTOR磷酸化水平,降低PI3K的抗凋亡作用。李振等[7]认为,蒿本内酯可能是通过抑制NF-kB信号通路的激活而发挥对脑出血大鼠的神经保护作用。但蒿本内酯对脑缺血再灌注损伤大鼠神经保护作用机制有待进一步分析研究。
综上所述,蒿本内酯可有效改善脑缺血再灌注损伤大鼠神经损伤,抑制大鼠神经细胞凋亡,具有神经保护作用,该作用机制可能与激活PI3K/AKT/mTOR信号通路有关。蒿本内酯可能会为脑缺血再灌注损伤的防治带来全新方向,但蒿本内酯对脑缺血再灌注损伤大鼠的神经保护作用机制仍有待更多的体内和体外实验研究给予证明。

